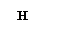Так как электронное строение элементов изменяется периодически, то соответственно периодически изменяются и свойства элементов, определяемые их электронным строением, такие как энергия ионизации, размеры атомов, окислительно-восстановительные и другие свойства. В данном параграфе рассмотрена лишь периодичность энергии ионизации, сродства к электрону, электроотрицательности и размеров атомов. Периодичность других свойств будет рассмотрена позднее.
Энергия ионизации. Энергия, необходимая для удаления одного моля электронов от одного моля атомов какого либо элементa, называется первой энергией ионизации 11. В результате ионизации атомы превращаются в положительно заряженные ионы. Энергию ионизации выражают либо в килоджоулях на моль (кДж/моль), либо в электронвольтах (эВ).
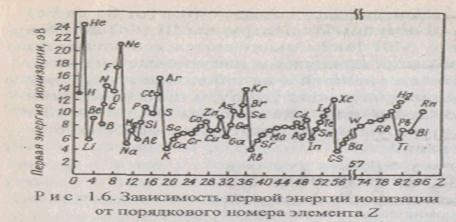
Энергия ионизации характеризует восстановительную способность элемента. Первая энергия ионизации определяется электронным строением элементов, и ее изменение имеет периодический характер. Энергия ионизации возрастает по периоду. Наименьшие значения энергии ионизации имеют щелочные элементы, находящиеся в начале периода, наибольшими значениями энергии ионизации характеризуются благородные газы, находящиеся в конце периода. Пики на кривой зависимости энергии ионизации от порядкового номера элемента наблюдаются у элементов с законченной s-подоболочкой (Be, Mg) и d -подоболочкой (Zn, Cd, Hg), и р- подоболочкой, в АО которой находится по одному электрону (N, P, As). Минимумы на кривой наблюдаются у элементов, имеющих на внешней подоболочке по одному электрону (щелочные металлы, В, Al, Ga, In).
В одной и той же группе энергия ионизации несколько уменьшается с увеличением порядкового номера элемента, что обусловлено увеличением размеров атомов и расстояния, внешних подоболочек от ядра.
Кроме первой энергии ионизации, элементы с многоэлектронными атомами могут характеризоваться второй 12, третьей /3 и более высокой энергией ионизации, которые равны соответственно энергии отрыва молей электронов от молей ионов Э+, Э2+ и т. д. При этом энергии ионизации возрастают с увеличением их номеров, т.е. 11<12< /3. Особенно резкое увеличение ионизации наблюдается при отрыве электронов из заполненной подоболочки.
Сродство к электрону. Энергетический эффект присоединения моля электронов к молю нейтральных атомов называется сродством к электрону. Например:
Э + е= Э".
Сродство к электрону Еср количественно выражается в кДж/моль или эВ. Сродство к электрону зависит от положения элемента в периодической системе. Наибольшие значения сродства к электрону имеют галогены, кислород, сера, наименьшие и даже отрицательные значения ее — элементы с электронной конфигурацией s2 (He, Be, Mg, Zn), с полностью или наполовину заполненными p-подоболочками (Ne, Ar, Кr, N, P, As).
Электроотрицательность. Для характеристики способности атомов в соединениях притягивать к себе электроны введено понятие электроотрицательности (ЭО). Учитывая, что эта способность атомов зависит от типа соединений, валентного состояния элемента, эта характеристика имеет условный характер. Однако ее использование полезно для объяснения типа химических связей и свойств соединений.
Имеется несколько шкал электроотрицательности. Согласно Р. Малликену (США) электроотрицательность равна полусумме энергии ионизации и энергии сродства к электрону. Сложность использования подхода Малликена заключается в том, что нет надежных методов количественного определения энергии сродства к электрону. Поэтому Л. Полинг (США) предложил термохимический метод расчета ЭО на основе определения разности энергии диссоциации соединения А-В и образующих его молекул А-А и В-В. Он ввел относительную шкалу электроотрицательности, приняв ЭО фтора, равной четырем. Электроотрицательность элементов возрастает по периоду и несколько убывает в группах с возрастанием номера периода у элементов I, II, V, VI и VII главных подгрупп, III, IV и V — побочных подгрупп, имеет сложную зависимость у элементов III главной подгруппы (минимум ЭО у А1), возрастает с увеличением номера периода у элементов IV — VIII побочных подгрупп. Наименьшие значения ЭО имеют s-элементы I подгруппы, наибольшие значения — p -элементы VII и VI групп.

Атомные радиусы. Атомы не имеют строго определенных границ из-за корпускулярно-волнового характера электронов. Поэтому абсолютное значение радиуса атома определить невозможно. Можно условно принять за радиус атома теоретически рассчитанное значение расстояния от ядра до наиболее удаленного от него максимума электронной плотности (орбитальный радиус атома) или половину расстояния между центрами двух смежных атомов в кристаллах (эффективные радиусы атомов). Наблюдается периодичность изменения атомных радиусов (рис. 1.7), особенно у s- и р-элементов. У d- и f- элементов кривая изменения радиусов атомов по периоду имеет более плавный характер. В одной и той же группе с увеличением номера периода атомные радиусы, как правило, возрастают в связи с увеличением числа электронных оболочек. Однако увеличение заряда ядра при этом оказывает противоположный эффект, поэтому увеличение атомных радиусов с увеличением номера периода относительно невелико, а в некоторых случаях, например у р-элементов III группы значение орбитального радиуса у AI больше, чем у Ga.
| |
| |  |
ХИМИЧЕСКАЯ СВЯЗЬ
Различают 3 основных типа химической связей: ковалентную, ионную и металлическую.
Механизм возникновения ковалентной связи:
Н + Н = Н2; DH = -436 кДж/моль.

Рис.2. Схема перекрывания электронных орбиталей при образовании молекулы водорода
Наибольшее перекрывание электронных облаков осуществляется вдоль линии, соединяющей ядра двух атомов.
Химическая связь тем прочнее, чем больше перекрывание электронных орбиталей (рис.2.)
Изображение химической связи:
1) Н + Н ® Н: Н


2) 1s1 1s1
 1s2
1s2








 или
или
3) H — H
.. ......


 Пример:: Cl ∙ + ∙ Cl:: Cl: Cl:
Пример:: Cl ∙ + ∙ Cl:: Cl: Cl:
 ........
........
неподеленная неспаренный общая
пара электронов электрон поделенная пара электронов

Рис.3. Схема образования химической связи в молекулах хлора Cl2 (a) и хлороводорода HCl (б)
Химическая связь, осуществляемая электронными парами, называется ковалентной. Различают неполярную ковалентную связь и полярную ковалентную связь (рис.3.)
Неполярная связь: H2, Cl2, O2, N2: H: H
..
Полярная связь: HCl, H2O, H2S: Hd+ : Cld-: (ЭОCl = 2,83; ЭОН = 2,1)
..
Ковалентная связь образуется за счет: а) перекрывания электронных облаков; б) по донорно-акцепторному механизму.
 +
+





 ....
....
 H: N: + H+ ® H: N: H (NH3 + H+ ® NH+4)
H: N: + H+ ® H: N: H (NH3 + H+ ® NH+4)





 ....
....
донор акцептор
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцепторным.
Свойства ковалентной связи
Длина связи – это межъядерное расстояние. Химическая связь тем прочнее, чем меньше ее длина.
Энергия связи – определяется количеством энергии, которое необходимо для разрыва связи.
Насыщаемость – способность атомов образовывать ограниченное число ковалентных связей.
Например: Н – неспаренный ℮ - 1 связь Н — Н;

С* - 4 неспаренных ℮ - 4 связи Н - С – Н;


Направленность – обусловливает пространственную структуру молекул, т.е. их геометрию (форму). Рассмотрим это на примере образования молекул Н2О (рис.) и NH3 (рис.5.)

.Рис.4. Схема образования химических связей в молекуле H2O
Форма молекулы воды – угловая.
О+7 1s22s22p4 – 2 неподеленные пары, 2 неспаренных электрона.
ÐНОН = 104,5°.
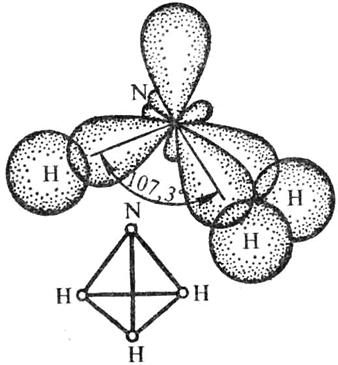
Рис. 5. Схема образования химических связей в молекуле NH3
Форма молекулы аммиака – пирамидальная.
N+7 1s2 2s2 2p3 – 3 неспаренных электрона.
ÐНОН = 107,3°. Углы между связями называются валентными.









 1s2
1s2






 Пример:: Cl ∙ + ∙ Cl:: Cl: Cl:
Пример:: Cl ∙ + ∙ Cl:: Cl: Cl: ........
........
 +
+


 ....
.... H: N: + H+ ® H: N: H (NH3 + H+ ® NH+4)
H: N: + H+ ® H: N: H (NH3 + H+ ® NH+4)



 ....
....