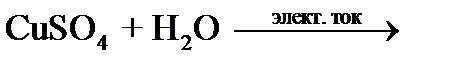Запишите наблюдения, какой выделяется газ:
1.______________________________________________________________________________
2.______________________________________________________________________________
3._____________________________________________________________________________.
С какими металлами взаимодействует соляная кислота_________________, с какими не взаимодействует_________________________
Напишите уравнения возможных реакций, укажите переход электронов:
1. Zn + HCl → ___________________________________________________________________
2. Cu + HCl → ___________________________________________________________________
3. Sb + HCl → ___________________________________________________________________.
Выпишите значения стандартных электродных потенциалов, отметьте окислитель и восстановитель, рассчитайте значение ЭДС реакций и возможность самопроизвольного протекания:
1. φ (Zn2+/Zn0) = _______эВ, _________, φ (2H+/H20) = _______эВ, _________,
ЭДС = ______________________________________________.
2. φ (Cu2+/Cu0) = _______эВ, _________, φ (2H+/H20) = _______эВ, _________,
ЭДС = ______________________________________________.
3. φ (Sb3+/Sb0) = _______эВ, _________, φ (2H+/H20) = _______эВ, _________,
ЭДС = ______________________________________________.
Вывод: (какие металлы вытесняют, а какие не вытесняют водород из разбавленных кислот) __________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
_______________________________________________________________________________.
Опыт 3. Электролиз раствора йодида калия
Запишите наблюдения на электродах: _________________________________________
________________________________________________________________________________
_______________________________________________________________________________.

Напишите реакцию в ионном виде (диссоциацию йодида калия и воды):
________________________________________________________________________________
какие частицы направляются к катоду (-)___________________________________________
какие частицы направляются к аноду (+)____________________________________________
напишите процесс на катоде (из значений стандартных электродных потенциалов выбрать окислитель):
φ (K+/K0) = _________эВ,_________, φ (H2O/H20) = _________эВ,_________,
уравнение процесса на катоде:
______________________________________________ (процесс_______________________)
напишите процесс на аноде (из значений стандартных электродных потенциалов выбрать восстановитель):
φ (I2/2I-) = _________эВ,_________, φ (O2/H2O) = _________эВ,_________,
уравнение процесса на аноде:
______________________________________________ (процесс_______________________)
суммарное уравнение электролиза:
_______________________________________________________________________________.
Вывод: ____________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
_______________________________________________________________________________.
Опыт 4. Электролиз раствора сульфата меди (II)
Запишите наблюдения на электродах:_________________________________________
________________________________________________________________________________
_______________________________________________________________________________.
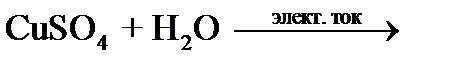
Напишите реакцию в ионном виде (диссоциацию сульфата меди (II) и воды):
________________________________________________________________________________
какие частицы направляются к катоду (-)___________________________________________
какие частицы направляются к аноду (+)____________________________________________
напишите процесс на катоде (из значений стандартных электродных потенциалов выбрать окислитель):
φ (Cu2+/Cu0) = _________эВ,_________, φ (H2O/H20) = _________эВ,_________,
уравнение процесса на катоде:
__________________________________________________ (процесс_____________________)
напишите процесс на аноде (из значений стандартных электродных потенциалов выбрать восстановитель):
φ (S2O82-/SO42-) = _________эВ,_________, φ (O2/H2O) = _________эВ,_________,
уравнение процесса на аноде:
_________________________________________________.(процесс_____________________)
суммарное уравнение электролиза:
_______________________________________________________________________________.
Вывод: ___________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
_______________________________________________________________________________.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
ФГБОУ ВПО «Уфимский государственный нефтяной технический университет»
Кафедра «Прикладная химия и физика»
Дисциплина «Химия»
ОТЧЕТ
по лабораторной работе № ___
На тему: «Коррозия металлов и методы защиты»
Выполнил
студент группы__________ ______________ И.О. Фамилия
(Подпись, дата)
Принял
преподаватель кафедры ПХиФ ______________ И.О. Фамилия
(Подпись, дата)
Цель работы:
- смоделировать в лабораторных условиях процессы электрохимической коррозии металлических изделий;
- изучить методы защиты металлических изделий от коррозионных разрушений.
Теоретическая часть
Гальванический элемент – ___________________________________________________
_______________________________________________________________________________.
Работа гальванического элемента основана на протекании________________________
_______________________________________________________________________________.
Анодом в гальваническом элементе является_______________металл с _____________
значением электродного потенциала;
катодом в гальваническом элементе является______________металл с _____________
значением электродного потенциала;
электроны в гальваническом элементе перемещаются по_____________________цепи от _______________________к____________________________.
ЭДС гальванического элемента рассчитывают________________________________.
Коррозия – ________________________________________________________________
_______________________________________________________________________________.
По характеру взаимодействия металла с окружающей средой различают типы коррозии:
- химическая;
- электрохимическая.
Электрохимическая коррозия наблюдается в электропроводных средах и сопровождается_________________________________________________________________.
В основе электрохимической коррозии лежат такие же процессы как в гальваническом элементе, только коррозионный элемент короткозамкнутый.
Анодный участок – металл с _______________________________________________
на котором протекает процесс______________________________.
катодный участок – металл с ________________________________________________
на котором протекает процесс_________________________, в качестве окислителя:
в кислой среде_____________________________________________________________
в нейтральной или щелочной________________________________________________.
Экспериментальная часть