

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
Топ:
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Техника безопасности при работе на пароконвектомате: К обслуживанию пароконвектомата допускаются лица, прошедшие технический минимум по эксплуатации оборудования...
Проблема типологии научных революций: Глобальные научные революции и типы научной рациональности...
Интересное:
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Напишите уравнения реакций средних солей:
1.___________________________________________________________________________________
2.___________________________________________________________________________________
3.___________________________________________________________________________________.
Запишите наблюдения:
1.___________________________________________________________________________________
2.___________________________________________________________________________________
3.__________________________________________________________________________________.
Напишите названия полученных солей:
1.___________________________________________________________________________________
2.___________________________________________________________________________________
3.__________________________________________________________________________________.
Вывод: (какие свойства солей наблюдали, почему реакции идут до конца?)______________________
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
Опыт 8. Получение основных солей
Напишите уравнения реакций получения основной соли (назовите ее) и её взаимодействие с щёлочью и кислотой:
1. ___________________________________________________________________________________
2. ___________________________________________________________________________________
3. ___________________________________________________________________________________.
Запишите наблюдения:
1.___________________________________________________________________________________
2.___________________________________________________________________________________
3.__________ _________________________________________________________________________
Вывод: (какой способ получения основной соли использовали, какие свойства основных солей наблюдали)____________________________________________________________________________
_____________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
ФГБОУ ВПО «Уфимский государственный нефтяной технический университет»
|
|
Кафедра «Прикладная химия и физика»
Дисциплина «Химия»
ОТЧЕТ
по лабораторной работе № ___
На тему: «Определение молекулярной массы эквивалента карбоната кальция»
Выполнил
студент группы__________ ______________ И.О. Фамилия
(Подпись, дата)
Принял
преподаватель кафедры ПХиФ ______________ И.О. Фамилия
(Подпись, дата)
Цель работы:
- определить молекулярную массу эквивалента карбоната кальция весовым методом на основе закона эквивалентов.
Теоретическая часть
Абсолютная атомная масса – _____________________________________________________
____________________________________________________________________________________.
Моль - ________________________________________________________________________
____________________________________________________________________________________.
Число Авогадро Na показывает____________________________________________________
____________________________________________________________________________________.
Относительная атомная масса -___________________________________________________
____________________________________________________________________________________.
Молекулярная масса - ___________________________________________________________
____________________________________________________________________________________.
Молярная масса - _______________________________________________________________
____________________________________________________________________________________.
К фундаментальным (стехиометрическим) относятся законы химии:____________________
_____________________________________________________________________________________
____________________________________________________________________________________.
Эквивалентом называется некая реальная или условная частица ________________________
____________________________________________________________________________________.
Число эквивалентности равно_____________________________________________________
____________________________________________________________________________________.
Единицей измерения количества эквивалентов является______________________________.
Величина, обратная числу эквивалентности, называется ______________________________,
которая показывает___________________________________________________________________.
Например, масса эквивалента кислорода равна ___________ г/моль.
Для газообразных веществ молярный объём эквивалента вещества называется _____________________________________так, молярный объём эквивалента кислорода равен ________ л/моль.
|
|
Закон эквивалентов:_____________________________________________________________
_____________________________________________________________________________________
____________________________________________________________________________________.
Для реакции А+В=С+Д закон эквивалентов записывается так:
____________________________________________________________________________________.
Экспериментальная часть
Определение молярной массы эквивалента карбоната кальция проводится по реакции:
________________________________________________________________________________
Записи в ходе эксперимента:
1. Вес пустой фарфоровой чашки - m1, г (________)
2. Вес фарфоровой чашки с мрамором до реакции - m2, г (_________)
3. Вес фарфоровой чашки с мрамором после реакции (после сушки) - m3, г (_________)
4. Объём соляной кислоты - 5 мл
5. Концентрация соляной кислоты - 2 н, моль/л
Обработка результатов:
1. Рассчитайте вес мрамора до реакции
m4 = m2 – m1, г
________________________________________________________________________________.
2. Рассчитайте вес мрамора после реакции
m5 = m3 – m1, г
________________________________________________________________________________.
3. Рассчитайте вес прореагировавшего мрамора
m6 = m4 – m5, г
________________________________________________________________________________.
4. Найдите массу соляной кислоты, вступившей в реакцию m(HCl) (по уравнению), г:
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
5. Найдите молекулярную массу эквивалента карбоната кальция:
 ;
;
МЭ (СaCO3) =
_________________________________________
6. Рассчитайте абсолютную и относительную ошибки опыта:
Δ MЭ = ׀Мтеор. – Мэксперим.׀

Вывод: (каким методом определили молярную массу эквивалента карбоната кальция, о чем говорят результаты расчета ошибок) ___________________________________ _____________________________
_____________________________________________________________________________________ _ __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ ___________________.
Нарисуйте схематично химическую посуду, используемую в лаборатории.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
ФГБОУ ВПО «Уфимский государственный нефтяной технический университет»
Кафедра «Прикладная химия и физика»
Дисциплина «Химия»
ОТЧЕТ
по лабораторной работе № ___
На тему: «Химическая кинетика. Катализ»
Выполнил
студент группы__________ ______________ И.О. Фамилия
|
|
(Подпись, дата)
Принял
преподаватель кафедры ПХиФ ______________ И.О. Фамилия
(Подпись, дата)
Цель работы:
- изучить влияние концентрации, поверхности реагирующих веществ, присутствия катализаторов на скорость химической реакции;
- оценить каталитическую активность катализатора.
Теоретическая часть
Химическая кинетика – это раздел химии, изучающий ____________________________ ______________________________________. Скоростью химической реакции называют ___________________________________________________________________________________ ____________________________________________________________________________________.Скорость гомогенной реакции выражается формулой:
Vгомог.=
_____________________
Скорость реакции зависит от различных факторов.
Зависимость скорости химической реакции от концентрации выражается законом действия масс: ________________________________________________________________________________ _______________________________________________________________________________________________________________________________________________________________________.
Например, для реакции  закон действия масс может быть записан:
закон действия масс может быть записан:
___________________________________________________________________________________
где  - ___________________;
- ___________________; 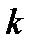 - __________________________; [ ] - _____ ___________________________________________________________________________________.
- __________________________; [ ] - _____ ___________________________________________________________________________________.
Данная система является гомогенной, так как _______________________________________ ___________________________________________________________________________________. Особенность гетерогенных процессов заключается в том, что они____________________________ ____________________________________________________________________. Поэтому скорость химических реакций в гетерогенных системах при постоянной температуре зависит и от _______________________________________________________. Скорость гетерогенной реакции выражается формулой:
Vгетер.=
_____________________
С ростом температуры скорость химической реакции резко возрастает. Зависимость скорости реакции от температуры выражается правилом ____________________________: _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________ и выражается формулой:
______________________________
где V (T1), V (Т2) - ____________________________________________;  и
и  - __________ _________________________________________;
- __________ _________________________________________;  - _______________________________________, показывающий на сколько _________________________________________при повышении температуры на 10°С.
- _______________________________________, показывающий на сколько _________________________________________при повышении температуры на 10°С.
Лишь определенная часть общего числа соударений молекул реагирующих веществ приводит к химическому взаимодействию. Такие соударения называются _____________________.
|
|
Энергия активации – это _________________________________________________________ _______________________________________________________________________________________________________________________________________________________________________.
Одним из методов ускорения химической реакции является катализ, который, осуществляется при помощи катализаторов – веществ, ________________________________ _____________________________________________. Механизм действия катализатора сводится к _________________________________________________________________________________.
Вещества, снижающие скорость химической реакции, называются _____________________.
Автокатализ – это ______________________________________________________________ _______________________________________________________________________________________________________________________________________________________________________.
Экспериментальная часть
|
|
|

Адаптации растений и животных к жизни в горах: Большое значение для жизни организмов в горах имеют степень расчленения, крутизна и экспозиционные различия склонов...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!