Описанное выше состояние, когда концентрации исходных веществ и продуктов реакции (а значит, и состав реакционной массы в целом) остаются неизменными при одновременном протекании прямой и обратной реакции, называется состоянием химического равновесия.
Химическое равновесие не следует представлять как нечто статичное, подобное равновесию на чашках весов. Следует понимать, что при равновесии непрерывно протекают как прямая, так и обратная реакции, но с одинаковой скоростью. При этом происходит непрерывное образование каждого из веществ – участников реакции, но в единицу времени такое же количество этого вещества расходуется на протекание реакции, идущей в противоположном направлении. Поэтому химическое равновесие характеризуют как динамическое равновесие. Кинетическим* условием химического равновесия является равенство скоростей прямой (1) и обратной (2) реакций:
υ 1 = υ 2.
Рассмотрим конкретную обратимую реакцию:
СО + NО2 ←→ СО2 + NО.
Для прямой реакции выражение для скорости по закону действия масс:
υ 1 = k 1·[CО]·[NO2]·,
а для обратной реакции скорость будет равна:
υ 2 = k 2·[CО2]·[NO]·.
В ходе процесса концентрации исходных веществ будут уменьшаться, и, следовательно, будет уменьшаться скорость прямой реакции. Концентрации продуктов реакции наоборот будут увеличиваться, а скорость обратной реакции постепенно возрастать. Как только значения υ 1 и υ 2 станут одинаковыми, в системе устанавливается динамическое равновесие и дальнейшее изменение концентраций всех участвующих в реакции веществ прекращается. Для состояния химического равновесия имеем равенство:
k 1·[CО]·[NO2]·= k 2·[CО2]·[NO].
Если в одной части уравнения сгруппировать значения концентраций, а в другой константы скорости реакций, то получится выражение:
 . (5)
. (5)
Поскольку при данной температуре k 1·и k 2·являются величинами постоянными, то их отношение при этих условиях также должно быть величиной постоянной. Отношение констант скорости прямой и обратной реакции обозначается К и носит название константы химического равновесия:
 .
.
Как видно из формулы (5), константа равновесия характеризует соотношение концентраций исходных веществ и концентраций продуктов реакции в состоянии химического равновесия. Константа химического равновесия зависит от природы регентов и температуры (K постоянна для данной температуры), и не зависит от концентраций реагирующих веществ. Величина константы не зависит от катализатора; присутствие катализатора в системе лишь ускоряет время наступления равновесия.
Рассмотрим общий случай некоторой обратимой реакции, описываемой уравнением:
а А + b В ←→ d D + e E,
в котором прописными буквами A, B, C, D обозначены различные виды молекул (реагентов и продуктов реакции), а строчными буквами a, b, c, d – числовые коэффициенты, показывающие, сколько молекул данного вещества участвуют в реакции (так называемые стехиометрические коэффициенты). Тогда для приведенной реакции скорости прямой и обратной реакций, согласно закону действия масс, будут равны:
υ 1 = k 1·[A] a ·[B] b, υ 2 = k 2·[D] d ·[E] e.
При достижении химического равновесия и равенстве скоростей:
k 1·[A] a ·[B] b = k 2·[D] d ·[E] e
константа равновесия будет выражаться следующей формулой:
 . (6)
. (6)
Таким образом, константа равновесия – физическая величина, равная отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам в уравнении реакции перед формулами этих веществ.
При гетерогенных реакциях в выражении константы равновесия, так же как в выражении закона действия масс для скорости химической реакции, не входят концентрации твердых веществ. Например, для реакции
СО2 + С(тверд.) ←→ 2СО
константа равновесия будет включать концентрации только газообразных участников реакции:
 , (7)
, (7)
Концентрации газообразных веществ в выражении для константы равновесия могут быть заменены равновесными парциальными давлениями этих веществ, и тогда вычисляется константа равновесия "по давлению", которая обозначается Kp. Например, формулы (5) и (7) могут быть записаны:
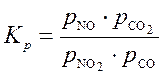 ;
;  .
.
По значению константы равновесия можно судить о том, в какую сторону и насколько интенсивно протекает реакция.
При К >> 1 протекает преимущественно прямая реакция; говорят, что «равновесие сдвинуто вправо». Имеет место полное или почти полное вступление в реакцию веществ, записанных в левой части уравнения. Для реакций, которые представляются нам необратимыми, К составляет 1015-1020 и более.
При К << 1 степень превращения исходных веществ в продукты реакции очень мала; реакция, фактически, идет в обратную сторону, говорят, что равновесие «сдвинуто» влево.
Если величина К не сильно отличается от единицы, то реакция останавливается в «среднем положении», когда в реакционной
смеси присутствуют и исходные вещества, и продукты, причем в концентрациях, отличающихся не более, чем на один-два порядка. Так, уже рассмотренная выше реакция (с. 42) взаимодействия иода и водорода:
H2 + I2 ← → 2HI
характеризуется величиной К около 50.



 . (5)
. (5) .
. . (6)
. (6) , (7)
, (7)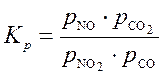 ;
;  .
.


