

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
Топ:
Оснащения врачебно-сестринской бригады.
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Интересное:
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Под степенью гидролиза понимают число h, показывающее какая часть от общего количества соли гидролизована.
Степень гидролиза определяется соотношением:

Познакомимся с вычислением степени гидролиза на примере KCN. Гидролиз этой соли может быть представлен следующим ионным уравнением:
 .
.
Напишем уравнение константы равновесия этой реакции:
 .
.
Величина [H2O] может считаться постоянной, т.к. вода находится в растворе в большом избытке. Перенесем её в левую часть уравнения:
 .
.
Произведение двух констант — это тоже константа, называемая константой гидролиза:
 . (10)
. (10)
Числовое значение К гидр можно найти из величины  и
и 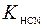 . Из ионного произведения воды:
. Из ионного произведения воды:

получим:  . (11)
. (11)
Подставим полученное выражение (11) для [OH–] в уравнение (10):

или  ,
,
где  — константа диссоциации цианистоводородной кислоты.
— константа диссоциации цианистоводородной кислоты.
Уравнение (10) будет иметь вид:
 . (12)
. (12)
Из уравнения (12) определим степень гидролиза соли. Пусть концентрация соли С моль/л. Если степень гидролиза h, то гидролизовано С ∙hмоль соли и образовано С ∙hмоль HCN и С ∙h моль ионов ОН–:
 .
.
Следовательно:  .
.
Так как величина h обычно мала по сравнению с единицей, то
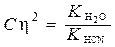 ;
;
 . (13)
. (13)
Полученное выше уравнение (13) подтверждает общие положения, что степень гидролиза тем больше:
а) чем больше  (т.е. чем выше температура), так как с ростом температуры ионное произведение воды (
(т.е. чем выше температура), так как с ростом температуры ионное произведение воды ( ) быстро растет);
) быстро растет);
б) чем меньше К кисл (т.е. чем слабей кислота, соль которой подвергается гидролизу);
в) чем меньше концентрация С, т.е. чем сильней разбавлен раствор.
Аналогично выводится формула для вычисления степени гидролиза солей сильных кислот и слабых оснований, например, NH4Cl:
 ;
;
 .
.
Примеры решения задач
Пример 1. Вычисление водородного показателя (рН) раствора.
|
|
Вычислите рН раствора КОН, содержащегося в растворе в концентрации  моль/л.
моль/л.
Решение: Концентрация ОН– ионов в растворе КОН равна  моль/л. Определим концентрацию ионов [H+]:
моль/л. Определим концентрацию ионов [H+]:
 ;
;
 .
.
Пример 2. Вычисление концентрации ионов ОН– по величине водородного показателя раствора.
Вычислите концентрацию ОН– ионов в растворе рН которого равен 3,28. Определим по величине рН концентрацию ионов Н+ в растворе  ;
;  .
.
 моль/л.
моль/л.
Определим концентрацию ионов ОН– по величине ионного произведения воды:
 моль/л.
моль/л.
Пример 3. Вычисление рН сильного электролита с учетом его коэффициента активности.
Найдите водородный показатель 0,175М раствора HNO3.
Решение: Определим активную концентрацию электролита. Для этого вычислим ионную силу раствора:
 ,
,
где С 1, С 2 – молярные концентрации отдельных присутствующих в растворе ионов; z 1, z 2 – их заряды:
 .
.
По вычисленной ионной силе находим коэффициент активности иона Н+ (см. таблицу 9):
 ;
;
 .
.
Водородный показатель раствора HNO3 равен:
 .
.
9 Таблица
Коэффициенты активности ионов
| Ионы | Ионная сила раствора | |||||||
| 0,001 | 0,002 | 0,005 | 0,01 | 0,02 | 0,05 | 0,1 | 0,2 | |
| H+ | 0,975 | 0,967 | 0,950 | 0,923 | 0,914 | 0,880 | 0,860 | 0,830 |
| Li+ | 0,975 | 0,965 | 0,948 | 0,929 | 0,907 | 0,870 | 0,865 | 0,800 |
| Rb+, Cs+, NH+, Ag+ | 0,975 | 0,964 | 0,945 | 0,924 | 0,898 | 0,850 | 0,800 | 0,750 |
| K+, Cl–, Br–, I–, CN–, NO3– | 0,975 | 0,964 | 0,945 | 0,925 | 0,899 | 0,850 | 0,805 | 0,755 |
| OH–, F–, CNS–, MnO4– | 0,975 | 0,964 | 0,946 | 0,926 | 0,900 | 0,855 | 0,810 | 0,760 |
| Na+ | 0,975 | 0,964 | 0,947 | 0,928 | 0,902 | 0,860 | 0,820 | 0,775 |
| SO42–, CrO42– | 0,903 | 0,867 | 0,803 | 0,740 | 0,660 | 0,545 | 0,445 | 0,355 |
| Pb2+, CO3–, SO32– | 0,903 | 0,868 | 0,805 | 0,742 | 0,665 | 0,550 | 0,455 | 0,370 |
| Sr2+, Ba2+, Cd2+, S2– | 0,903 | 0,868 | 0,805 | 0,744 | 0,670 | 0,555 | 0,465 | 0,380 |
| Ca2+, Cu2+, Zn2+, Mn2+, Fe2+, Ni2+, Co2+ | 0,905 | 0,870 | 0,809 | 0,749 | 0,675 | 0,570 | 0,485 | 0,405 |
| Mg2+, Be2+ | 0,906 | 0,872 | 0,813 | 0,755 | 0,595 | 0,520 | 0,450 | |
| PO43–, [Fe(CN)6]3– | 0,796 | 0,725 | 0,612 | 0,505 | 0,395 | 0,250 | 0,160 | 0,095 |
| Al3+, Fe3+, Cr3+ | 0,802 | 0,738 | 0,632 | 0,540 | 0,445 | 0,325 | 0,245 | 0,180 |
| [Fe(CN)6]4– | 0,668 | 0,570 | 0,425 | 0,310 | 0,200 | 0,100 | 0,048 | 0,021 |
Пример 4. Вычисление рН смеси сильных электролитов.
Определить рН раствора, содержащего в 1л 0,01 моль NaOH и 0,12 моль NaCl.
Решение: Ионная сила раствора:
 .
.
Коэффициент активности иона ОН- равен:  ;
;
|
|
 ;
;
 ;
;
 .
.
В случае приближенного расчета (без учета активности)
получим:
[OH–]=0,01=10–2;
 ;
;
 .
.
Разница всего 0,1.
Пример 5. Вычисление рН раствора слабого электролита.
Определите рН 0,17н. CH3COOH, константа диссоциации
которой равна  .
.
Решение: В соответствии с законом разбавления Оствальда, степень диссоциации равна:
 .
.
Концентрация ионов  моль/л.
моль/л.
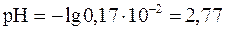 .
.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Содержание работы:
1. После ознакомления с теоретическим материалом выполнить опыты и записать результаты наблюдений.
2. На основании экспериментальных данных по опыту 3 сделать записи о том, протекает ли гидролиз в растворе каждого из соединений; сделать вывод о том, для каких соединений протекает гидролиз. Записать молекулярные, ионно-молекулярные и краткие ионные уравнения реакций гидролиза.
3. По опыту 4 записать молекулярные, ионно-молекулярные и краткие ионные уравнения реакций гидролиза, сделать вывод
о влиянии температуры и влиянии природы соли на процесс
гидролиза.
|
|
|

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!