Химические реакции протекают с различными скоростями. Некоторые из них полностью заканчиваются за доли секунды (взрывы), другие осуществляются за минуты, часы, дни; есть реакции, протекающие в течение нескольких лет, десятилетий и еще более длительных отрезков времени (коррозия металлов, разрушение разнообразных материалов в атмосферных условиях).
При определении понятия скорости химической реакции необходимо различать гомогенные и гетерогенные реакции. Поэтому необходимо напомнить значение некоторых терминов.
Системой называется совокупность объектов (физических тел, химических веществ), взятых для рассмотрения и условно отделенных от других объектов и веществ (от окружающей среды). Различают гомогенные и гетерогенные системы. Гомогенной называется система, состоящая из одной фазы, гетерогенной – система, содержащая несколько фаз.
Фазой называется однородная часть гетерогенной системы, одинаковая по составу, химическим и физическим свойствам и отделенная от других частей поверхностью раздела, при переходе через которую свойства системы резко меняются.
Если реакция протекает в гомогенной системе, например, в растворе или в смеси газов, то она идет во всем объеме системы. Например, при сливании и перемешивании растворов серной кислоты и тиосульфата натрия помутнение, вызываемое выпадением в осадок серы, наблюдается во всем объеме раствора:
H2SO4 + Na2S2O3 = Na2SO4 + H2O + SO2↑ + S↓.
Если реакция протекает между веществами, образующими
гетерогенную систему, то она может идти только на поверхности раздела фаз, образующих систему. Например, реакция взаимодействия металла и кислоты, приводящая в итоге к растворению металла:
Fe + 2HCl = FeCl2 + H2↑
может протекать только на поверхности металла, потому что только здесь соприкасаются друг с другом оба реагирующие вещества. В связи с этим скорости гомогенной реакции и гетерогенной определяются различно.
Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени в единице объема системы.

 . (1)
. (1)
Знак «±» в формуле используется для того, чтобы значение скорости реакции всегда было положительным, независимо, от того, производится расчет по числу молей исходного вещества или продукта реакции.
Отношение числа молей вещества к объему, в котором оно распределено, есть молярная концентрация вещества:
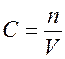 ,
,  , следовательно
, следовательно  .
.
Поэтому скорость гомогенной реакции можно также определить как изменение концентрации какого-либо из веществ:
исходного реагента или продукта реакции, происходящее в единицу времени.

 . (2)
. (2)
Если реакция протекает между веществами, находящимися в различных фазах гетерогенной системы, то она может идти только на поверхности раздела этих фаз. Например, как отмечалось выше, взаимодействие раствора кислоты и куска металла происходит только на поверхности металла. Соответственно, скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени на единице поверхности раздела фаз:

 , (3)
, (3)
где S – площадь поверхности раздела фаз, на которой протекает
реакция.
|
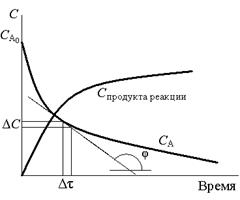
| Рис. 1. Изменение концентраций исходного вещества и получаемого продукта в ходе реакции
|
В зависимости от характера реакции время может быть выражено не только в секундах, как требует система СИ, но также в минутах или часах. Поскольку в ходе реакции концентрации исходных веществ непрерывно уменьшаются (рис. 1), то и величина скорости реакции не является постоянной, а также непрерывно уменьшается. Расчеты по вышеприведенным формулам (1) и (2) дают среднее значение скорости реакции за некоторый интервал времени
Δτ = τ2 – τ1. Истинная (мгновенная) скорость определяется как предел к которому стремится отношение Δ С / Δτ при Δτ → 0, т. е. истинная скорость равна производной концентрации по времени (может быть найдена как тангенс угла наклона касательной в данной точке).
Для реакции, в уравнении которой есть стехиометрические коэффициенты, отличающиеся от единицы, значения скорости, выраженные по разным веществам, неодинаковы. Например для реакции А + 3В = D + 2Е расход вещества А равен одному молю, вещества В – трем молям, приход вещества Е – двум молям. Поэтому
υ (А) = ⅓ υ (В) = υ (D) =½ υ (Е) или υ (Е). = ⅔ υ (В).
Важнейшими факторами, влияющими на скорость химической реакции, являются:
— природа реагирующих веществ;
— концентрация реагирующих веществ;
— температура,
— присутствие в системе катализаторов.
Иногда в числе факторов, влияющих на скорость гетерогенных реакций, указывают степень дисперсности (степень измельчения) реагентов. Действительно, если, например, при растворении в кислоте металла взять его в виде мелких зерен, а не в виде цельного куска, выделение водорода будет происходить с большей интенсивностью. Однако следует понимать, что в случае, когда реагирует мелкоизмельченный металл, увеличивается площадь поверхности раздела фаз, а потому выделяется большее количество водорода в единицу времени. Сама же скорость гетерогенной реакции, вычисляемая с учетом площади контакта фаз в соответствии с формулой 3, не меняется.
1.2. Зависимость скорости химической реакции
от концентрации
Необходимым условием химического взаимодействия различных веществ, составляющих гомогенную систему, является столкновение их молекул. Только при столкновении молекулы попадают в сферы взаимного влияния электрических полей, возбуждаемых той или иной заряженной частицей другой молекулы. Очевидно, что скорость химического взаимодействия должна зависеть от числа столкновений реагирующих молекул в единицу времени. Также понятно, что число соударений тем больше, чем выше концентрация каждого из исходных веществ.
В 1867 г. двумя норвежскими химиками К.М. Гульдбергом и П. Вааге был сформулирован закон действия масс, выражающий зависимость скорости химической реакции от концентрации реагирующих веществ:
При постоянной температуре скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ, возведенных в степени, равные коэффициентам при формулах этих веществ в уравнении реакции.
Тогда для реакции:
2А + В → продукты
справедливо соотношение υ ~ · С А2· С В, а чтобы перейти от пропорциональности к равенству вводится коэффициент пропорциональности k, называемый константой скорости реакции:
υ = k · С А2· С В или υ = k ·[А]2·[В].
Обратите внимание, что молярные концентрации в формулах могут обозначаться как буквой С с соответствующим индексом, так и химической формулой соответствующего вещества, заключенной в квадратные скобки!
Физический смысл константы скорости реакции – скорость реакции при концентрациях всех реагирующих веществ, равных 1 моль/л. Размерность константы скорости реакции зависит от числа сомножителей в правой части уравнения и может быть с–1;
с–1·[л/моль]; с–1·[л2/моль2] и т. п., то есть такой, чтобы в любом случае при вычислениях скорость реакции выражалась в моль·л–1·с–1.
Например, для реакции взаимодействия водорода с хлором:
H2 + Cl2 = 2HCl
зависимость скорости υ от концентраций водорода [H2] и хлора [Cl2], согласно закону действия масс, выражается формулой:
υ = k ·[H2]2·[Cl2],
Аналогично, для реакции взаимодействия азота с водородом:
N2 + 3H2 = 2NH3
выражение скорости будет иметь вид:
υ = k ·[H2]·[H2]·[H2]·[N2] = k ·[H2]3·[N2].
Таким образом, коэффициенты в уравнении реакции являются показателями степени при концентрации соответствующего вещества в выражении для скорости реакции. Для уравнения некоторой общей реакции вида:
m A + n B = D
скорость реакции выражается формулой
υ = k · С А m · С B n или υ = k ·[А] m ·[В] n.
Для гетерогенных реакций в уравнение закона действия масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе. Дело в том, что концентрация вещества, находящегося в твердой фазе, представляет постоянную величину и включается в константу скорости. Например, для процесса горения угля:
С + О2 = СО2
по закону действия масс скорость равна:
υ = kI ·[C]·[O2]·= kI ·const·[O2]·= k ·[O2],
где k = kI ·const.
В системах, где одно или несколько веществ являются газами, скорость реакции зависит также и от давления. Например, при взаимодействии водорода с парами иода:
H2 + I2 =2HI
скорость химической реакции будет определяться выражением:
υ = k ·[H2]·[I2].
Если увеличить давление, например, в 3 раза, то во столько же раз уменьшится объем, занимаемый системой, и, следовательно, во столько же раз увеличатся концентрации каждого из реагирующих веществ. Скорость реакции в этом случае возрастет в 9 раз.
Следует понимать, что если в результате протекания указанной реакции в системе уже образовалось определенное количество иодистого водорода и достигнуто состояние химического равновесия, то увеличение давления не приведет к изменению состава системы, так как скорость обратной реакции — разложения иодистого водорода на исходные иод и водород также возрастет и в то же число раз. Этот вопрос рассматривается далее в теме «Химическое равновесие»




 . (1)
. (1)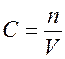 ,
,  , следовательно
, следовательно  .
.

 , (3)
, (3)


