Покажем это на примере гальванического элемента (рис. 9.1). Этот элемент (элемент Якоби-Даниэля) состоит из двух электродов, имеющих различные значения электродных потенциалов: цинковой пластины, погруженной в раствор сульфата цинка (цинковый электрод 1), и медной пластины, погруженной в раствор сульфата меди (медный электрод 2). Электроды соединены между собой металлическим проводником 3, а растворы – электролитическим ключом 4 – U-образной стеклянной трубкой, выполняющей функции проводника с ионной проводимостью.
На цинковом электроде (отрицательный электрод, анод) происходит окисление атомов цинка в ионы, которые переходят в раствор
Zn – 2ē = Zn2+.
Электроны перемещаются по металлическому проводнику к медному электроду (положительный электрод, катод), где происходит восстановление катионов меди из раствора в атомы меди и осаждение их на электроде:
Cu2+ + 2 ē = Cu.
В результате около цинкового электрода электролит приобретает избыточное число положительно заряженных ионов Zn2+ по сравнению с исходным, а около медного электрода – недостаток ионов SO42–. По электролитическому мостику анионы SO42– перемещаются от медного электрода к цинковому, замыкая цепь.
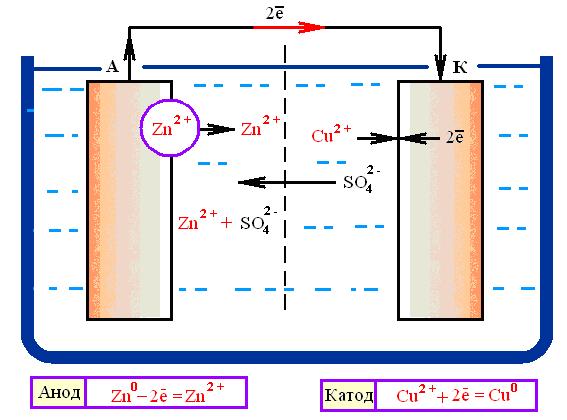
Рис. 9.1. Схема медно-цинкового гальванического элемента
| 9.2. Направление протекания окислительно-восстановительных реакций
При работе гальванического элемента в качестве окислителя выступает электрохимическая система с более высоким значением электродного потенциала, а в качестве восстановителя – с более низким.
Таким образом, сопоставляя электродные потенциалы соответствующих систем, можно определить направление, в котором будет протекать окислительно-восстановительная реакция:
чем больше значение стандартного электродного потенциала (стандартного окислительно-восстановительного потенциала) данного атома или иона, тем больше его окислительные свойства, а чем меньше алгебраическая величина стандартного окислительно-восстановительного потенциала данного атома или иона, тем больше его восстановительные свойства.
Для определения направления окислительно-восстановительной реакции необходимо найти ЭДС гальванического элемента, образованного из данного окислителя и восстановителя:
ΔЕ = Е ок. – Е восст.
Если ΔЕ > 0, то данная реакция возможна, если ΔЕ < 0, то реакция протекает в обратном направлении.
При одинаковых или очень близких значениях электродных потенциалов двух систем реакция между ними не имеет преимущественного направления, то есть обе системы находятся в состоянии подвижного равновесия.
Стандартное значение ЭДС Е0 гальванического элемента связано со значением стандартной энергией Гиббса ΔG0 протекающей реакции соотношением:
nFЕ0 = – ΔG0,
где n– число электронов, принимающих участие в реакции;
F – число Фарадея.
Кроме того, значение стандартной энергии Гиббса связано с константой равновесия реакции К уравнением:
ΔG0 = – 2,3 R T lg K.
Из двух последних уравнений следует:
n F Е0 = 2,3 R T lg K.
Пользуясь этим соотношением, можно по экспериментально определенному значению стандартной ЭДС вычислить константу равновесия соответствующей окислительно-восстановительной реакции.
При Т = 298 К, F ≈ 96500 Кл/моль, R = 8,314 Дж/ (моль • К):
lg K = n Е0 / 0,059
|
9.3. Электролиз
Электролиз – совокупность окислительно-восстановительных процессов, протекающих при прохождении постоянного электрического тока через расплав или раствор электролита. При электролизе энергия электрического тока превращается в химическую энергию. Как и в случае гальванического элемента, на аноде происходит окисление, а на катоде – восстановление. Но при электролизе анодом является положительный электрод, а катодом – отрицательный.
Характер протекания электродных процессов при электролизе зависит от многих факторов, например, от материала электродов, состава электролита, режима электролиза (температура, напряжение, плотность тока и др.).
Материал электродов:
1) нерастворимые (инертные) электроды – в процессе электролиза химически не изменяются, а служат лишь для передачи электронов во внешнюю цепь (инертные электроды изготавливаются обычно из графита, угля, платины);
2) растворимые (активные) электроды (из меди, цинка, серебра, никеля и других металлов) – во внешнюю цепь электроны посылает сам анод за счет окисления атомов металла, из которого сделан анод:
Me – nē = Men+
анод во внешнюю в р-р
цепь
|