1 стадия – диффузия субстрата к ферменту и связывание его с АЦ фермента (образование фермент-субстратного комплекса ES)
E+S=ES
Эта стадия непродолжительна по времени. Зависит от концентрации субстрата в среде и скорости его диффузии к АЦ.
Образование ES происходит практически мгновенно. Изменение энергии активации незначительно.
2 cстадия – преобразование первичного ES в один или несколько ES (ES* и ES**).
ES*à ES**
Наиболее медленная стадия. Ее длительность зависит от энергии активации данной реакции.
Происходит разрыв связей субстрата и образование новых в результате взаимодействия каталитических групп субстрата. => Снижается энергия активации.
3 стадия – отделение продуктов реакции от АЦ фермента и диффузия их в окружающую среду (комплекс EP диссоциирует на E и Р).
EPàE+P
Стадия непродолжительная по времени. Определяется скоростью диффузии продуктов реакции в окружающую среду.
При изменении конформации фермента, меняется и его активный центр в сторону повышения комплементарности к субстрату.
- Какие ферменты цикла трикарбоновых кислот являются регуляторными? Какие соединения и как на них влияют?
Регуляторные ферменты (аллострические) – ферменты, активность которых регулируется путем взаимодействия аллостричского ингибитора с аллострическим центром этого фермента.
Такие ферменты состоят из 2 субъединиц: аллострической и каталитической. Присоединение эффектора к регуляторной субъединице приводит к изменению ее конформации, вследствие чего изменяется конформация и каталитической субъединицы(кооперативный эффект). В том числе и каталитического АЦ в сторону повышения его комплементарности к субстрату.
К регуляторным фермнтам ЦТК относятся:
- Цитратсинтаза – фермент, катализирующий первую реакции цикла Кребса (образование цитрата из оксалоацетата и ацетил-КоА через промежуточное соединение цитрил-КоА).
Он ингибируется высокими концентрациями АТФ, НАДН, сукцинил-КоА, ацил-КоА, цитрата.
- Изоцитратдегидрогеназа – фермент, катализирующий 3 реакцию ЦТК (превращение изоцитрата сначала в оксалосукцинат, а затем в 2-оксоглутарат).
Как и всякая ДГ, этот фермент имеет кофермент – акцептор Н, отщепляемый от субстрата.
Истинная изоцитратДГ – НАД-зависимый фермент, который содержится только в матриксе МТХ и катализирует дегидрирование изоцитрата.
Другая НАД-зависимая изоцитратДГ находится в основном в цитоплазме клетки (около 80%). Она катализирует декарбоксилирование оксалосукцината с образованием 2-оксоглутарата.
Реакция, катализируемая данным ф-том, требует присутствия ионов Мn или Мg.
Активируется АДФ, АМФ. Избыток НАДН и АТф ингибирует фермент.
- 2-оксоглутаратдегидрогеназный комплекс (пируватДГ, дигидролипоилтрансфераза, КоА-SH, дигидролипоилДГ, НАД) – полиферментный комплекс, катализирующий превращение 2-оксоглутарата в сукцинил-КоА (4 реакция ЦТК).
Ингибиторы: НАДН, сукцинил-КоА.
3. Биосинтез РНК (транскрипция). Первичные транскрипты и созревание (процессинг) рибосомных, транспортных и матричных РНК.
Транскрипция имеет 3 фазы: инициацию, элонгацию и терминацию.
1) Инициация транскрипции происходит вследствие присоединения ДНК-зависимой РНК-полимерзы к промотору, обладающим высоким сродством к этому ферменту. Промотор-это стартовая точка транскрипции.
РНК-полимераза состоит из 5 субъединиц: 4 из них образуют агрегат (кор-фермент), который катализирует обр-е фосфодиэфирных связей м/д нуклеотидами в РНК; 5-я субъединица (сигма-фактор) легко отделяется от субъединицы. Сигма-фактор «выбирает» место транскрипции, а затем к нему присоединяется кор-фермент и начинает транскрипцию.
У эукариотов имеется 3 РНК-полимеразы:
- РНК-полимераза I ответственна за транскрипцию генов рРНК;
- РНК-полимераза II – за тРНК и 5S рРНК;
- РНК-полимераза III участвует в синтзе предшественника мРНК.
РНК-полимеразы наращивают цепь всегда в направлении 5-3, поэтому 5-конец содержит всегда фосфат, а 3-конец – свободный ОН.
Начинается синтез РНК либо с фффА, либо с фффГ, которые специфически спариваются со стартовыми основаниями разных транскриптонов.
2) Элонгация транскрипции происходит при скольжении РНК-полимеразы вдоль матрицы ДНК. Каждый следующий нуклеотид спаривается с комплементарным основанием в ДНК-матрице, а РНК-полимераза «скрепляет» его с растущей цепью РНК фосфодиэфирными связями.
3) Терминация транскрипции происходит после достижения РНК-полимеразой нуклеотидны последовательностей ДНК, являющихся стоп-сигналами. Благодаря терминаторам цепи РНК образуются только опр-й длины.
По мере того, как транскрипция подходит к концу, синтезированная РНК отделятся от ДНК.
Первичные продукты транскрипции являются полными копиями транскриптонов ДНК – РНК-предшественники, в которых есть информативные и неинформативные участки. Такую РНК необходимо освободить от неинформативного груза и оставить только информативную часть молекул РНК.
Образуется 3 типа РНК-предшественников:
1) Предшественник мРНК (пре-мРНК)
2) Предшественник рРНК (пре-рРНК)
3) Предшественник тРНК (пре-тРНК).
В ядре все пре-РНК проходят стадию процессинга (созревания):
1) Вырезание неинформативных участков из пре-РНК
2) Сращивание информативных участков «разорванных» генов – сплайсинг
3) Модификация 5- и 3-концевых участков РНК
Процессинг пре-мРНК
1) Вырезание неинфомативных участков (интронов) пре-мРНК с помощью рибонуклеаз:
они гидролизуют фосфодиэфирные связи,начиная с 5-конца,и оставляют от пре-мРНК необходимую часть готовой мРНК.
2) Экзоны сращиваются в единую цепь с помощью РНК-лигаз.
3) Модификация 5- и 3-концов обр-ся мРНК:
К 5-концу присоединяется олигонуклеотид, который состоит из 2х или 3х метилированных нуклеотидов.
К 3-концу (у эукариот) присоединяется полиадениловый фрагмент – поли(А) с помощью поли(А)-полимеразы.
Процессинг пре-рРНК
Пре-рРНК обр-ся в ядрышке,где находятся транскриптоны рРНК. В ДНК ядрышка гены 18S и 28S рРНК входят в один транскриптон,где расположены попарно друг за другом. В пре-РНК их расположение такое же.
Размеры пре-рРНК достигают 45S. А в ходе процессинга остается чуть больше половины пре-рРНК и освобождаются зрелые 18S и 28S рРНК.
Часть нуклеотидов РНК подвергается модофикации (метилирование основанией метилтрансферазами).
Зрелые рРНК соединяются в ядре с белками рибосом и образуют малую и большую субъединицы рибосом.
Процессинг пре-тРНК.
Пре-тРНК содержит излишки примерно в 40 нуклеотидов. Они удаляются рибонуклеазами.
Затем происходит метилирование оснований тРНК.
Окончастельно зрелая тРНК образуется путем присоединения акцепторного конца (ЦЦА) с помощью спец-й РНК-полимеразы.
- Задача. Объясните, почему при употреблении в пищу преимущественно кукурузы и малого количества мяса возникает пеллагра? Напишите формулу соединения для лечения.
Пелла́гра — заболевание, один из авитаминозов, который является следствием длительного неполноценного питания (недостаток витамина PP и белков, в особенности содержащих незаменимую аминокислоту триптофан).
Для лечения применяется никотинамид, близкий по строению к никотиновой к-те (ликвидирует недостаток витамина ПП). 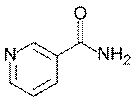
5билет.
- Охарактеризуйте четвертый класс ферментов: тип катализируемых реакций и назовите важнейшие группы ферментов внутри класса. Назовите несколько представителей и напишите химизм реакций.
Лиазы – ферменты, катализирующие разрыв С-О, С-С, C-N и других связей, а также обратимые реакции отщепления различных групп негидролитическим путем. Выделяют 7 подклассов. Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту двойной связи. Лиазы являются сложными ферментами. Коферментами служат: пиридоксальфосфат, тиаминдифосфат, участвует магний, кобальт.
Ферменты делятся на подклассы в зависимости от природы атакуемой связи. Примером являются ферменты, действующие на углерод-углеродные связи, углерод-кислородные связи, углерод-азотные связи.
Если рассматривать все подклассы, то в них выделяются:
4.1. углерод-углерод лиазы;
4.2. углерод-кислород лиазы;
4.3. углерод-азот лиазы;
4.4. углерод-сера лиазы;
4.5. фосфор-кислород лиазы.
Среди подподклассов выделяют, например, карбокси-лиазы (4.1.1.), гидро-лиазы 4.2.1.).
Систематическое название образуется: Расщепляемый субстрат: отделяемая группа – лиаза
| Систематическое название
| 2-оксокислота:карбокси-лиаза
|
| Рабочее название
| Пируватдекарбоксилаза
|
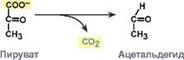
| Систематическое название
| АТФ:дифосфат-лиаза (циклизующая)
|
| Рабочее название
| Аденилатциклаза
|

- Представление о биосинтезе холестерина.
Углеродный скелет холестерина целиком состоит из углерода уксусной кислоты.
Биосинтез холестерина из ацетил-КоА происходит с участием ферментов ЭПС и гиалоплазмы многих тканей и органов. Наиболее активен этот процесс в печени взрослого человека.
Происходит в 3 этапа:
- Образование мевалоновой кислоты из ацетил-КоА
- Образование б-гидрокси-б-метилглутарил-КоА из ацетил-КоА


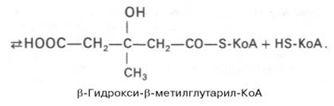
Далее б-гидрокси-б-метилглутарил-КоА под д-ем гидроксиметилглутарил-КоА-редуктазы превращается в мевалоновую кислоту:

Эта реакция необратима.
- Синтез из мевалоновой кислоты «активного изопрена» с конденсацией последнего в сквален;
Мевалоновая кислота в ходе нескольких ферментных реакций, в которых расходуется АТФ, превращается в изопентилпирофосфат и его изомер 3,3-диметилаллилпирофосфат. Эти оба в-ва и есть «активный изопрен», который используется на обр-е сквалена.
- Превращение сквалена в холестерин.
Сквален à Ланостерин à Холестерин
Гидроксилирование стероидного кольца протекает с участием монооксигеназной цепи мембран ЭПС.
Эфиры холестерина обр-ся (особенно активно в слизистой кишечника и печени) путем переноса ацила с ацил-КоА или с фосфатидилхолина на гидроксильную группу холестерина.
Фосфатидилхолин + Холестерин àЛизофосфатидилхолин + Эфир холестерина
(кат-ся фосфатидилхолин-холестерин-ацилтрансферазой).
Т.о., холестерин в тканях может синтезироваться из любых в-в,при распаде к-х обр-ся ацетил-КоА (углеводы, АК, ЖК, глицерин).
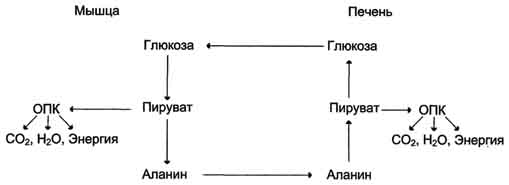
- Глюкозо-аланиновый цикл и его биологическая роль.
В условиях голодания часть белков мышечной ткани распадается до аминокислот, которые далее включаются в процесс катаболизма. Аминокислоты, которые при катаболизме превращаются в пируват или метаболиты цитратного цикла, могут рассматриваться как потенциальные предшественники глюкозы и гликогена и носят название гликогенных. Например, окса-лоацетат, образующийся из аспарагиновой кислоты, является промежуточным продуктом как цитратногр цикла, так и глюконеогенеза.
Из всех аминокислот, поступающих в печень, примерно 30% приходится на долю аланина. Это объясняется тем, что при расщеплении мышечных белков образуются аминокислоты, многие из которых превращаются сразу в пируват или сначала в оксалоацетат, а затем в пируват. Последний превращается в аланин, приобретая аминогруппу от других аминокислот. Аланин из мышц переносится кровью в печень, где снова преобразуется в пируват, который частично окисляется и частично включается в глюкозонеогенез. Следовательно, существует следующая последовательность событий (глюкозо-аланиновый цикл): глюкоза в мышцах → пируват в мышцах → аланин в мышцах → аланин в печени → глюкоза в печени → глюкоза в мышцах (рис. 7-52). Весь цикл не приводит к увеличению количества глюкозы в мышцах, но он решает проблемы транспорта аминного азота из мышц в печень и предотвращает лактоацидоз.
- Задача. Больной недавно приехал с Севера. Жалуется на сильные головные боли, недомогание. Под кожей заметны точечные кровоизлияния. При опросе оказалось, что больной часто употреблял в пищу печень белого медведя. С каким гипервитаминозом вы имеете дело? Каков механизм действия этого витамина?
Гипервитаминоз А – это состояние, развивающееся при чрезмерном поступлении и накоплении в организме витамина А (ретинол).
Ретинол является жирорастворимым витамином, поэтому его избыток плохо выделяется с мочой, что приводит к накоплению витамина в организме. В обычных дозах ретинол участвует в световосприятии (чувствительность глаз к свету), обновлении кожи (регенерации) и созревании сперматозоидов (мужских половых клеток). В повышенных дозах действует токсически (оказывает отравляющее действие на организм), особенно на печень.

6билет.
















