Производственные сточные воды от технологических процессов многих отраслей промышленности содержат щелочи и кислоты. В большинстве кислых сточных вод содержатся соли тяжелых металлов, которые необходимо выделять из этих вод. С целью предупреждения коррозии материалов канализационных очистных сооружений, нарушения биохимических процессов в биологических окислителях и водоемах, а также осаждения из сточных вод солей тяжелых металлов кислые и щелочные стоки подвергают нейтрализации.
Нейтрализацию осуществляют смешением кислых и щелочных сточных вод, добавлением реагентов, фильтрованием кислых вод через нейтрализующие материалы и абсорбцией кислых газов щелочными водами или абсорбцией аммиака кислыми водами. На практике реагент вводят в избытке (на 10 % больше расчетного количества).
Реакция нейтрализации - это химическая реакция между веществами, имеющими свойства кислоты и основания, которая приводит к потере характерных свойств обоих соединений. Наиболее типичная реакция нейтрализации в водных растворах происходит между гидратированными ионами водорода и ионами гидроксида, содержащимися соответственно в сильных кислотах и основаниях: Н++ ОН- = Н2О. В результате концентрация каждого из этих ионов становится равной той, которая свойственна самой воде (около 10-7), т.е. активная реакция водной среды приближается к рН = 7. При спуске сточных вод в водоем или в городскую канализационную сеть практически нейтральными следует считать смеси с рН = 6,5…8,5. Следовательно, подвергать нейтрализации следует сточные воды с рН менее 6,5 и более 8,5.
Наиболее часто сточные воды загрязнены минеральными кислотами: серной Н2SO4, азотной НNОз, соляной НС1, а также их смесями. Значительно реже в сточных водах встречаются азотистая HNO2, фосфорная Н3РO4, сернистая Н2SО3, сероводородная H2S, плавиковая HF, хромовая Н2СrO4 кислоты, а также органические кислоты: уксусная CH3COOH, пикриновая НОС6Н2(NO2)3, угольная H2СО3, салициловая С6Н4(ОН)2 и др.
При химической очистке применяют следующие способы нейтрализации:
а) взаимная нейтрализация кислых и щелочных сточных вод;
б) нейтрализация реагентами (растворы кислот, негашеная известь СаО, гашеная известь Ca(OH)2, кальцинированная сода Na2CO3, каустическая сода NaOH, аммиак NH3OH);
в) фильтрование через нейтрализующие материалы [известь, известняк СаО3, доломит CaCO3·MgCO3, магнезит MgCO3, обожженный магнезит MgO, мел СаСО3 (96…99 %)];
г) нейтрализация щелочных сточных вод дымовыми газами.
Нейтрализация сточных вод путем смешения кислых сточных вод со щелочными. Режимы сброса сточных вод, содержащих кислоту и отработанную щелочь, какправило, различны. Кислые воды обычно сбрасываются в канализацию равномерно втечение суток и имеют постоянную концентрацию; щелочные воды сбрасываются периодически по мере того, как сбрасывается щелочной раствор. В связи с этим для щелочных вод часто необходимо устраивать регулирующий резервуар, объем которогодолжен быть достаточным, чтобы принять суточное количество щелочных сточныхвод. Из резервуара эти воды равномерно выпускают в камеру реакции, где в результатесмешения их с кислыми сточными водами происходит взаимная нейтрализация.
Нейтрализация сточных вод путем добавления реагентов. Если на промышленных предприятиях имеются только кислые или только щелочные сточные воды либо если невозможно обеспечить взаимную нейтрализацию, применяют реагентный метод нейтрализации. Этот метод наиболее широко используют для нейтрализации кислых сточных вод.
Процессы реагентной нейтрализации сточных вод осуществляются на нейтрализационных установках (рис. 4.1).

Рис. 4.1. Рис. 4.1. Принципиальная схема станции реагентной нейтрализации:
I, II — подача соответственно кислых и щелочных сточных вод; III, IV — выпуск соответственно нейтрализованных сточных вод и осадка:
1 — песколовки; 2 — усреднители; 3 — склад реагентов; 4 — растворные баки; 5 — дозатор; 6 — смеситель; 7 — нейтрализатор;
8 — отстойник; 9 — осадкоуплотнитель; 10 — вакуум-фильтр; 11 — накопитель обезвоженных осадков; 12 — шламовые площадки.
Выбор реагента для нейтрализации кислых сточных вод зависит от вида кислот и их концентрации, а также от растворимости солей, образующихся в результате химической реакции. Для нейтрализации минеральных кислот применяют любой щелочной реагент, но чаще всего известь и карбонаты кальция или магния в виде суспензии. Известь для нейтрализации применяют в виде известкового молока 5 %-ной концентрации или в виде порошка. Наибольший эффект достигается при измельчении до частиц размером 5…10 мкм (60…70 %) и до 10…100 мкм (30…40 %). Для приготовления известкового молока известь гасят в известегасилках, барабанных аппаратах или шаровых мельницах
Схема аппарата для безотходного гашения показана на рис. 4.2. Барабан диаметром 1300 мм вращается на горизонтальном валу с частотой 23…25 мин-1. В барабан загружают чугунные шары диаметром 50 и 70 мм. Производительность барабана по извести 12…15 т/сут.
Для перемешивания реагента со сточной водой применяют гидравлические и механические смесители.
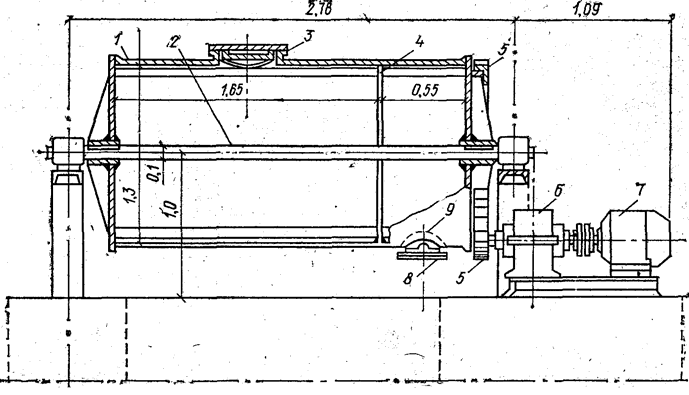
Рис. 4.2. Аппарат для гашения извести:
1 — барабан; 2 — горизонтальный вал;
3 — верхний люк: 4 — перегородка; 5 — шестерни; 6 — редуктор;
7 — электродвигатель; 8 — нижний люк; 9 — сетка.
При высокой концентрации сульфат кальция выпадает в осадок, поэтому при нейтрализации сильных кислот, кальциевые соли которых труднорастворимы в воде, необходимо устраивать отстойники-шламонакопители. Существенным недостатком метода нейтрализации серной кислоты известью является также образование пересыщенногораствора гипса, выделение которого из сточной воды может продолжаться несколькосуток, что приводит к зарастанию трубопроводов и аппаратуры. Для уменьшения коэффициента пересыщения используется метод рециркуляции образующегося в результате нейтрализации осадка сульфата кальция.
В кислых и щелочных сточных водах всегда присутствуют ионы металлов, поэтому дозу реагента следует определять с учетом выделения в осадок солей тяжелых металлов.
Расход реагентов для нейтрализации Q (в м3/ч) сточных вод находят из зависимости (в кг/ч)
 ,
,
количество реагентов для нейтрализации кислых вод, содержащих соли тяжелых металлов, определяют из соотношения
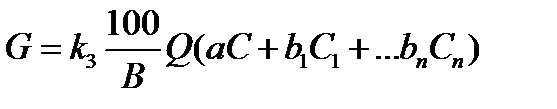
где k3 — коэффициент запаса; В — количество активной части в товарном продукте, %; a — удельный расход реагента, кг/кг; С — концентрация кислоты или щелочи, кг/м3; С1, С2,.., Сn — концентрация металлов, кг/м3; b1, b2,.., bn — удельный расход реагента, кг/кг.
Количество сухого вещества осадка М, кг, которое образуется при нейтрализации 1 м3 сточной воды, содержащей свободную серную кислоту и соли тяжелых металлов, определяется по формуле
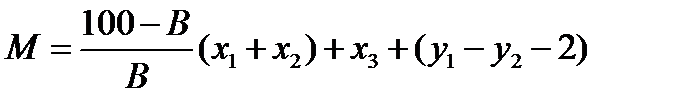 ,
,
где B — содержание активной СаО в используемой извести, %; x 1, x 2 — количество активной СаО, необходимой соответственно для осаждения металлов и для нейтрализации свободной серной кислоты, кг; х 3—количество образующихся гидроксидов металлов, кг; y 1, y 2 — количество сульфата кальция, образующегося при осаждении соответственно металлов и при нейтрализации свободной серной кислоты, кг.
Если значение третьего члена в формуле отрицательно, то он не учитывается.
Объем осадка V oc, %,, образующегося при нейтрализации 1 м3 сточной воды, можно найти по уравнению
 ,
,
где w вл — влажность осадка, %.
Пример 4.1. Требуется рассчитать установку для нейтрализации сточных вод металлургического завода при следующих исходных данных: расход сточных вод, включающих отработавшие травильные растворы, регенерация которых экономически нецелесообразна, промывные воды и смывы с полов Q = 315 м3/сут; поступление стоков на нейтралкзационную установку носит периодический характер; содержание серной кислоты в сточных водах C = 12 кг/м3, а сульфата железа С 1 = 10 кг/м3.
Предусматривают нейтрализацию отработавших травильных растворов негаше-
ной известью в виде известкового молока, при этом происходят следующие реакции:
— с серной кислотой:
H2SO4 + CaO + H2O = CaSO4 + 2H2O,
98 56 18 136 36
⎯ сульфатом железа:
FeSO4 + CaO + H2O = CaSO4 + Fe(OH)2.
152 56 18 136 90
На основании вышеприведенных реакций и исходных данных по содержанию свободной кислоты и связанного железа в сточных водах определяем расход извести на нейтрализацию кислых сточных вод и осаждение железа по формуле

По табл. 4.1 определяем удельный расход негашеной извести на нейтрализацию серной кислоты а = 0,56, а по табл. 4.2 — количество негашеной извести, требуемое для перевода железа из растворенного состояния в осадок, b 1 = 1,0 (в пересчете на сульфат железа FeSO4 b 1 = 0,37).
Таблица 4.1
Количество реагентов для нейтрализации 100 %-х кислот и щелочей
| Щелочи
| Кислоты
|
|
| Серная
| Соляная
| Азотная
| Уксусная
|
| Негашеная известь
| 0,56/1,79
| 0,77/1,30
| 0,46/2,2
| 0,47/2,15
|
| Гашеная известь
| 0,76/1,32
| 1,01/0,99
| 0,59/1,7
| 0,62/1,62
|
| Кальцинированная сода
| 1,08/0,93
| 1,45/0,69
| 0,84/1,19
| 0,88/1,14
|
| Каустическая сода
| 0,82/1,22
| 1,1/0,91
| 0,64/1,57
| 0,67/1,5
|
| Аммиак
| 0,35/2,88
| 0,47/2,12
| 0,27/3,71
|
|
| Примечание. В числителе показан расход щелочи на 1 г кислоты, в знаменателе — расход кислоты на 1 г щелочи.
|
Таблица 4.2
Количество реагентов, требуемое для удаления металлов
| Металлы
| Реагенты
|
| СаО
| Са(ОН)2
| Na2CО3
| NaOH
|
| Цинк
| 0,85
| 1,13
| 1,6
| 1,22
|
| Никель
| 0,95
| 1,26
| 1,8
| 1,36
|
| Медь
| 0,88
| 1,16
| 1,66
| 1,26
|
| Железо
| 1,0
| 1,32
| 1,9
| 1,43
|
| Свинец
| 0,27
| 0,36
| 0,51
| 0,38
|
| | | | | | | |
Для известкового молока K = 1,1; B = 50 %

Известь приготовляют в виде известкового молока в растворных баках общей емкостью
 ,
,
где ρ – плотность воды, ρ = 1000 кг/м3; n — число заготовок известкового молока в сутки, n = 6; z — концентрация известкового молока по гашеной извести, z = 7 %.
Принимаем два железобетонных бака прямоугольной формы, размерами 3×3 и глубиной наполнения 1,8 м; в баках устанавливают лопастные мешалки с вертикальной осью и частотой вращения 40 мин-1.
Известковое молоко из растворных баков подаем в дозатор. Расход известкового молока

Общий расход нейтрализуемого отработавшего травильного раствора q ст и известкового молока
q общ = q ст + q из = 3,65 + 1,11 = 4,76
Смешение нейтрализуемого раствора с известковым молоком производят в смесителе, время перемешивания t см = 5 мин. Вместимость смесителя
V см = q общ 60 t см/1000 = 4,76.60.5/1000 = 1,43 м3.
Смеситель принимают круглым в плане со следующими размерами
D см = 1,4 м; Н см = 1 м. В смесителе устанавливают лопастную мешалку с частотой вращения 40 мин-1.
Из смесителя сточные воды подают в проточную камеру нейтрализации, объем которой рассчитывают, исходя из продолжительности нейтрализации t н = 30 мин:
V н = q общ 60 t н/1000 = 4,76.60.30/1000 = 8,6 м3.
Размеры камеры нейтрализации в плане 2,4 × 2,4 м, глубина 1,5 м; камеру нейтрализации оборудуют мешалкой с частотой вращения 40 мин-1.
После нейтрализации сточные воды подают в отстойники вертикального типа с продолжительностью отстаивания не менее 2 ч.
Нейтрализация кислых сточных вод путем фильтрования через нейтрализующие материалы. Нейтрализация соляно- и азотнокислых, а также сернокислыхсточных вод при концентрации серной кислоты не более 1,5 г/л происходит на непрерывно действующих фильтрах. В качестве загрузки применяют такие нейтрализующиематериалы, как доломит, известняк, магнезит, мел, мрамор и др. Крупность фракцийматериала загрузки 3…8 см; расчетная скорость фильтрования зависит от вида загрузочного материала, но не более 5 м/ч; продолжительность контакта не менее 10 мин.
Высоту загрузки Н для сточных вод, содержащих HCI и HNO3 принимают равной 1…1,5 м, а содержащих H2SO4 — равной 1,5…2 м. Вода фильтруется сверху вниз или снизу вверх.
Применение таких фильтров возможно при условии отсутствия в кислых сточных водах растворенных солей металлов, поскольку при рН > 7 они будут выпадать в осадок в виде труднорастворимых соединений, которые полностью забивают поры фильтра. Ограничивается применение нейтрализующих фильтров при подаче на них сернокислых сточных вод с концентрацией серной кислоты более 1,5 г/л.
Установка состоит из усреднителя, устройств для дробления и классификации загрузки, дозаторов, насосов для перекачки промывных вод и аппаратов для удаления взвешенных веществ из промывных вод.
При нейтрализации сточной воды на вертикальном фильтре высоту слоя загрузочного материала Н, см, определяют по эмпирической формуле
H = Kd n (3+ lg b) √ v,
где K и n — эмпирические константы; d — диаметр зерен загрузочного материала, мм; b — концентрация кислоты, г-экв./л; v — скорость фильтрования, равная 4…8 м/ч.
Величина n относительно постоянна и в среднем равна 1,47. Величина K зависит от сорта доломита.
После определения величины Н подсчитывают площадь фильтрования f, м2, по формуле
F = q / v,
где q —расход нейтрализуемых сточных вод, м3/с; v — скорость фильтрования, м/с.
Далее определяют суточный расход реагента М, т/сут (загрузочного материала):
M = a С Q /1000,
где а — расход щелочного реагента на нейтрализацию; С — концентрация кислоты, кг/м3; Q — расход нейтрализуемых сточных вод, м3/сут.
Так как полное (100 %-ное) использование активной части загрузочного материала фильтра практически невозможно, вводится коэффициент для определения фактического расхода материала М ф (например, для доломита М ф = 1,5 М).
В зависимости от высоты слоя загрузочного материала, площади фильтрования и местных условий назначается число фильтров и определяются их конструктивные размеры в плане.
Продолжительность работы фильтра без перегрузки определяется по формуле
 ,
,
где ρ — плотность загрузочного нейтрализующего материала (для доломита, известняка и мрамора ρ = 2800 кг/м3, магнезита — 3000 кг/м3, мела — 2700 кг/м3); М -расход реагента, кг/сут; k — коэффициент, учитывающий неполноту использования загрузочного материал.
Длину горизонтального фильтра-нейтрализатора находят по формуле (в м)
L = v τ.
Продолжительность контакта сточных вод с загрузочным материалом:
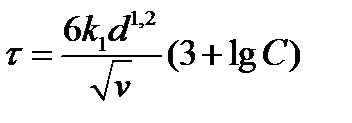 ,
,
где k 1 —коэффициент, характеризующий активность материала (для подмосковного доломита k 1 = 1,87, уральского — 3,96); d — средний диаметр материала загрузки, см; С — концентрация кислоты в воде, г-экв./л.
Аппаратуру и трубопроводы изготовляют из кислотоупорных материалов.
Нейтрализация дымовыми газами. Применение для нейтрализации щелочных сточных вод отходящих газов, содержащих CО2, SО2, NO2 и другие кислые газы, позволяет не только нейтрализовать сточные воды, но и одновременно осуществлять высокоэффективную очистку самих газов от вредных компонентов. Нейтрализация производится в колонной абсорбционной аппаратуре, расчет которой основан на закономерностях хемосорбции.
Использование для нейтрализации щелочных сточных вод диоксида углерода имеет ряд преимуществ по сравнению с применением серной или соляной кислот, позволяет резко снизить стоимость процесса нейтрализации. Вследствие плохой растворимости СО2 уменьшается опасность переокисления нейтрализованных растворов. Образующиеся карбонаты находят большее применение по сравнению с сульфатами или хлоридами, кроме того коррозионные и токсичные воздействия СО32- ионов в воде меньше, чем ионов SO42- и С13-.
Нейтрализация щелочных вод дымовыми газами является примером ресурсосберегающей технологии, позволяющей исключить использование кислот, создать бессточнуто схему водопотребления. При этом ликвидируется сброс сточных вод, сокращается потребление свежей воды, а также очищаются дымовые газы от кислых компонентов (СО2, SO2 и др.) и пыли.






 ,
,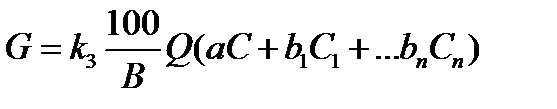
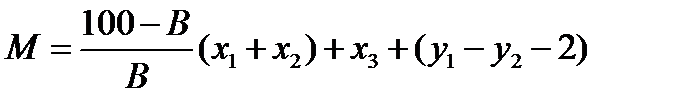 ,
, ,
,

 ,
,
 ,
,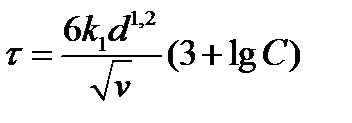 ,
,


