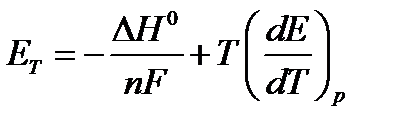Устройства, в которых проводят те или иные процессы электрохимического воздействия на водные растворы, имеют общее название — электролизеры. Общая принципиальная схема таких устройств представлена на рис. 3.17.

Рис. 3.17. Схема электролизера:
1 — внешняя цепь; 2 — емкость; 3 — анод; 4 — катод; 5 — источник
питания.
Вода поступает в емкость 2, в которую погружены два электрода 3, 4, соединенные с источником тока 5. Под действием электрического поля положительно заряженные ионы мигрируют к отрицательному электроду — катоду, а отрицательно заряженные ионы — к положительному электроду — аноду. На электродах происходит переход электронов. Катод отдает электроны в раствор, и в приэлектродном пространстве происходят процессы, связанные с присоединением электронов к реагирующим частицам
— восстановление. В прианодном пространстве протекают процессы переноса электронов от реагирующих частиц к электроду — окисление.
Иногда схему усложняют, разделяя полупроницаемой перегородкой (диафрагмой или ионообменной мембраной) катодное и анодное пространства. Тогда поступающая на обработку вода либо последовательно проходит каждую из двух образовавшихся камер, либо циркулирует в одной из них.
В зависимости от природы процессов, протекающих в таких аппаратах и обеспечивающих извлечение или обезвреживание загрязняющих компонентов, электролизеры разделяют на следующие типы: электрокоагуляторы, электрофлотаторы, электролизеры для проведения реакций окисления и восстановления и электродиализаторы.
Электрохимические коагуляторы. Коагуляция вод, содержащих мелкодисперсные и кололидные частицы, может происходить при пропуске сточных вод через электролизер с анодом, изготовленным из алюминия или железа. Металл анода под действием постоянного тока ионизируется и переходит в сточную воду, частицы загрязнений которой коагулируются образовавшимися труднорастворимыми гидроксидами алюминия или железа.
Метод электрохимического коагулирования может быть применен для обработки сточных вод, содержащих эмульгированные частицы масел, жиров и нефтепродуктов, хроматы, фосфаты. Компактность установок, отсутствие реагентного и складского хозяйства, простота обслуживания являются несомненным достоинством метода электрохимической коагуляции. Однако значительные расходы электроэнергии и металла, являющиеся следствием образования окисной пленки на поверхности электродов, их механического загрязнения примесями сточных вод, а также нагревания обрабатываемой сточной воды, ограничивают область применения этого метода.
На схеме приведена электрокоагуляционной установки по очистке производственных сточных вод, содержащих нефтепродукты и взвешенные вещества в концентрации соответственно 0,3…7,5 и 0,5…8 г/л.

Рис. 3.18. Электрокоагуляционная установка:
1 –насос; 2 – бункер для осадка; 3 – гидроциклон; 4 – выпрямитель; 5 – выпуск очищенной воды; 6 – уловленные нефтепродукты; 7 – вертикальный отстойник; 8 – электродный блок; 9 – выгрузка осадка.
При электрокоагуляции в резервуаре (электрокоагуляторе) через систему плоских стальных электродов, установленных на расстоянии 10 мм друг от друга, пропускается постоянный ток плотностью 0,6 А/дм2 под напряжением 10…18 В. При продолжительности контакта сточных вод в электрическом поле 15…30 с и пропускной способности,1,5…3 м3/ч на 1 м2 площади поверхности электродов одного полюса эффективность очистки достигает 99 %. Положительные результаты получены также при обработке сточных вод цеха гальванопокрытий, где расход электроэнергии на 1 м3 обрабатываемой сточной воды составляет 0,4…0,5 кВт.ч.
Электрофлотационные установки. Сущность электрофлотационного способа очистки сточных вод заключается в переносе загрязняющих частиц из жидкости на ее поверхность с помощью пузырьков газа, образующихся при электролизе сточной воды.
В процессе электролиза сточной, воды на катоде выделяется водород, а на аноде — кислород. Основную роль в процессе флотации частиц играют пузырьки, выделяющиеся на катоде. Размер пузырьков, отрывающихся от поверхности электрода, зависит от величины краевого угла смачивания, кривизны поверхности электрода, а также его конструкции.
При применении растворимых электродов (железных или алюминиевых) на аноде происходит анодное растворение металла, в результате чего в воду переходят катионы железа или алюминия, приводящие к образованию хлопьев гидроокисей. Одновременное образование хлопьев коагулянта и пузырьков газа обеспечивает эффективность флотационного процесса. Такие установки называются электрокоагуляционно-флотационными. При пропускной способности до 10…15 м3/ч установки могут быть однокамерными, а при большей пропускной способности — двухкамерными горизонтального или вертикального типа.
Расчет установок для электрофлотации или электрофлотокоагуляции сводится к определению общего объема V y установки, объемов электродного отделения V э и камеры флотации V ф, м3, следовательно,
V у = V э + V ф.
Объем электродного отделения определяется из возможности размещения в нем необходимой электродной системы. Так, при расчете горизонтальной установки (рис.3.19) ширина секции В принимается в зависимости от производительности Q: если Q <90 м3/ч, то B = 2 м, если Q = 90…180 м3/ч, то В = 2,5…3 м.

Рис. 3.19. Горизонтальный электрофлотатор:
1 — впускная камера; 2 — решетка-успокоитель; 3 — электродная система; 4 — скребки для сгребания пены; 5 - пеносборник; 6, 7 — отвод соответственно обработанной сточной воды и шлама; 8 - отвод осадка
Число пластин электродов n э, размещаемых в установке,
n э = (B – 2 a 1 + a 2)/(δ + a 2),
где a 1 — величина зазора между крайними пластинами и стенками камеры, равная 100
мм; а 2 — величина зазора между пластинами, равная 15…20 мм;
δ — толщина пластин, равная 6…10 мм.
Тогда необходимая площадь пластин электродов f э, м2, будет
f э = f а.э/(n э -1),
где f а.э — активная поверхность электродов, м2, определяемая по формуле f а.э = E Q / i,
здесь Е — удельное количество электричества, А ч/м3; Q — расчетный расход сточных вод, м3/ч; i — плотность тока на электродах, А/м2.
Определив f э и назначив высоту пластин h э = 1…1,5 м, найдем их длину l э = f э/ h э, а затем подсчитаем длину электродной камеры
L э = l э + 2 a 1.
Тогда объем электродной камеры, м3, составит:
W э = B H э L э,
где H э — рабочая высота электродной камеры, м, равная: H э = h 1 + h 2 + h 3,
здесь h 1 — высота осветленного слоя, равная 1…1,5 м; h 2 — высота защитного слоя, равная 0,3…0,5 м; h 3 — высота слоя шлама, равная
0,4…0,5 м.
Объем флотационной камеры
V ф = Q t ф,
где t ф — продолжительность флотации, определяемая экспериментально и принимаемая обычно равной 0,3…0,75 ч.
Длину L ф и высоту H ф флотационной камеры подсчитывают исходя из ее объема W ф и ширины В.
При осуществлении процесса электрофлотокоагуляции необходимо определить количество металла электродов, переходящее в раствор, а также срок службы электродной системы:
m э = k т Э Е,
где m э — количество металла, переходящего в 1 м3 раствора, г; k т — коэффициент выхода по току, равный 0,5…0,95 (определяется экспериментально); Э — электрохимический эквивалент, г/(А·ч), равный для Fe2+, Fe3+, Al3+ соответственно 1,042; 0,695 и 0,336.
Срок службы электродной системы Т, сут,
Т = M ·1000/(m э/ Q сут),
где М — количество металла электродов, которое растворяется при электролизе, кг:
M = ρ kэ fэ δ nэ,
здесь ρ — плотность металла электродов, кг/м3; k э — коэффициент использования материала электродов, равный 0,8…0,9; Q cyт — суточный расход сточных вод, м3/сут.
Пример 3.6. Исходные данные: производительность электрофлотационного аппарата
Q = 15 м3/ч; время электрофлотации t = 0,6 ч; электрофлотационный аппарат должен работать по схеме "электрокоагуляция - флотация" с одинаковым временем пребывания сточных вод на каждой стадии; концентрация алюминия (максимальная), добавляемая в нефтесодержащие сточные воды – 20 мг/л.
1. Рабочий объем электрофлотационного аппарата
V = Q t= 15•0,6 = 9,0 м3.
2. Объем камеры электрокоагуляции и флотокамеры.
Сточные воды должны пребывать одинаковое время на стадиях электрокоагуляции и флотации, поэтому
V 1 = V 2 = V /2 = 4,5м3,
где V 1 - объем камеры электрокоагуляции; V 2 - объем флотокамеры.
3. Глубина камеры электрокоагуляции и камеры флотации выбирается с учетом проведенных испытаний пилотной электрофлотационной установки. При этом была рекомендована глубина камер электрокоагуляции и флотации в пределах 1,4...1,45 м (h ср =1,425 м).
4. Площадь поперечного сечения камер электрокоагуляции и флотации
S 1 = S 2 = V /(2• h ср) = 9,0/(2•l,425) = 3,16 м2.
5. Соотношение длины (а) и ширины (b) камер электрокоагуляции и флотации выбирается как 2:1.
Тогда
S 1= а • b = 2 b 2 = 3,16 м2,
где b = 1,26 м, а = 2,52 м.
6. Один пакет электродов включает n 1 электродов размером a (b - 0,2) м, причем электрическое подключение к пакету электродов - биполярное. Толщина пакета электродов d, как показывают экспериментальные исследования, должна составлять примерно 250 мм. Расстояние между электродами δ, в качестве которых могут быть применены дюралюминий или сталь Ст. 3, составляет около 20...22 мм в зависимости от толщины электродов d 1 (d 1 = 3 мм).
Таким образом число электродов в пакете:
 ;
;
число пакетов электродов:
N= b / d =1260/250= 5;
общее количество анодных электродных пластин
п а = n 1• N = 10•5 = 50.
7 Продолжительность работы τ (сут) анодных электродных пластин может быть определена с помощью соотношения
τ = (n а ρ S ан d 1)/(Q D Al(Fe)),
где S ан = a (b - 0,2) - рабочая поверхность анодов; ρ - плотность материала анодов; Q -производительность электрофлотационной установки; D Al(Fe) - доза алюминия (железа).
τ = (50•2,7•103•2,52•1,06•3-10)/(15•24•20•103) = 105 сут.
8. Сила тока, необходимая для поддержания концентрации алюминия в пределах до 20 мг/л:
I = (F n D Al Q)/(η A τэ),
где I - сила тока, А; F - постоянная Фарадея (96500 Кл); п - валентность, (п = 3); η-выход металла по току (η = 120); А - атомный вес металла (А = 27); τэ -время электрообработки (τэ = 24 ч).
I = (96500•3•20•10-3•15•3600•24)/(120•27•24• 3600) = 26,81 А.
9. Плотность тока в камере электрокоагуляции
j = I / S ан = 26,81/(2,52•1,04) = 10,04 А/м2.
10. В камере флотации графитовый анод располагается на днище аппарата, а сетчатый катод - на расстоянии 20...40 мм от анода. Режим электрофлотации, как показывают эксперименты по очистке нефтесодержащих сточных вод, в большинстве случаев следующий: плотность тока 10...20 мА/см2 (100...200 А/м2); время электрофлотации
τэф =0,6/2 = 0,3 ч.
Установки для извлечения металлов. Использованию электролиза для извлечения металлов из разбавленных растворов препятствует низкая удельная производительность электролизеров, особенно с плоскими электродами, по сравнению с такими процессами очистки металлов, как цементация или химическое выделение.
Для увеличения интенсивности процессов электроизвлечения металлов из сильно разбавленных по ионам металла растворов используют объемные электроды. Принцип работы электролизеров с такими электродами заключается в том, что подвергаемый обработке раствор пропускают через каналы в теле объемного электрода, потенциал которого поддерживают на уровне, обеспечивающем протекание процесса извлечения с максимально возможной скоростью, т. е. при предельной силе диффузионного тока.
Электрохимические установки позволяют решать задачи, связанные с концентрированием солей металлов, содержащихся в сточных водах, и возвратом концентрированных растворов для повторного использования. Принцип действия такой установки поясняется схемой, представленной на рис. 3.20. Электролиз сточной воды проводят в аппарате, разделенном диафрагмой или ионообменной мембраной на две камеры — 1 и 2. В каждой камере установлены пластинчатые электроды. В процессе обработки воды периодически изменяют направление тока, с тем чтобы изменялась полярность элекродов в камерах 1 и 2.

Рис. 3.20. Установка для концентрирования растворов солей металлов:
а — в камере 1 выделяется металл на электродах, в камере 2 происходит растворение металла; б — в камере 1 растворяется металл, в камере 2 выделяется металл на электродах; V — поток сточной воды;
1 V, 2 V — сточная вода, направляемая в катодную и анодную камеры электролизера соответственно.
Сточная вода, направляемая на очистку, разделяется на два потока. Один поток— большая часть сточной воды — направляется в камеру 1, в которой электроды работают в режиме катода (рис. 3.20, а), и происходит разряд ионов металла с образованием осадка. Очищенная вода в этом случае выходит из камеры 1. Второй поток — меньшая часть сточной воды — поступает в камеру 2, где на аноде происходит растворение металла, осажденного в предыдущем цикле его работы как катода (рис. 3.20, б). При смене полярности электродов одновременно перераспределяют и потоки воды. Таким образом, например, удается повысить содержание сернокислых солей меди в промывочных водах с 0,8 г/л до нескольких десятков и вернуть раствор солей на повторное использование.
Природа материала электродов, а во многих случаях и подготовка их оказывают большое влияние на направление и ход реакций при очистке воды от загрязнителей. Аноды можно изготовлять из металлов, которые устойчивы в водных растворах при потенциалах выделения кислорода. В кислых растворах эти потенциалы выше +1,23 В, а в щелочных выше + 0,4 В. В этой области потенциалов устойчивы металлы платиновой группы, графит, а также оксиды некоторых металлов. Металлы платиновой группы не применяют так как они дорого стоят. Удовлетворяют перечисленным требованиям некоторые модификации графита. Недостатком графитовых электродов является их медленное разрушение вследствие постепенного окисления графитовой поверхности до диоксида и оксида углерода. Скорость разрушения анодов из графита определяется пористостью графита. Для устранения отрицательного влияния пор аноды пропитывают различными материалами, уменьшающими смачиваемость поверхности и препятствующими попаданию электролита в поры.
Высокую электропроводность и достаточную химическую стойкость электродов в щелочных средах обеспечивают оксиды таких металлов, как медь, никель, кобальт, железо. Так, в процессах очистки воды часто используют магнетит FeO • Fe 2 O 3.
К катодным материалам предъявляют менее жесткие требования в отношении их коррозионной устойчивости, чем к анодным материалам. Выбор катодного материала зависит от назначения и условий проведения очистки; основным показателем, служащим для его выбора — является величина перенапряжения при выделении водорода.
По величине перенапряжения электродные материалы разделяются на две группы: с низким (железо, никель и др.) и высоким (графит, цинк и др.) перенапряжением.
Для процессов очистки воды, в которых определяющую роль играет анодный процесс (деструктивные методы), а катодный процесс в большинстве случаев имеет второстепенное значение, в качестве катодного материала выбирают металлы из первой группы, руководствуясь энергетическими затратами.
Для процессов обработки воды, в которых катодная реакция обеспечивает удаление загрязнителей (выделение металлов, перевод вещества в менее токсичное соединение и др.), целесообразно использовать электроды с высоким перенапряжением при выделении водорода, что позволяет облегчить протекание таких реакций.
При расчете электролизеров определяют полезный объем электролизера, поверхность электродов и нагрузку по току, расход энергии на обработку воды. Для расчета исходными данными являются: расход сточной воды, общее содержание минеральных солей и загрязняющих компонентов в ней, время обработки воды. Объем электролизера определяют из выражения
V = Qt,
где Q — расход сточной воды, м3/с; t — время обработки, с.
Нагрузку по току находят ориентировочно из выражения
 ,
,
где q — теоретическое количество электричества, необходимое для обезвреживания или очистки загрязнителя и определяемое по закону Фарадея; C 0 – начальная концентрация загрязнителя; BT — коэффициент полезного использования электроэнергии — выход по току, доли единицы.
Общая поверхность электродов
 ,
,
где d — расстояние между электродами, м.
Часто из предварительных экспериментов известны коэффициент полезного использования энергии BT (выход по току), а также оптимальные значения удельной силы тока, приходящейся на единицу поверхности электрода (плотность тока). В этом случае размеры электродов анода и катода могут быть определены из выражения

где I — общая нагрузка по току, А; j — плотность тока, А/м2.
При извлечении металлов, а также в том случае, когда загрязняющий компонент претерпевает изменения исключительно в результате электродной реакции и скорость процесса лимитируется доставкой разряжающихся частиц к электроду, поверхность электрода можно определить из выражения
 ,
,
где m υ — объемная скорость движения воды через аппарат, м3/с;
K m — коэффициент массопередачи, равный отношению D/ δ, м/с; Сн — начальная концентрация металлов; Ск — конечная концентрация металлов на выходе из аппарата; D – коэффициент диффузии, м2/с; δ — толщина диффузионного слоя, м.
Расход энергии на электрохимическую обработку является основной величиной, определяющей эксплуатационные затраты на установки и их конкурентоспособность.
Расход энергии W обычно относят к 1 м3 очищаемой воды или (при утилизации ценных компонентов) к единице массы извлеченного вещества. Величина W определяется напряжением на электродах, расстоянием между ними, удельным сопротивлением и другими характеристиками обрабатываемой воды.
Рассмотрим вклад каждой из перечисленных составляющих в расход электроэнергии. Величину W можно выразить как
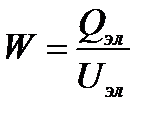 ,
,
где Qэл — количество электричества, затраченное на обработку 1 м3 воды; U эл — напряжение на электролизере. Необходимое для обработки воды количество электричества зависит от содержания загрязнителя и вида электрохимической очистки. В процессах электрохимического окисления его удается оценить, если предположить, что для осуществления анодной деструкции до необходимой степени окисления органических соединений достаточно получить в результате электродной реакции количество кислорода, равное величине ХПК; тогда значение Qэл определяется из выражения (в А•ч/м3)
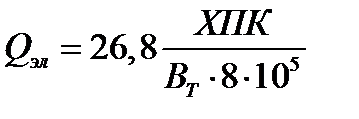 .
.
Приближенность такого определения заключается в допущении, что как при химическом окислении (определение ХПК), так и при электрохимической деструкции окисление идет до одинаковой глубины, а также одинаковы состав и количество продуктов, уносимых с газовой фазой.
Если известна анодная реакция и присутствует один токсичный компонент, например в случае окисления в сточных водах цианид-ионов.
 ,
,
то количество электричества, необходимое для обезвреживания ионов CN −, можно рассчитать из уравнения (в А/ч)
 ,
,
где C 0— исходная концентрация цианидов в сточных водах, г/м3; V — объем сточных вод в электролизере, м3; 2,06 — электрохимический эквивалент окисления ионов CN −, А•ч/г.
Необходимость предварительного расчета количества электричества, потребляемого для очистки, обусловлена высокой химической активностью и токсичностью окислителей, которые образуются в ходе электродных реакций (в частности, хлора), и стремлением избежать накопления их в избыточных количествах. В некоторых случаях величина Qэл известна из предварительных исследований.
Общее напряжение на аппаратах электрохимической очистки воды складывается из теоретического напряжения, перенапряжения на электродах, концентрационной поляризации, падения напряжения в электролите, диафрагме, электродах и контактах. Напряжение на одной секции аппарата (одна пара электродов) определяется из выражения
 ,
,
где Eа и Eк — термодинамические (обратимые) значения потенциалов анода и катода,В; η а и η к — перенапряжение на аноде и катоде, В; Δ E конц — величина концентрационной поляризации, В; Δ U эл — падение напряжения в электролите, В; Δ U д — падение напряжения в диафрагме или мембране, В; Δ U 1, Δ U 2— падение напряжения в электродах и контактах соответственно, В.
Для отдельных видов обработки вклад каждой составляющей U будет различным. Для электрофлотаторов и электрокоагуляторов, а также аппаратов электрохимической очистки окислением и восстановлением в общем балансе напряжений будут преобладать значения Е а, E к, ηа, ηк. Для электродиализаторов основной составляющей баланса является падение напряжения на мембранах и в растворе: Δ U д, Δ U эл.
Теоретическое напряжение разложения Е т = Е а – Е к на электролизере можно определить, исходя из термодинамических данных:
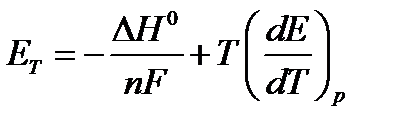
где Δ Н 0 — энтальпия реакции разложения; п — число электронов, участвующих в реакции; F — число Фарадея; ∂ F / ∂ T — температурный коэффициент, В/К.
Для реакции разряда молекул воды величина теоретического напряжения разложения воды в изотермических условиях Е т = 1,481 В, а величина P (∂ F / ∂ T) составляет 0,00085 В/ К. Для условий, отличных от стандартных, значения Е а и Е к определяются в зависимости от р Н обрабатываемой воды из уравнений (при Т = 293 К):
Е а = 1,23 — 0,059 р Н; Е к = - 0,059 р Н.
Величины перенапряжения на катоде ηк и аноде ηа зависят от реакции, протекающей на электроде. Для реакции выделения водорода используют уравнение Тафеля:

где а, b — константы, зависящие от природы материала катода (справочные данные); j – плотность тока, А/м2.
Величина Δ E конц характерна для аппаратов, в которых удаление ионов металлов происходит в результате катодной реакции восстановления. В этом случае скорость процесса обусловлена замедленностью массопереноса удаляемых ионов к электроду.
Точный расчет концентрационной поляризации возможен лишь для аппаратов, в которых массоперенос можно контролировать. Приближенную оценку Δ E конц для случая стационарной диффузии можно дать на основании уравнения

где n — числа электронов, участвующих в реакции; j, j пр.к — плотности тока и предельного тока диффузии электродной реакции соответственно, А/м2.
Величину Δ U д определяют для аппаратов, в которых анодное пространство отделено от катодного диафрагмой или ионообменной мембраной. Для электролизеров с диафрагмой справедливо выражение
Δ U д = I • R д,
где I — сила тока (А), протекающего через электролизер;
R д — сопротивление диафрагмы

ρ — удельное электросопротивление электролита в порах диафрагмы с учетом газонаполнения, Ом•м; δ — толщина диафрагмы, м;β — коэффициент извилистости пор, β =1,2…1,3; S — поверхность диафрагмы, м2;
пд — объемная пористость диафрагмы.
Падение напряжения, возникающее при прохождении тока через раствор, для аппаратов с плоскопараллельными электродами рассчитывают по закону Ома
Δ U эл = j •ρ• l,
где j — плотность тока, А/м2; ρ — удельное сопротивление электролита, Ом•м; l —расстояние между электродами, м.
Падение напряжения в проводниках Δ U 1 первого рода рассчитывают по закону Ома, падение напряжения в контактах определяют с учетом материала контактирующих пар металлов (по справочной литературе).
Электродиализаторы. Электродиализ— процесс сепарации ионов солей, осуществляемый в мембранном аппарате под действием постоянного электрического тока, применяемый для опреснения высокоминерализованных сточных вод.
Электродиализатор разделен чередующимися катионитовыми и анионитовыми мембранами, образующими концентрирующие (рассольные) и обессоливающие (дилюатные) камеры. Под воздействием постоянного тока катионы, двигаясь к катоду («—»), проникают через катионитовые мембраны, но задерживаются анионитовыми, а анионы, двигаясь в направлении анода («+»), проходят через анионитовые мембраны, но задерживаются катионитовыми. В результате этого из одного ряда камер (например, четных) ионы обоих знаков выводятся в смежный ряд камер.
Мембраны для электродиализатора изготовляют в виде гибких листов прямоугольной формы или рулонов из термопластичного полимерного связующего и порошка ионообменных смол.





 ;
;
 ,
, ,
,
 ,
,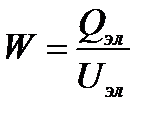 ,
,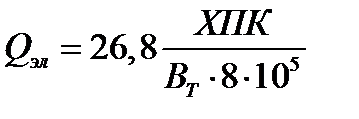 .
. ,
, ,
, ,
,