В основе расчета теплового эффекта взрывчатого превращения ВВ используется закон Г.Н.Гесса (1840 г.), основанный на первом начале термодинамики.
В соответствии с этим законом тепловой эффект некоторой последовательности химических реакций не зависит от пути превращения исходных веществ в конечные продукты, а определяется только начальным и конечным состояниями системы.
Рис. 4.2. Треугольник Гесса
Вычисление теплот сгорания и взрыва по теплотам образования на основании закона Гесса можно проиллюстрировать схемой, представленной на рис. 4.2, которую называют треугольник Гесса. Вершины углов треугольника соответствуют различным состояниям системы.
Согласно закону Гесса алгебраическая сумма теплот реакций при переходе системы по первому пути (1-2-3) равняется теплоте, выделенной при переходе системы по второму пути (1-3):
 (4.12)
(4.12)
и, следовательно, теплота горения или взрыва равняется теплоте образования продуктов взрыва минус теплота образования ВВ.
 . (4.13)
. (4.13)
или
 (4.14)
(4.14)
где

- теплота взрыва ВВ, кДж/моль (ккал/моль);
 - суммарная теплота образования продуктов взрыва с учетом числа их грамм-молей -
- суммарная теплота образования продуктов взрыва с учетом числа их грамм-молей -  , кДж/моль (ккал/моль). Здесь
, кДж/моль (ккал/моль). Здесь  - теплота образования i-го продукта взрыва;
- теплота образования i-го продукта взрыва;
 - суммарная теплота образования компонент ВВ с учетом числа их грамм-молей -
- суммарная теплота образования компонент ВВ с учетом числа их грамм-молей -  , кДж/моль (ккал/моль). Здесь
, кДж/моль (ккал/моль). Здесь  - теплота образования i-ой компоненты ВВ.
- теплота образования i-ой компоненты ВВ.
Значение теплоты взрыва  будет тем выше, чем ниже теплота образования ВВ или его компонент и чем выше теплоты образования ПВ (теплотворная способность горючих элементов).
будет тем выше, чем ниже теплота образования ВВ или его компонент и чем выше теплоты образования ПВ (теплотворная способность горючих элементов).
Теплоты образования компонент ВВ и продуктов взрыва приводятся в термохимических таблицах, например в [5].
Пример 4.3. Определить теплоту взрыва нитроглицерина (глицеринтринитрата).
Реакция взрывчатого превращения нитроглицерина по Бертло (Кб >0) имеет вид
C3H5(ONO2)3 = 2,5H2O + 3CO2 + 1,5N2 + 0,25O2.
По термодинамическим таблицам (Приложение 1) находится теплота образования нитроглицерина, равная  = 344,5 кДж/моль.
= 344,5 кДж/моль.
Определяется суммарная теплота образования ПВ для парообразного состояния воды в ПВ (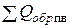 )
)
 кДж/г-моль,
кДж/г-моль,
где q 1 = 240,6 кДж/моль - теплота образования моля H2O в парообразном состоянии;
q 2 = 395,6 кДж/моль - теплота образования моля CO2.
Откуда
 = 1443,8 кДж/моль.
= 1443,8 кДж/моль.
Для 1 кг ВВ осуществляется перерасчет по формуле
 , кДж/кг, (4.15)
, кДж/кг, (4.15)
где  - молекулярный вес ВВ.
- молекулярный вес ВВ.
Откуда для 1 кг нитроглицерина
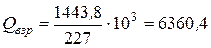 , кДж/кг.
, кДж/кг.
Здесь  = 227 - молекулярный вес нитроглицерина.
= 227 - молекулярный вес нитроглицерина.
Для многокомпонентных ВВ, если реакция взрывчатого превращения составлена не для 1 кг ВВ, масса ВВ определяется выражением
 = М 1 m 1 + М 1 m 2 +…..+ М n m n,
= М 1 m 1 + М 1 m 2 +…..+ М n m n,
где M 1, M 2… - грамм-молекулярные веса компонентов ВВ;
m 1, m 2… - число молей компонентов ВВ.
Очевидно, при расчете для 1 кг ВВ  = 1000 г, а получаемое значение теплоты взрыва
= 1000 г, а получаемое значение теплоты взрыва  имеет размерность кДж/кг или ккал/кг.
имеет размерность кДж/кг или ккал/кг.
4.6.3. Определение теплоты сгорания и образования ЭМ (ВВ) по Карашу
При отсутствии справочных данных теплоты образования ВВ могут быть вычислены по расчетной теплоте сгорания. Расчет теплоты сгорания по методу Караша основан на современных представлениях о валентности и на многочисленных опытных данных, полученных исследователями при изучении зависимости теплового эффекта сгорания вещества от его химического строения [1,8].
Реакция сгорания вещества в атмосфере кислорода имеет вид
 . (4.16)
. (4.16)
Используя закон Гесса для условий сгорания ВВ, определим теплоту его образования.
По закону Гесса
 . (4.17)
. (4.17)
Здесь  - суммарная теплота образования ВВ или его компонентов с учетом числа их грамм-молей -
- суммарная теплота образования ВВ или его компонентов с учетом числа их грамм-молей - 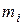 кДж/моль (ккал/моль);
кДж/моль (ккал/моль);

- теплота сгорания ВВ, кДж/моль (ккал/моль);
 - суммарная теплота образования продуктов сгорания с учетом числа их грамм-молей -
- суммарная теплота образования продуктов сгорания с учетом числа их грамм-молей -  , кДж/моль (ккал/моль).
, кДж/моль (ккал/моль).
Откуда теплота образования ВВ
 ,
,
или
 =
=  . (4.18)
. (4.18)
При разработке метода Караш исходил из следующих положений:
- сгорание органического соединения связано с перемещением электронов от атомов углерода и водорода к кислороду;
- теплота сгорания есть функция общего числа перемещающихся электронов.
При перемещении одного электрона из связи CH4 в соединения типа CO2 или H2O выделяется энергия 26,051) ккал/г-моль.
Тогда теплота сгорания простейших органических соединений при постоянном давлении может быть вычислена по формуле
 , ккал/г-моль, (4.19)
, ккал/г-моль, (4.19)
где  - теплота сгорания органического соединения, ккал/г-моль;
- теплота сгорания органического соединения, ккал/г-моль;
 - число перемещающихся электронов при сгорании одной молекулы вещества.
- число перемещающихся электронов при сгорании одной молекулы вещества.
Учитывая, что любое органическое соединение может рассматриваться как углеводород, в котором несколько атомов водорода замещены на другие атомы или группы атомов Караш в формулу (4.20) вводит поправки
 , (4.20)
, (4.20)
где  - число одинаковых заместителей в молекуле;
- число одинаковых заместителей в молекуле;
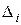 - соответствующая данному заместителю поправка.
- соответствующая данному заместителю поправка.
Численные значения тепловых поправок приведены в табл. 4.3.
Для подсчета числа смещающихся электронов Караш предлагает пользоваться нижеприведенными формулами [8]:
- для углеводородов типа CаHb
 ; (4.21)
; (4.21)
- для соединений типа CaHbOd и соединений с 3 валентным азотом, не содержащих нитрогруппы  типа CaHbNcOd
типа CaHbNcOd
 ; (4.22)
; (4.22)
- для нитросоединений типа CaHbNcOd(NO2)p
 . (4.23)
. (4.23)
Здесь р – число нитрогрупп - NO2.
Основываясь на методе Караша для вычисления теплот сгорания, теплоту образования вещества можно определить по формуле

 , (4.24)
, (4.24)
где  - число атомов углерода;
- число атомов углерода;
 - число атомов водорода.
- число атомов водорода.
Таблица 4.3
Численные значения поправок для расчета теплот сгорания и образования по Карашу [8]
| №
пп
| Характеристика группировок, заместителей и связей
| Тепловые поправки 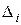 , ккал/моль1) , ккал/моль1)
|
| 1.
| Связь между алифатическим и ароматическим радикалами R − Al
|
−3,5
|
| 2.
| Связь между ароматическими радикалами R − R
| −6,5
|
| 3.
| Связь между ароматическим радикалом и гидроксильной группой R − OH
|
+3,5
|
| 4.
| Связь между первичным алифатическим радикалом и гидроксильной группой Al − OH
|
+13,0
|
| 5.
| Нитрогруппа − NO2 в алифатических и ароматических соединениях
|
+13,0
|
| 6.
| Нитрогруппа, связанная с атомом азота 
| −3,8
|
| 7.
| Ароматические нитриды 
| −6,5
|
| 8.
| Связь конденсированных ароматических ядер
| −20,0
|
| 9.
| Первичные алифатические амины 
| +13,0
|
| 10.
| Эфиры жирные и ароматические 
| +19,5
|
| 11.
| Ацетиленовая связь 
| +46,1
|
| 12.
| Сложные эфиры алифатических кислот
| +13,5
|
| 13.
| Сложные эфиры ароматических кислот
| +10,0
|
| 14.
| Сложные эфиры азотной кислоты
|
|
Примечание 1) − по данным [8].
Пример 4.4. Определить теплоту сгорания и образования тротила C7H5(NO2)3.
В соответствии с (4.23) получаем
 =
=  =30.
=30.
Теплота сгорания по формуле (4.20), учитывая поправку на группу  Δ1 = +13 (табл. 4.3), равна
Δ1 = +13 (табл. 4.3), равна
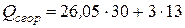 =820,5 ккал/моль.
=820,5 ккал/моль.
Откуда по формуле (4.24) теплота образования равна
 =12,25 ккал/моль.
=12,25 ккал/моль.
Некоторое расхождение с известными данными ( ≈13 ккал/моль) связано с необходимостью учитывать энергию на плавление тротила как твердого вещества [1].
≈13 ккал/моль) связано с необходимостью учитывать энергию на плавление тротила как твердого вещества [1].
Пример 4.5. Определить по методу Караша теплоту образования пикриновой кислоты C6H2(NO2)3OH или C6H3O(NO2)3.
В соответствии с химической формулой a= 6, b= 3, d = 1, p = 3, откуда по (4.23)
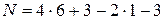 = 22.
= 22.
Теплота сгорания по формуле (4.20), учитывая поправку на группу  Δ1 = +13 и на группу OH Δ2 = +3,5 (табл. 4.3), равна
Δ1 = +13 и на группу OH Δ2 = +3,5 (табл. 4.3), равна
 = 615,6 ккал/моль.
= 615,6 ккал/моль.
По формуле (4.24) находим теплоту образования пикриновой кислоты
 = 54,15 ккал/моль.
= 54,15 ккал/моль.




 (4.12)
(4.12) . (4.13)
. (4.13) (4.14)
(4.14)
 - теплота взрыва ВВ, кДж/моль (ккал/моль);
- теплота взрыва ВВ, кДж/моль (ккал/моль);
 - суммарная теплота образования продуктов взрыва с учетом числа их грамм-молей -
- суммарная теплота образования продуктов взрыва с учетом числа их грамм-молей -  , кДж/моль (ккал/моль). Здесь
, кДж/моль (ккал/моль). Здесь  - теплота образования i-го продукта взрыва;
- теплота образования i-го продукта взрыва; - суммарная теплота образования компонент ВВ с учетом числа их грамм-молей -
- суммарная теплота образования компонент ВВ с учетом числа их грамм-молей -  , кДж/моль (ккал/моль). Здесь
, кДж/моль (ккал/моль). Здесь  - теплота образования i-ой компоненты ВВ.
- теплота образования i-ой компоненты ВВ. будет тем выше, чем ниже теплота образования ВВ или его компонент и чем выше теплоты образования ПВ (теплотворная способность горючих элементов).
будет тем выше, чем ниже теплота образования ВВ или его компонент и чем выше теплоты образования ПВ (теплотворная способность горючих элементов). = 344,5 кДж/моль.
= 344,5 кДж/моль.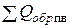 )
) кДж/г-моль,
кДж/г-моль, = 1443,8 кДж/моль.
= 1443,8 кДж/моль. , кДж/кг, (4.15)
, кДж/кг, (4.15) - молекулярный вес ВВ.
- молекулярный вес ВВ.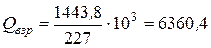 , кДж/кг.
, кДж/кг. имеет размерность кДж/кг или ккал/кг.
имеет размерность кДж/кг или ккал/кг. . (4.16)
. (4.16) . (4.17)
. (4.17) - суммарная теплота образования ВВ или его компонентов с учетом числа их грамм-молей -
- суммарная теплота образования ВВ или его компонентов с учетом числа их грамм-молей -  кДж/моль (ккал/моль);
кДж/моль (ккал/моль); - теплота сгорания ВВ, кДж/моль (ккал/моль);
- теплота сгорания ВВ, кДж/моль (ккал/моль);
 - суммарная теплота образования продуктов сгорания с учетом числа их грамм-молей -
- суммарная теплота образования продуктов сгорания с учетом числа их грамм-молей -  , кДж/моль (ккал/моль).
, кДж/моль (ккал/моль). ,
, =
=  . (4.18)
. (4.18) , ккал/г-моль, (4.19)
, ккал/г-моль, (4.19) - теплота сгорания органического соединения, ккал/г-моль;
- теплота сгорания органического соединения, ккал/г-моль; - число перемещающихся электронов при сгорании одной молекулы вещества.
- число перемещающихся электронов при сгорании одной молекулы вещества. , (4.20)
, (4.20) - число одинаковых заместителей в молекуле;
- число одинаковых заместителей в молекуле; - соответствующая данному заместителю поправка.
- соответствующая данному заместителю поправка. ; (4.21)
; (4.21) типа CaHbNcOd
типа CaHbNcOd ; (4.22)
; (4.22) . (4.23)
. (4.23)
 , (4.24)
, (4.24) - число атомов углерода;
- число атомов углерода; - число атомов водорода.
- число атомов водорода.




 =
=  =30.
=30.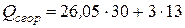 =820,5 ккал/моль.
=820,5 ккал/моль. =12,25 ккал/моль.
=12,25 ккал/моль.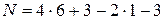 = 22.
= 22. = 615,6 ккал/моль.
= 615,6 ккал/моль. = 54,15 ккал/моль.
= 54,15 ккал/моль.


