Для выявления РНК вируса гепатита С методом ПЦР «в режиме реального времени» использовалась коммерческая тест-система «РеалБест РНК ВГС».
Принцип анализа основан на регистрации процесса амплификации выбранного специфического фрагмента РНК, заключающегося в повторяющихся циклах: температурная денатурация, отжиг праймеров на комплементарные последовательности, достройка полинуклеотидных последовательностей с этих праймеров Taq-полимеразой. В основе метода лежит измерение уровня флуоресценции в каждом цикле ПЦР [53].
Реагенты и оборудование:
· готовая реакционная смесь для ПЦР (ГРС), лиофилизированная;
· слабый положительный контрольный образец (СПКО ВГВ/ВГС/ВИЧ), лиофилизированный;
· положительный контрольный образец (ПКО ВГС), лиофилизированный;
· калибровочный образец 1 (КО1 ВГС) лиофилизированный;
· калибровочный образец 2 (КО2 ВГС) лиофилизированный;
· раствор для восстановления контрольных образцов (РВК);
· амплификатор с флуоресцентной детекцией в реальном времени;
· ПЦР-бокс, освещаемый УФ-лампой;
· холодильник бытовой, поддерживающий температуру (2-8)˚С;
· пипетки полуавтоматические (дозаторы механические) одноканальные с переменным объёмом, со сменными наконечниками;
· перчатки медицинские одноразовые;
· одноразовые наконечники для пипеток с защитным фильтром;
· штативы для микропробирок вместимостью 1,5 и 0,2 мл;
· ёмкость для сброса наконечников;
· нож канцелярский.
Набор дополнительно комплектуется стрипированными крышками для пробирок или оптической плёнкой, а также пластиковыми крышками для флаконов с контрольными образцами [53].
Методика выделения НК из образцов:
1. пронумеровали необходимое количество пробирок с ГРС и расположить в штативе;
2. в каждую пробирку внесли 50 мкл соответствующего раствора выделенной РНК;
3. поместили пробирки в амплификатор;
4. запрограммировали прибор для проведения амплификации специфического фрагмента РНК ВГС и ВКО и детекции флуоресцентных сигналов;
5. для детектирования сигнала при амплификации фрагмента РНК ВКО в системе применяли гибридизационный ДНК-зонд, меченный флуофором «FAM». Для детекции выбирали канал детекции «FAM». Для детектирования сигнала при амплификации фрагмента РНК ВКО в системе применяли гибридизационный ДНК-зонд, меченный флуофором «ROX»;
6. запрограммировали положение пробирок с исследуемыми образцами, положительным и отрицательным контролями согласно инструкции к используемому прибору;
7. запустили программу и провели ПЦР с флуоресцентной регистрацией «в режиме реального времени» [53].
Сыворотки крови пациентов на выявление вируса гепатита С исследовали ПЦР в «режиме реального времени» на амплификаторе StratagenMx3000P. Для постановки ПЦР «в режиме реального времени» использовали тест-системы «PCR-Real-time».
ПЦР «в режиме реального времени» – это метод, при котором этапы амплификации ДНК-мишени и детекции образующихся продуктов происходят одновременно в одной пробирке. Он основан на измерении флуоресцентного сигнала в каждом цикле амплификации, что дает возможность оценить течение процесса, и зависит от начального количества исследуемого генетического материала [53].
Для выявления продуктов амплификации в режиме реального времени используют следующие способы:
1. С использованием интеркалирующих красителей (рисунок 2.1). Этот способ детекции основан на том, что флуоресценция красителей бромистого этидия и сайбргрина значительно возрастает при их внедрении в двойную цепь молекулы ДНК, то есть при накоплении продуктов амплификации.

Рисунок 2.1 – Встраивание интеркалирующих красителей в двухцепочечную ДНК
2. С использованием ДНК-зондов. В реакционную смесь добавляют ДНК зонды, в состав которых входит флуоресцентная метка и гаситель флуоресценции. Когда зонд находится в растворе, гаситель поглощает излучение и свечение отсутствует. В ходе ПЦР происходит присоединение ДНК-зонда к комплиментарной цепи ДНК, одновременно разъединяются флуоресцентная метка и гаситель, что приводит к увеличению детекции свечения (рисунок 2.2).

Рисунок 2.2 – Встраивание ДНК зонда в строящуюся цепь
Интенсивность сигнала пропорциональна концентрации конечного продукта ПЦР. Важнейшей особенностью метода является синхронизация регистрации и амплификации. Это дает возможность оценить кинетику процесса, которая зависит от начального количества исследуемого наследственного материала. Детекция флуоресцентного сигнала от каждого красителя происходит в определенном для него диапазоне длин волн (канале). Диапазон выбирается таким образом, чтобы детектировать сигнал только одного красителя, избегая перекрывания соседних сигналов. Если настроить прибор для детекции сигнала в максимуме флуоресценции каждого красителя, тогда остальные красители в этом максимуме будут иметь очень низкую флуоресценцию, которой можно пренебречь (рисунок 2.3).
Флуоресцентные красители обеспечивают флуоресценцию, прямо пропорциональную количеству ПЦР-продукта репортерную флуоресценцию. Механизмы генерации репортерной флуоресценции различаются в зависимости от типа ПЦР «в реальномвремени».

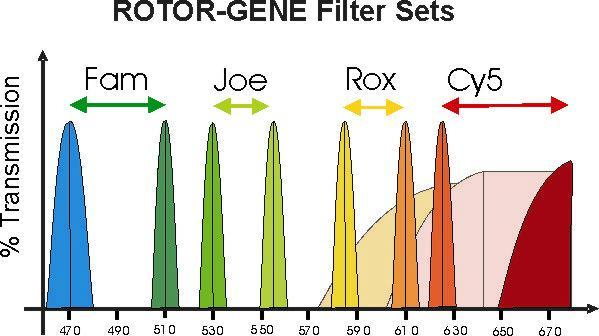
Рисунок 2.3 – Спектр излучаемой флуоресценции различных красителей
На рисунке 2.4 показан типичный образец кинетической кривой ПЦР «в реальном времени». График имеет сигмовидную форму и демонстрирует 3 стадии реакции:
1) инициация (отсутствие детектирующего сигнала, выявляющего ПЦР продукты);
2) экспоненциальная (экспоненциальная зависимость интенсивности флуоресценции от количества циклов ПЦР);
3) насыщения (пороговый уровень флуоресценции).

Рисунок 2.4 – Кинетическая кривая ПЦР «в реальномвремени»
В начальных циклах ПЦР существуют небольшие изменения флуоресцентного сигнала, значения которого определяют исходный (базовый) уровень графика. Увеличение уровня флуоресценции сверх базового свидетельствует о накоплении ПЦР продуктов. При этом фиксируемое пороговое значение флуоресценции может быть установлено выше ее базового уровня. Пороговый цикл определяют как номер цикла, при котором флуоресценция преодолевает фиксированный порог.
Теоретически в конце каждого цикла должно происходить удвоение числа продуктов ПЦР. Результатом циклического процесса является экспоненциальное увеличение количества специфического фрагмента ДНК, которое можно описать формулой (2.1):

| (2.1)
|
где  – количество специфических (ограниченных праймерами) продуктов реакции амплификации;
– количество специфических (ограниченных праймерами) продуктов реакции амплификации;
 – начальное количество ДНК-мишеней;
– начальное количество ДНК-мишеней;
n – число циклов амплификации.
Реальное значение эффективности отдельных циклов амплификации составляет по некоторым данным 78-97%. В случае присутствия в пробе ингибиторов реакции это значение может быть намного меньше, поэтому фактическое количество специфических продуктов амплификации лучше описывает формула (2.2):

| (2.2)
|
где  – значение эффективности реакции.
– значение эффективности реакции.
Следует заметить, что в процессе амплификации на исходной цепи синтезируются и длинные фрагменты, однако их накопление происходит лишь в арифметической прогрессии по формуле (2.3):

| (2.3)
|
где  - количество длинных продуктов амплификации.
- количество длинных продуктов амплификации.
Таким образом, специфические фрагменты, ограниченные на концах праймерами, впервые появляются в конце второго цикла, накапливаются в геометрической прогрессии и очень скоро начинают доминировать среди продуктов амплификации.
Амплификатор Stratagene Mx3005Pro оснащён программным обеспечением MxPro™ QPCR, которое работает в операционной системе Microsoft Windows на платформе NT и позволяет:
- осуществлять ввод параметров эксперимента;
- отображать кривые накопления продукта реакции в режиме реального времени;
- устанавливать базовую линию и пороговый цикл автоматически или вручную;
- оценивать абсолютное количество ДНК/РНК при одновременном анализе нескольких калибровочных кривых;
- оптимизировать праймеры и зонды при помощи специального программного модуля;
- осуществлять мониторинг параметров прибора.
Алгоритм проведения ПЦР «в режиме реального времени» можно разделить на стадии:
1) дизайн эксперимента;
2) проведение эксперимента;
3) сбор данных;
4) анализ полученных результатов.
Последовательность выполнения операций:
Последовательность выполнения операций:
– Загрузили операционную систему, включили амплификатор и запустили программное обеспечение с помощью ярлыка «MxPro». После инициализации прибора в появившемся стартовом окне «New Options» выбрали тип анализа исследуемых образцов и нажали кнопку «Ok» (рисунок 2.5). Перед началом работы прогрели галогеновую лампу оптического блока амплификатора, нажав одноименную кнопку на панели инструментов.

Рисунок 2.5 – Стартовое диалоговое окно
– Сформировали схему планшета: расположение образцов в модуле и вид детекции флуоресцентного сигнала с учетом специфики образцов в окне «Plate Setup».

Рисунок 2.6 – Пример заполнения планшета
– Все образцы обозначили значком «Unknown», отметили галочкой имена флуорофоров, которые нужно детектировать, нажали кнопку «Showwellnames» и ввели имя образца в каждую ячейку (рисунок 2.6 и 2.7).

Рисунок 2.7 – Выбор каналов детекции
– Создали программу в модуле «Thermal Profile Setup», с учетом вида анализа и указанием временных температурных режимов, количество циклов. Обязательным шагом является установка этапа считывания флуоресцентного сигнала. Обычно считывание проводят при наименьшем значении температуры в цикле реакции (кроме случаев использования интеркалирующих красителей). Затем сохранили сформированный файл и запустили выполнение программы, нажав кнопку «Run» (рисунок 2.8).

Рисунок 2.8 – Настройка протокола параметров реакции
– Поместили микропробирки или стрипы в реакционный модуль амплификатора и нажали на клавишу «Start». Перед стартом включили (отметили галочкой) опцию выключения лампы после окончания выполнения программы с целью сохранения ресурса лазерной лампы (рисунок 2.9).


Рисунок 2.9 – Окно запуска эксперимента

Рисунок 2.10 – Температурный градиент амплификации
На рисунке 2.10 показан типичный профиль амплификации, выполняемый программным обеспечением амплификатора Stratagene Mx3005Pro.

Рисунок 2.11 – Кривые накопления флуоресцентного сигнала


Рисунок 2.12 – Окно просмотра графиков накопления РНК в одной лунке
При проведении анализа в конце каждого из множества циклов ПЦР регистрируется изменение компонентов реакций, а не после ее завершения. Визуализация регистрации накопления продуктов ПЦР в ходе реакции возможна при нажатии «Show Plots», при этом возможно индивидуально отслеживать интересующую нас ячейку (рисунок 2.12).
На основании считываемых данных управляющая программа строит кривые накопления флуоресцентного сигнала по каждому из заданных для образцов каналов (рисунок 2.13).

Рисунок 2.13 – Результаты амплификации образцов
Результат считается достоверным только в случае прохождения положительных и отрицательных контролей амплификации и отрицательного контроля выделения ДНК.









 – количество специфических (ограниченных праймерами) продуктов реакции амплификации;
– количество специфических (ограниченных праймерами) продуктов реакции амплификации; – начальное количество ДНК-мишеней;
– начальное количество ДНК-мишеней;
 – значение эффективности реакции.
– значение эффективности реакции.
 - количество длинных продуктов амплификации.
- количество длинных продуктов амплификации.












