ВИТАМИНЫ. СРЕДСТВА, АКТИВИРУЮЩИЕ И КОРРИГИРУЮЩИЕ МЕТАБОЛИЗМ. ПРП ЖЕЛЕЗА
ВИТАМИННЫЕ И КОФЕРМЕНТНЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА
Витамины - низкомолекулярные органические вещества, необходимые для обеспечения биохимических и физиологических процессов в организме.
Классификация витаминных препаратов
• Монокомпонентные. - Водорастворимые. - Жирорастворимые.
• Поликомпонентные.
- Комплекс водорастворимых витаминов.
- Комплекс жирорастворимых витаминов.
- Комплекс водо- и жирорастворимых витаминов.
- Витаминные препараты, содержащие макро- и(или) микроэлементы:
■ комплексы витаминов с макроэлементами;
■ комплексы витаминов с микроэлементами;
■ комплексы витаминов с макро- и микроэлементами.
- Витаминные препараты с компонентами растительного происхождения.
• Комплекс водо- и жирорастворимых витаминов с компонентами растительного происхождения.
• Комплекс водо- и жирорастворимых витаминов с микроэлементами и компонентами растительного происхождения.
• Фитопрепараты с высоким содержанием витаминов.
Фармакокинетика витаминов
Витамин B1 (тиамин) хорошо всасывается в кишечнике. Проникает в кишечный эпителиоцит при помощи переносчика (активный транспорт), а при больших концентрациях - диффузией. Определён- ное количество витамина циркулирует из эпителиальных клеток в полость тонкой кишки и обратно. Через 15 мин тиамин обнаруживают в плазме крови, а через 30 мин - в тканях. Витамин накапливается в мозге, сердце, почках, надпочечниках, печени, скелетных мышцах. Около 50% всего количества содержится в мышечной ткани. Максимальную его концентрацию при оральном приёме монопрепарата или в составе витаминных комплексов отмечают приблизительно через 1,5 ч (см. табл. 23-3), её значения практически равны в обоих случаях. При приёме тиамина в той же дозе в составе витамино-минерального комплекса максимальная концентрация значительно ниже. Аналогичные данные получены и для AUC-тиамина. В печени витамин B1 превращается в активные метаболиты - дифосфо- и трифосфотиамин. Элиминация тиамина осуществляется за счёт метаболизма в печени со средней скоростью 1 мг/сут. Период полувыведения эндогенного тиамина - 9-18 сут, введённого в составе витаминных препаратов - 4-5,5 ч.
Витамин B6. Все три формы (пиридоксин, пиридоксаль и пиридоксамин) легко всасываются в ЖКТ путём простой диффузии. В крови происходит неферментативное превращение пиридоксина в пиридоксамин, после чего образуется один из конечных продуктов обмена - 4-пиридоксиловая кислота. В тканях пиридоксин путём фосфорилирования превращается в пиридоксинфосфат, пиридоксальфосфат и пиридоксаминфосфат. Конечные продукты обмена (4-пири- доксиловая и 5-фосфопиридоксиловая кислота) выделяются с мочой. Наибольшие концентрации витамина обнаруживают в печени, миокарде (вероятно - депо), высокие - в почках. При оральном приёме витаминных комплексов в сравнении с монопрепаратом не отмечено уменьшения максимальной концентрации витамина B6 и уменьшения площади под кривой «концентрация-время». Однако при оральном приёме витаминных комплексов в сочетании с макро- и микроэлементами происходит уменьшение максимальной концентрации и AUC. Время достижения максимальной концентрации при приёме витамина B6 в составе комплексов несколько больше, чем при приёме его в той же дозе в виде монопрепарата (см. табл. 23-3).
Витамин B2 (рибофлавин). Его молекулы всасываются в проксимальной части тонкой кишки путём активного транспорта. В связи с тем, что в пище он находится в фосфорилированном состоянии и связан с белками, для всасывания в кишке должны пройти процессы расщепления и дефосфорилирования. Оральное применение синтетического рибофлавина в избыточных дозах не ведёт к увеличению его всасывания, однако содержание свободного витамина в жёлчи и просвете кишки возрастает. Рибофлавин в организме подвержен энтерогепатической циркуляции. Наибольшие количества рибофлавина обнаруживают в миокарде, печени, почках, мозге. На динамику его всасывания не влияет состав витаминного препарата. Использование для орального приёма витамино-минеральных и поливитаминных комплексов не приводит к уменьшению максимальной концентрации и площади под кривой «концентрация-время» (см. табл. 23-3). Метаболизм рибофлавина начинается в стенке кишки, где он фосфорилируется. Затем в печени образуется рибофлавин-5γ-монофосфат, затем - флавинадениндинуклеотид. За сутки с мочой выделяется около 10% принятой дозы, остальная часть реабсорбируется в канальцах.
Витамин C (аскорбиновая кислота) всасывается в тонкой кишке. По данным различных авторов, время достижения максимальной концентрации в плазме крови - 1,5-4 ч (большие значения получены при приёме кислоты в составе комплексных препаратов). Рядом авторов установлено, что всасывание витамина C зависит от количества компонентов в препарате: чем их меньше, тем лучше всасывание. Поэтому при использовании многокомпонентных лекарственных форм необходимо увеличение дозы аскорбиновой кислоты. Для насыщения тканей требуется превращение кислоты в дегидроаскорбиновую форму (проникает через мембрану энтероцита без затрат энергии). В клетках при участии тиоловых и дисульфидных групп дегидроаскорбиновая кислота быстро восстанавливается в аскорбиновую. Витамин C избирательно накапливается в задней доле гипофиза и надпочечниках. Метаболизм его происходит главным образом в печени (преобразование в дезоксиаскорбиновую и дикетогулоновую кислоту). Последняя затем превращается в щавелево-уксусную кислоту. Выделение метаболитов аскорбиновой кислоты происходит в почках. Скорость её метаболизма - 5-20 мг/сут. При приёме аскорбиновой кислоты в сверхвысоких дозах она сразу выводится почками в неизменённом виде.
Витамин E. Его свойствами обладают 8 различных токоферолов естественного происхождения. Из кишечника всасывается приблизительно половина витамина E, принятого с пищей. Его абсорбция требует присутствия жирных кислот. Витамин E проникает в кровь через лимфу, связываясь сначала с хиломикронами, а затем с β-липопротеинами плазмы. Часть выводимого из организма витамина (α-токоферола) экскретируется в жёлчь, а остальное количество - в мочу в виде глюкуронидов. Основной путь выведения γ-токоферола из организма - выделение с мочой в виде конъюгированного глюкуронида. Депо витамина - в гипофизе, семенниках, надпочечниках и ряде других органов. По данным некоторых авторов, биодоступность натурального витамина E по сравнению с искусственным токоферолом - 1,36.
Литературные данные по фармакокинетическим параметрам витаминов ограничены информацией, полученной при использовании монопрепаратов. В ответ на тенденцию последнего времени - назначение преимущественно поликомпонентных или витамино-минеральных комплексов - в табл. 23-3 приведены данные о фармакокинетике витаминов B1, B2, B6, C, E при приёме их в одинаковой дозе в виде монопрепарата, поливитаминного и витамино-минерального комплекса.
Витамин B12 (цианокобаламин) - единственный водорастворимый витамин, обладающий способностью к кумуляции. Поэтому весьма высок риск передозировки при использовании его как в виде монопрепарата, так и в составе различных комплексов.
Взаимодействие
Для витаминных препаратов важно фармацевтическое взаимодействие не только в растворах, но и в «твёрдых» лекарственных формах:
• тиамина гидрохлорид окисляется в присутствии рибофлавина на выпадающие в осадок тиохром и хлорофлавин (аскорбиновая кислота в определённой степени предотвращает осаждение тиохрома, однако это может привести к ещё большему образованию хлорофлавина; взаимодействие между тиамином и рибофлавином усиливается под действием никотинамида);
• фолиевая кислота разрушается под действием тиамина и рибофлавина (при pH=5 реакция протекает значительно медленнее);
• цианокобаламин разрушается в присутствии дегидроаскорбиновой кислоты (предотвратить реакцию можно, остановив окисление аскорбиновой кислоты - необходимо присутствие ионов меди);
• рибофлавин усиливает аэробное разрушение аскорбиновой кислоты (защита от света и кислорода позволяет предотвратить реакцию);
• аскорбиновая кислота уменьшает стабильность сухих порошков β-каротина в твёрдых лекарственных формах;
• эргокальциферол изомеризуется под воздействием аскорбиновой и фолиевой кислоты, тиамина гидрохлорида и пиридоксина гидрохлорида.
Фармацевтическое взаимодействие витаминов более выражено в жидких лекарственных формах. В твёрдых его легче избежать, заключая некоторые вещества (например, цианокобаламин) в желатин. Уменьшение содержания воды также способствует снижению вероятности фармацевтического взаимодействия. Другая возможность - использование многослойных или ламинированных таблеток, а также заключение отдельных витаминов в покрытия или капсульные оболочки. Есть несколько методов предотвращения фармацевтического взаимодействия между витаминами в жидких лекарственных формах: использование двухкамерных ампул, лиофилизация; для препаратов, используемых для орального приёма, - приготовление порошков или растворимых гранул.
Включение микроэлементов в витаминные продукты также часто приводит к нестабильности, так как некоторые из них - тяжёлые металлы, катализирующие окислительное разрушение витаминов. Для повышения стабильности лекарственной формы изготавливают отдельные гранулы витаминов и микроэлементов, а затем объединяют их в таблетку (обычную, двухслойную или ламинированную). Наиболее трудоёмко, но эффективно производство капсул, содержащих витамины и микроэлементы отдельно, с последующим объединением их в единой упаковке.
По данным некоторых авторов, тяжёлые металлы (Pb, Cd, Fe, Co, Cu, Mg, Ni) могут в определённой степени снижать стабильность витамина B6. Даже незначительное количество их ионов оказывает каталитическое воздействие на окислительное разрушение многих витаминов (ретинол и его эфиры; тиамина гидрохлорид; рибофлавин; пантотеновая и аскорбиновая кислота и их соли; пиридоксина гидрохлорид; фолиевая кислота; колекальциферол; эргокальциферол; рутин*). Для тиамина основной катализатор - Cu (нежелательные эффекты других металлов слишком слабы). Неблагоприятным эффектам тяжёлых металлов на стабильность витаминов противопоставляют добавление хелатного агента (образует комплексы с ионами металлов).
Одна из сложнейших проблем фармации - разработка стабильного, комбинированного с микроэлементами мультивитаминного продукта. Особенно сложно достигнуть указанной цели для водных растворов. Поэтому предпочтение отдают таблеткам, капсулам, растворимым гранулам, двухкамерным ампулам и лиофилизатам. Большинство публикаций о подобных продуктах не раскрывает сложности проблемы, а лишь освещает её отдельные аспекты. Сейчас самые стабильные формы мультивитаминных препаратов, по-видимому, мягкие желатиновые капсулы и таблетки, покрытые сахарной оболочкой. Однако при любой форме выпуска не исключена возможность взаимодействия компонентов в организме человека.
Наиболее важный для витаминных препаратов уровень фармакокинетического взаимодействия - метаболизм. Достоверно установлено, что при недостаточном или дополнительном введении некоторых витаминов (например, тиамина и рибофлавина) происходит изменение активности ферментов метаболизма ксенобиотиков.
К введению витаминов чувствительны следующие микросомальные ферменты: в большей степени - деметилаза и гидроксилаза, в меньшей - НАДН-редуктаза и эстераза. Индометацин и напроксен подвергаются в организме деметилированию. Установлено, что под влиянием больших доз пиридоксина гидрохлорида (0,2 г/сут) возможны уменьшение концентрации фенитоина в крови и уменьшение его противосудорожного действия (витамин B6 индуцирует некоторые изоферменты цитохрома P-450, участвующие в его биотрансформации).
Существуют данные о влиянии ЛС на фармакокинетику и фармакодинамику витаминов. Так, результаты многочисленных исследований показали, что анаболические стероиды (ретаболил*, силаболин*) повышают активность транспорта аскорбиновой кислоты в тонкой кишке, увеличивают процент её всасывания, вызывают снижение концентракции восстановленной и повышение - окислённой формы.
При приёме ацетилсалициловой кислоты увеличивается экскреция почками витамина C (вплоть до развития гиповитаминоза с характерной клинической картиной). В то же время при одновременном приё- ме салицилатов и аскорбиновой кислоты (более 2 г/сут) может увеличиваться кислотность мочи, возрастать реабсорбция воды в почечных канальцах (у пациентов возникают жалобы на шум в ушах, головокружение, снижение слуха; возможны рвота, возбуждение).
Хлорпромазин блокирует флавинокиназу - при сочетанном применении с рибофлавином тормозит его превращение в флавинмононуклеотид. Аналогичным антивитаминным эффектом обладают мепакрин (акрихин*), галактофлавин, изорибофлавин. Метаболизм рибофлавина, особенно в миокарде, ухудшают трициклические антидепрессанты - имипрамин и амитриптилин.
У женщин, принимающих содержащие эстрогены оральные контрацептивы, обнаруживают дефицит пиридоксина. Дефицит витамина B6 возникает при длительном применении антибиотиков, сульфаниламидов, фтивазида, изониазида, циклосерина, дезоксипиридоксина.
Эстрогены, содержащиеся в контрацептивных препаратах, могут повышать концентрацию в крови ретинолсвязывающего протеина, поэтому при их применении вместе с препаратами витамина A может возникнуть его гипервитаминоз. При длительном совместном применении тетрациклинов с препаратами витамина A возможно развитие внутричерепной гипертензии. Дефицит Zn в организме нарушает превращение ретинола в активную форму. Витамин A обладает антагонистическими свойствами к адреналину и кортизону. Приём больших доз кортизона ведёт к уменьшению содержания витамина A в организме.
В настоящее время известен ряд антагонистов витаминов (табл. 23-10).
 В результате многочисленных клинико-экспериментальных наблюдений установлено, что в человеческом организме есть межвитаминные взаимодействия: в процессе обмена физиологическое действие каждого витамина осуществляется в комплексе с воздействием других. Рассматривая взаимодействие тиамина с пиридоксином, следует отметить, что большинство авторов отмечают антагонистический характер взаимоотношений между этими витаминами. При введении витамина B6 наблюдают повышение экскреции тиамина, снижение концентрации тиаминдисульфида в крови и общего тиамина в тканях. При введении тиамина отмечают резкое снижение концентрации в крови коферментной формы пиридоксина и увеличение экскреции 4-пиридоксовой кислоты, что, по мнению некоторых авторов, можно расценивать как обеднение организма пиридоксином. Конкурентные взаимоотношения между витаминами B1 и B6 обусловливают необходимость введения пиридоксина в период использования тиамина (их применяют поочерёдно - через день). В связи с тем что конкуренция между витаминами может осуществляться на путях фосфорилирования, целесообразно применять вместо тиамина его коферментную форму - тиаминдисульфид (кокарбоксилаза).
В результате многочисленных клинико-экспериментальных наблюдений установлено, что в человеческом организме есть межвитаминные взаимодействия: в процессе обмена физиологическое действие каждого витамина осуществляется в комплексе с воздействием других. Рассматривая взаимодействие тиамина с пиридоксином, следует отметить, что большинство авторов отмечают антагонистический характер взаимоотношений между этими витаминами. При введении витамина B6 наблюдают повышение экскреции тиамина, снижение концентрации тиаминдисульфида в крови и общего тиамина в тканях. При введении тиамина отмечают резкое снижение концентрации в крови коферментной формы пиридоксина и увеличение экскреции 4-пиридоксовой кислоты, что, по мнению некоторых авторов, можно расценивать как обеднение организма пиридоксином. Конкурентные взаимоотношения между витаминами B1 и B6 обусловливают необходимость введения пиридоксина в период использования тиамина (их применяют поочерёдно - через день). В связи с тем что конкуренция между витаминами может осуществляться на путях фосфорилирования, целесообразно применять вместо тиамина его коферментную форму - тиаминдисульфид (кокарбоксилаза).
Приём больших ежедневных доз аскорбиновой кислоты ухудшает усвоение витамина B12из пищи или пищевых добавок. Недостаток в рационе витамина E способствует развитию гиповитаминоза A.
Аденозина фосфат
Аденозина фосфат (АМФ) - компонент адениловой системы; его биологическая роль:
• активация в анаэробных условиях ряда ферментов цикла Кребса, усиление ресинтеза АТФ с одновременным торможением гликолиза;
• в качестве пуринового нуклеотида способствует синтезу нуклеиновых кислот и, следовательно, синтезу белков;
• входит в состав важнейших дыхательных коферментов-перенос- чиков электронов и протонов в начальных звеньях цепи тканевого дыхания (НАД, НАДФ и ФАД);
• энергетическое обеспечение процессов синтеза - предшественник макроэргических соединений (образование АДФ и АТФ происходит при фосфорилировании АМФ);
• участвует в регуляции углеводного обмена.
Он способен проникать в клетки. Поступая в организм, аденозина фосфат (фосфаден*) не может сразу включиться в макроэргический пул - вначале метаболизируется до аденозина. Последний обладает биологической активностью - происходит расширение артериальных капилляров, что влечёт активацию обмена за счёт повышения притока кислорода, увеличение синтеза АТФ. Кроме того, аденозин может включаться в синтез макроэргов.
В то же время при достаточном количестве АТФ в клетке происходит переход аденозина фосфата не в аденозин, а в инозинмонофосфат, метаболизирующийся иначе. По совокупности свойств аденозин можно отнести к анаболическим веществам.
Показания к применению. Препарат применяют с целью улучшения периферического кровообращения, а также для восстановления анаболических процессов и микроциркуляции при острых и хронических заболеваниях миокарда.
Способ приёма и дозы. Назначают per os в таблетках в разовой дозе 25-50 мг, при суточной - до 300 мг. Продолжительность курса - 15-30 дней (при необходимости лечение повторяют с интервалом в 5-7 дней).
Инозин
Инозин (рибоксин*) - нуклеотид, содержащий в качестве пуринового основания гипоксантин. При введении в организм препарат расщепляется на рибозу и гипоксантин. Последний затем реагирует с пирофосфорилированной рибозой с образованием нуклеотида - инозинмонофосфата. Не исключена возможность и прямого его образования фосфорилированием инозина (хотя фермент, необходимый для такой реакции, пока не обнаружен).
Инозинмонофосфат занимает особое место в процессе биосинтеза пуриновых нуклеотидов в организме: образуется первым и служит предшественником синтеза остальных пуриновых нуклеотидов (АМФ, гуаниловая и ксантиловая кислота).
Инозин, поступая в плазму крови, может разрушаться до гипоксантина. Он, захватываясь эритроцитами, повышает в них содержание 2,3-ДФГ, тем самым облегчая диссоциацию кислорода из оксигемоглобина, что способствует улучшению обмена кислорода в организме. В тех случаях, когда в клетках недостаточно сорбита, инозин может служить источником его синтеза. Разрушаясь в печени до гипоксантина, инозин включается в энергетический пул как его субстрат, улучшая функцию гепатоцитов.
Показания к применению. Инозин, подобно аденозина фосфату, применяют как корректор анаболических процессов при острых и хронических заболеваниях миокарда.
Способ приёма и дозы. Назначают per os по 0,2-0,4 г 3 раза в сутки, часто - в сочетании с калия оротатом. При необходимости используют 2% раствор в ампулах по 10 и 20 мл. Содержимое ампул вводят внутривенно медленно или капельно один раз в день.
Трифосаденин
Трифосаденин (кислота аденозинтрифосфорная, АТФ) - трифосфорный эфир аденозина, содержащий аденин, рибозу и три остатка фосфорной кислоты. Сложен и многообразен путь включения экзогенного АТФ в биоэнергетические процессы организма. Во-первых, большое количество фермента АТФазы сразу подвергает его метаболизму. Во-вторых, в процессе дальнейшей биотрансформации, зависящей от состояния ферментных систем организма, происходит включение метаболитов экзогенно введённого АТФ по пути или аденозина фосфата, или инозина. Эффект от введения стандартной дозы трифосаденина (20 мг) ниже, чем от чем описанных ранее нуклеотидов. Так как при её метаболизме образуется меньше активных продуктов, АТФ в больших дозах вводить нельзя из-за роста числа побочных реакций. Наиболее эффективна АТФ, как и другие нуклеотиды, в комплексе с коферментами и витаминными препаратами.
Показания к применению - ИБС, астенические состояния, вегетативно-сосудистая дистония, т.е. тогда, когда необходима умеренная коррекция процессов микроциркуляции путём изменения капиллярного кровообращения, активации синтеза адениловых нуклеотидов в неизменённых системах.
Способ приёма и дозы. Препарат вводят внутримышечно по 1- 2 мл/сут 1% раствора в течение 2-4 нед.
Триметазидин
Препарат поддерживает метаболизм клетки во время ишемии за счёт сохранения её энергетического потенциала, коррекции нарушений ионного транспорта, препятствия действию свободных радикалов. Способствует сохранению энергетического потенциала митохондрий, уменьшает внутриклеточный ацидоз, вызванный гипоксией, сохраняет внутриклеточный Ca2+, препятствует увеличению его концентрации в цитозоле. Значительно снижает перекисное окисление мембранных липидов. Триметазидин оказывает действие только на клетки, вовлечённые в патологический процесс. В физиологических условиях заметного действия на ткани не выявлено. В терапевтической концентрации увеличивает электрический потенциал ишемизированного миокарда и уменьшает выход креатинфосфокиназы. Триметазидин уменьшает величину некроза и степень структурных изменений ткани при инфильтрационном отёке от сильной гипоксии.
Показания к применению. В отличие от других ЛС указанной группы в ряде многоцентровых контролируемых исследований у триметазидина обнаружена антиангинальная эффективность при стабильной стенокардии напряжения.
Способ приёма и дозы. Начальная доза препарата - per os 20 мг 3 раза в сутки. Создана пролонгированная форма триметазидина (предуктал МВ*) - принимают по 35 мг 2 раза в сутки. Пациенты хорошо переносят лечение, побочные эффекты возникают крайне редко и слабо выражены. Отсутствуют данные о несовместимости триметазидина с другими ЛС. Он не взаимодействует с антикоагулянтами, гликозидами, диуретиками. В настоящее время не выявлено противопоказаний к применению препарата.
АНТИОКСИДАНТЫ
Наиболее интенсивно процессы свободнорадикального окисления происходят в фосфолипидном среднем слое мембраны клеток. Процессы перекисного окисления липидов в здоровом организме протекают сбалансированно. В норме образование свободных радикалов происходит в небольшом количестве. Однако их концентрация возрастает при любом патологическом процессе прямо пропорционально тяжести состояния. Под влиянием различных повреждающих факторов происходит разобщение процессов окислительного фосфорилирования и тканевого дыхания. Атомарный кислород утрачивает роль акцептора электронов в дыхательной цепи, снижается выработка АТФ и креатинфосфата в тканях - возникает дефицит энергии. Снижается поляризация клеточных мембран, увеличивается проницаемость цитоплазматических и лизосомальных мембран, что приводит к выходу в межклеточную жидкость ионов K+ и лизосомальных ферментов, деполяризации клеточной мембраны. Снижение её заряда способствует активации потенциалзависимых Ca2+-каналов и поступлению ионов Ca2+ внутрь клетки. Изза недостатка АТФ происходит нарушение работы кальциевого насоса, обычно удаляющего ионы из клетки, не происходит их депонирования в ЭПР, митохондриях и т.д. Ионы свободного внутриклеточного Ca2+ увеличивают активность протеаз, липаз, в частности фосфолипазы A2 (под её влиянием из фосфолипидов мембраны происходит высвобождение свободных жирных кислот, особенно арахидоновой).
В здоровом организме действует защитный механизм (например, ферменты: каталазы, пероксидазы, супероксидизмутазы - и так называемые «ловушки радикалов»: витамины A, C, E, глутатион, серосодержащие соединения, биогенные амины, эссенциальные микроэлементы).
Оценить интенсивность процесса перекисного окисления липидов можно, определяя концентрацию малонового диальдегида в плазме крови и мембранах клеток.
Антиоксидантный статус клетки зависит от интенсивности свободнорадикального окисления и антиокислительной активности.
К антиоксидантам относят соединения различной химической природы, способные тормозить или устранять свободнорадикальное окисление органических веществ молекулярным кислородом в организме человека.
Механизмы действия антиоксидантных препаратов:
• изменения структуры мембраны, приводящие к ограничению доступа окислителей к ненасыщенным жирным кислотам;
• повышение активности эндогенных антиоксидантных систем (глутатионредуктазы, каталазы);
• прямое взаимодействие со свободными радикалами кислорода с устранением их активности;
• связывание катализирующих свободнорадикальные реакции ионов Fe2+ и Cu2+.
В медицинской практике в качестве антиоксидантов наиболее часто используют витамины A, C, E, препараты, содержащие фосфолипиды и микроэлементы (Se, Zn).
Витамин A
Антиоксидантные свойства ретинола: препятствует окислению цистеина; обеспечивает нормальное функционирование поверхностного эпителия (не допускает чрезмерного ороговения); препятствует канцерогенному действию бензпирена путём торможения микросомального окисления; замедляет фотохимические свободнорадикальные реакции.
Витамин C
Аскорбиновая кислота во взаимодействии с токоферолом и глутатионом - главный компонент биологической антиоксидантной системы. Обеспечивает движение восстановленных пиридиннуклеотидов через токоферол на «гашение» свободных радикалов (реакция - нейтрализация первичного радикала). Витамин C - физиологический антиоксидант, защищающий организм человека от «простудных» заболеваний и старения. Особенно его антиоксидантный эффект заметен при поражениях лёгких, протекающих с усилением свободнорадикального окисления (пневмония, бронхиальная астма, хронические неспецифические заболевания).
Витамин E
Молекулы витамина E взаимодействуют с пероксидными радикалами липидов, восстанавливая их в гидропероксиды, но сами при этом превращаются в токоферолхинон, экскретируемый затем почками. Таким образом, витамин E сохраняет целостность и функциональную активность клеточных мембран, останавливая процесс образования перекисей липидов. Молекулы витамина в комплексе с Se и полиненасыщенными жирными кислотами (преимущественно с арахидоновой) входят в состав биологических мембран. Сохраняя жирные кислоты в мембранах тромбоцитов и препятствуя образованию эндоперекисей и предшественников простагландинов, витамин E ограничивает процесс их агрегации (тем самым снижает риск прогрессирования заболеваний сердечно-сосудистой системы).
Кофермент Q10
Кофермент Q10 (КoQ10), увеличивая синтез АТФ, стимулирует процессы клеточного дыхания в кардиомиоцитах. Оказывает клинически значимое антиоксидантное защитное действие. Предохраняет мембраны кардиомиоцитов от перекисного окисления. Сокращает зону повреждения миокарда в условиях ишемии и реперфузии. КoQ10активирует Na+-К+-АТФазу, что нормализует процесс реполяризации мембран и, таким образом, препятствует удлинению интервала Q-T.
Водорастворимая форма убихинона обладает более высокой биодоступностью по сравнению с жирорастворимой.
Сочетание кофермента Q10 и витамина E препятствует развитию атеросклероза, воздействуя на липопротеиды низкой плотности. Препарат стимулирует метаболические процессы, повышает переносимость физических нагрузок.
Янтарная кислота
Янтарная кислота повышает активность антиоксидантной системы клетки за счёт восстановления глутатиона и активности витамина E и КoQ10, ферментов антиоксидантной защиты (глутатионпероксидазы и каталазы).
Селен
Se - компонент глутатионпероксидазы, разрушающей эндоперекиси, образовавшиеся при перекисном окислении липидов (табл. 23-11). Витамин E не заменяет Se, так как тот и другой действуют на различ-
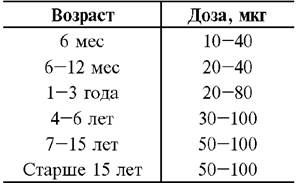
Таблица 23-11. Суточная доза Se в зависимости от возраста
ные звенья патогенеза перекисного окисления липидов. Однако они обладают синергизмом и при совместном назначении их дозы можно снижать. В настоящее время приоритетную позицию занимают препараты, в которых Se содержится в виде комплекса с биолигандами (природными носителями микроэлементов): в дрожжах - триовит*; в водорослях - спирулина, с гуминовыми кислотами (табл. 23-12).
Таблица 23-12. Se-содержащие лекарственные препараты, пищевые добавки и витамины
* Дозы препарата, требующие контроля селена в организме при курсовом назначении.
 Свойства антиоксидантов обнаружены у некоторых микроэлементов: Mo, Ni, W, Zn.
Свойства антиоксидантов обнаружены у некоторых микроэлементов: Mo, Ni, W, Zn.
ПРЕПАРАТЫ ЖЕЛЕЗА
Взаимодействие
Ферменты поджелудочной железы в течение 1-2 ч угнетают всасывание препаратов Fe. В течение 3 ч нарушают их всасывание некоторые антациды (ионы Ca, Mg, Al, входящие в их состава, образуют с железом плохо растворимые комплексы). Аналогичным эффектом обладает колестирамин.
 При одновременном приёме Fe и тетрациклинов образуются плохо всасывающиеся хелаты (в то же время 200 мг FeSO4 в течение 3 ч значительно снижают абсорбцию терапевтических доз тетрациклинов). В случае необходимости комбинации тетрациклинов с препаратами, содержащими ионы железа, последние должны быть приняты только после того, как будет достигнут максимальный уровень концентрации антибиотика в плазме крови. Аналогичным способом следует поступать при необходимости одновременного назначения пациенту препаратов железа и ципрофлоксацина, ломефлоксацина и богатых кальцием продуктов питания. Степень взаимодействия меньше при использовании препаратов Fe с энтеральным покрытием.
При одновременном приёме Fe и тетрациклинов образуются плохо всасывающиеся хелаты (в то же время 200 мг FeSO4 в течение 3 ч значительно снижают абсорбцию терапевтических доз тетрациклинов). В случае необходимости комбинации тетрациклинов с препаратами, содержащими ионы железа, последние должны быть приняты только после того, как будет достигнут максимальный уровень концентрации антибиотика в плазме крови. Аналогичным способом следует поступать при необходимости одновременного назначения пациенту препаратов железа и ципрофлоксацина, ломефлоксацина и богатых кальцием продуктов питания. Степень взаимодействия меньше при использовании препаратов Fe с энтеральным покрытием.
С другой стороны, аскорбиновая, янтарная кислота и их соли, лактоза, фруктоза, декстроза (глюкоза*), серосодержащие аминокислоты (цистеин, метионин), инозин при одновременном приёме с Fe2+ предохраняют его от окисления (перехода в Fe3+) и увеличивают всасывание. Оптимальная доза аскорбиновой кислоты, обеспечивающая наибольшее всасывание, - 200 мг на каждые 30 мг Fe2+.
Хлорамфеникол может замедлить реакцию костного мозга на ионы железа. Этанол, особенно в высоких дозах и при длительном применении, увеличивает абсорбцию и печёночное накопление Fe. Препараты железа не следует запивать чаем (с танином образуются плохо всасывающиеся соединения). Пища уменьшает всасывание Fe2+ на 30-80% (наибольшим эффектом обладают твёрдая пища, хлеб, сырые злаки, молоко и молочные продукты, мороженое, яйца, овощи).
Оценка эффективности лечения
При лечении первого (манифестного) этапа железодефицитной анемии контроль над количеством эритроцитов и ретикулоцитов, концентрацией гемоглобина, цветовым показателем проводят 1-2 раза в неделю. Эффект считают хорошим, если прирост гемоглобина составляет 1-2 (г/л)/сут, а эритроцитов - 0,04х1012/сут. Достижение концентрации гемоглобина 115-120 г/л - критерий ликвидации первого этапа болезни.
При лечении латентного этапа железодефицитной анемии дополнительно контролируют концентрацию сывороточного железа (после 5-7-дневного перерыва в приёме препаратов). Нормализация концентрации сывороточного железа и достижение индивидуальной нормы гемоглобина и эритроцитов - ликвидация латентного этапа.
Для выявления прелатентной фазы железодефицитной анемии необходимы более тонкие исследования, в частности тест с дефероксамином, радиоиммунное определение ферритина, определение степени абсорбции радиоактивного железа и др.
ВИТАМИНЫ. СРЕДСТВА, АКТИВИРУЮЩИЕ И КОРРИГИРУЮЩИЕ МЕТАБОЛИЗМ. ПРП ЖЕЛЕЗА





 В результате многочисленных клинико-экспериментальных наблюдений установлено, что в человеческом организме есть межвитаминные взаимодействия: в процессе обмена физиологическое действие каждого витамина осуществляется в комплексе с воздействием других. Рассматривая взаимодействие тиамина с пиридоксином, следует отметить, что большинство авторов отмечают антагонистический характер взаимоотношений между этими витаминами. При введении витамина B6 наблюдают повышение экскреции тиамина, снижение концентрации тиаминдисульфида в крови и общего тиамина в тканях. При введении тиамина отмечают резкое снижение концентрации в крови коферментной формы пиридоксина и увеличение экскреции 4-пиридоксовой кислоты, что, по мнению некоторых авторов, можно расценивать как обеднение организма пиридоксином. Конкурентные взаимоотношения между витаминами B1 и B6 обусловливают необходимость введения пиридоксина в период использования тиамина (их применяют поочерёдно - через день). В связи с тем что конкуренция между витаминами может осуществляться на путях фосфорилирования, целесообразно применять вместо тиамина его коферментную форму - тиаминдисульфид (кокарбоксилаза).
В результате многочисленных клинико-экспериментальных наблюдений установлено, что в человеческом организме есть межвитаминные взаимодействия: в процессе обмена физиологическое действие каждого витамина осуществляется в комплексе с воздействием других. Рассматривая взаимодействие тиамина с пиридоксином, следует отметить, что большинство авторов отмечают антагонистический характер взаимоотношений между этими витаминами. При введении витамина B6 наблюдают повышение экскреции тиамина, снижение концентрации тиаминдисульфида в крови и общего тиамина в тканях. При введении тиамина отмечают резкое снижение концентрации в крови коферментной формы пиридоксина и увеличение экскреции 4-пиридоксовой кислоты, что, по мнению некоторых авторов, можно расценивать как обеднение организма пиридоксином. Конкурентные взаимоотношения между витаминами B1 и B6 обусловливают необходимость введения пиридоксина в период использования тиамина (их применяют поочерёдно - через день). В связи с тем что конкуренция между витаминами может осуществляться на путях фосфорилирования, целесообразно применять вместо тиамина его коферментную форму - тиаминдисульфид (кокарбоксилаза). Свойства антиоксидантов обнаружены у некоторых микроэлементов: Mo, Ni, W, Zn.
Свойства антиоксидантов обнаружены у некоторых микроэлементов: Mo, Ni, W, Zn. При одновременном приёме Fe и тетрациклинов образуются плохо всасывающиеся хелаты (в то же время 200 мг FeSO4 в течение 3 ч значительно снижают абсорбцию терапевтических доз тетрациклинов). В случае необходимости комбинации тетрациклинов с препаратами, содержащими ионы железа, последние должны быть приняты только после того, как будет достигнут максимальный уровень концентрации антибиотика в плазме крови. Аналогичным способом следует поступать при необходимости одновременного назначения пациенту препаратов железа и ципрофлоксацина, ломефлоксацина и богатых кальцием продуктов питания. Степень взаимодействия меньше при использовании препаратов Fe с энтеральным покрытием.
При одновременном приёме Fe и тетрациклинов образуются плохо всасывающиеся хелаты (в то же время 200 мг FeSO4 в течение 3 ч значительно снижают абсорбцию терапевтических доз тетрациклинов). В случае необходимости комбинации тетрациклинов с препаратами, содержащими ионы железа, последние должны быть приняты только после того, как будет достигнут максимальный уровень концентрации антибиотика в плазме крови. Аналогичным способом следует поступать при необходимости одновременного назначения пациенту препаратов железа и ципрофлоксацина, ломефлоксацина и богатых кальцием продуктов питания. Степень взаимодействия меньше при использовании препаратов Fe с энтеральным покрытием.

