Пред уг-вод-ы, их химические свойства.
Алканы (парафины) - это насыщенные (предельные) углево. Они имеют общую формулу СnН2n+2, В алканах атомы уг-род-а связаны между собой только простыми (одинарными) связями, а остальные валентности уг-род-а насыщены атомами водорода. Характерный суффикс для насыщенных уг-вод-ов-ан.,
СН4 - метан; С2Н6 - этан; С3Н8 - пропан
С4Н10 - бутан (2 изомера)
С5Н12 - пентан (3 изомера)
С6Н14 - гексан, С7Н16 - гептан
С8Н18 - октан С9Н20 - нонан С10Н22 – декан
Химические св-ва:
1)Замещение: CH4+Cl2→CH3Cl+HCl (хлористый метил)
CH3Cl+HCl→CH2Cl2+HCl (хлористый метилен) CH2Cl2+Cl2→CHCl3+HCl (хлороформ)
3)Нитрование: характерно для имеющим вторичный или третичный атом уг-род-а.

Р-я КОНОВАЛОВА
4)При температуре 100-500ºС и кислороде - крекинг
- р-я горения CH4+2O2 →CO2+H20(полное), 2СН4+О2à2СО+4Н2(неполное)
-Каталитическое окисление2СН3-СН2-СН2-СН3 + 5О2 →4СН3СООН (уксусная кислота),
-реакция отщипления: 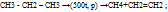 (крекинг)
(крекинг)

-изомеризация 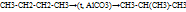
5) Галогенирование СH4+Cl2→CH3Cl+HCl
Получение алканов.
в промышленности:
1. Фракционированием природного газа и перегонкой нефти.
2. Синтез при  t (вольтова дуга),
t (вольтова дуга),
C + 2H2 →CH4
Химические способы получения:
1)Из солей орг кисл. Cплавление ацетата натрия со щелочью: СН3СOONa + NaOH →CH4 + Na2CO3
2)Синтез Вюрца: CH3Cl+2Na+ClCH2-CH3→2NaCl+C3H8
3)Из магний органических соединений: CH3Br+Mg→CH3MgBr
CH3MgBr+H2O→CH4+Mg(OH)Br
4)Синтез Бертло: C2H5I+HI→C2H6+I2
5)Из алкенов 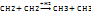
6) Восстановление галогенпроизводных алканов. CH3Cl+H2→(p,pt)→CH4+HCl
Галогенопроизводные уг-вод-ов
Это производные пред и непред, аром уг-вод-ов, у которых 1 или несколько атомов Н замещены на галагены Галогенопроизводные уг-вод-ов получают взаимодействием уг-вод-ов (как предельных, так и непредельных) с галогенами. Галогенопроизводные уг-вод-ов используются для синтеза многих органических веществ (спиртов, аминов и др.).
Получение:
1)Галагенирование СН4 + Cl2 →CHCl3 + HCl; CH3Cl + Cl2 →CH2Cl2 + HCl;
CH2Cl2 + Cl2 →CHCl3 + HCl; CHCl3 + Cl2 →CCl4 + HCl
2) из непредельных уг-вод-ов. (этен + хлор)

3)из спиртов 3R-OH+PCl3→3R-Cl+H3PO4; CH3-OH+Br2→CH2Br-OH+HBr
Хим св-ва:
1)Реакция Вюрца +2Na+ClCH2-CH3→2NaCl+C3H8,
2) 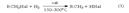
3) 2RHal + Na →R–R + 2NaHa
4) а) реакции гидролиза
RHal + H2O → ROH + HHal
RHal + NaOH → ROH + NaHal
б) реакции образования простых эфиров (реакция Вильямсона)
RHal + R`ONa →ROR` + NaHal
в) синтез сложных эфиров
R1Hal + RCOONa → RCOOR1 + NaHal
Диеновые уг-вод-ы. Особенности реакции присоединения в зависимости от положения двойных связей.
Это непред уг-вод-ы, в молекулах которых присутствуют две двойные связи. Общая формула алкадиенов СnH2n-2 a) кумулированными – обе двойные связи принадлежат одному атому уг-род-а
СH2=C=CH2 - пропадиен CH2=C=CH-CH3 - бутадиен-1,2
б) сопряженными (конъюгиро ванными) - разделены одной простой связью
СH2=CH-CH=CH2 - бутадиен-1,3; CH3-CH=CH-CH=CH2 - пентадиен-1,3
в) изолированными - разделены двумя и более простыми связями
CH2=CH-CH2-CH=CH2 - пентадиен-1,4
Реакции присоединения.
1) CH2=CH-CH=CH2(бутандиен 1.3) + Br2 →СH2Br-CH=CH-CH2Br (1,4-дибромбутен-2)
CH2=CH-CH=CH2 + Br2 →СH2Br-CHBr-CH=CH2
1,2-дибромбутен-1
2)Бромирование СH2=CH-CH=CH2+Br2 (избыток) →СH2Br-CHBr-CHBr-CH2Br (тетрабромбутан)
Правила ориентации
Заместители, имеющиеся в бензольном ядре, направляют вновь вступающую группу в определенные положения, т.е. оказывают ориентирующее действие.
Ориентанты 1-го рода (орто-пара -ориентанты) направляют последующее замещение преимущественно в орто - и пара -положения.
К ним относятся галогены радикалы гидроксогруппа аминогруппа
Ориентанты 2-го рода (мета -ориентанты) направляют последующее замещение преимущественно в мета -положение.
К ним относятся нитрогруппа - NO2, карбоксильная - COOH альдегидная - CH=O - сульфидная SO3H
Хим. Св-ва.
РЕАКЦИИ ПРИСОЕДИНЕНИЯ
1. Гидрирование карбонильных соединений. Из альдегидов при восстановлении образуются первичные спирты, H-COH + H2→СH3OH;
2. Прис.Н2О
R-COH+H2O=R-CH(OH)2 (двухатомный спирт)
3. Взаимодействие сенильной кислотой R-COH+H-CN=R-CH(OH)(CN) (оксинитрил)
4. Взаимодействие со спиртами R-COH+R1-OH=R-CH(OR1)(OH)(полуацеталь) R-COH+R1-OH=(t* HCl)=R-CH(OR1)(OR1) (ацеталь)
РЕАКЦИИ ЗАМЕЩЕНИЯ КАРБОНИЛЬНОЙ ГРУППЫ
CH3-COH+PCl5→CH3-CHCl2+POCl3
РЕАКЦИИ ЗАМЕЩЕНИя В РАДИКАЛЕ
CH3-COH+Br2=Br-CH2-COH+HBr (бромуксусный альдегид)
Р.ОКИСЛЕНИЯ
CH3-COH+Ag2O→CH3COOH+2Ag
Р.АЛЬДОЛЬНОЙ КОНЦЕНТРАЦИИ
CH3COH+ CH3COH→CH3-CH(CH3)-CH2-COH→CH3-CH=CH-COH+H2O
Р.КУЧЕРОВА CH≡CH+H2O→CH2=CHOH→CH3COH
Получение альдегидов.
К альдегидам относят органические соединения, имеющие в своем составе карбонильную группу С=О, соединенную в альдегидах с одним уг-вод-ным радикалом
1 окисление метанола
CH3OH + O2 →2H-COH(формальдегид,муравьиный альдегид) + 2H2O;
2. Дегидрирование метанола в газовой фазе на катализаторе (Сu, Ni).СН3OH→H-COH + H2
С2H2 + H2O →CH2=CH-OH →CH3-COH(уксусный альд)
3 ЩЕЛОЧНОЙ ГИДРОЛИЗ ДИГАЛОГЕНПРОИЗВОДНЫХ
CH3-CHCl2+2NaOH→CH3C(OH)3+2NaCl→CH3COH+H2O+2NaCl
4. Р.КУЧЕРОВА CH≡CH+H2O→CH3COH
Дикарбоновые кислоты.
Карбоновые кислоты - это производные уг-вод-ов, имеющие в своем составеодну или несколько карбоксильных групп. Общая формула карбоновых кислот - R-COOH. Карбоксильная группа в свою очередь состоит изкарбонильной (>С=О) и гидроксильной (-ОН) групп В зависимости от количества карбоксильных групп карбоновые кислоты делят наодноосновные(монокарбоновые), двухосновные(дикарбоновые) и многоосновные кислоты. Это орг.соединения содержащие две карбоксильные групппы. Двухосновные кислоты
НООС-СООН щавелевая (этандиовая)
НООС-СН2-СООН малоновая пропандиовая
НООС-СН2-СН2-СООН янтарная (бутандиовая)
НООС-СН2-СН2-СН2-СООНпентандиовая, глутаровая
НООС-СН2-СН2-СООН янтарная=(-Н2О)=ангидрид янтарной кислоты
ПОЛУЧЕНИЕ:
1)окисление 2хатомных спиртов CH2(OH)- CH2(OH)→[O],-H2O→COH-COH→[O]→COOH-COOH
2)из дигалогенпроизводных Cl-CH2-CH2-Cl→(2KCl)→N≡C-CH2-CH2-C≡N→(+6H2O,-2NH3)→HOOC-CH2-CH2-COOH+2H2O
ХИМИЧЕСКИЕ СВ-ВА
1)реакции замещения
COOH-COOH→(+NaOH,-H2O)→ COONa-COOH→(+NaOH,-H2O)→ COONa-COONa
2)выдеоение СО2 при t
COOH-COOH→CO2+HCOOH
COOH-CH2-COOH→CO2+CH3COOH
3)выделение Н2О при t
СООН-CH2-CH2-COOH→(t,-H2O)→ (-CH2-COOOC-CH2-)ЦИКЛ
4) COOH-COOH→[O]→CO2+CO+H2O
5) COOH-CH2-COOH+2C2H5O→CO(O-C2H5)-CH2-CO(O-C2H5)+H2O
6) СООН-CH2-CH2-COOH+2NH4OH→ СООNH4-CH2-CH2-COONH4→(-H2O)→ СОNH2-CH2-CH2-CONH2→(-NH3)→(-CH2-C(O)-NH-C(O)-CH2-)→(-CH=CH-NH-CH=CH-)
Прогорание жира.(окисление)
1)гидролитическое под действием ферментов, микроорганизмов- образование масляной кислоты. 2) окислительное присутствии кислорода, образуются альдегиды и кетоны
Мыла растворимые и нерастворимые Мыла можно разделить на две группы: растворимые и нерастворимые. Растворимые мыла представляют собой натриевые, калиевые и аммониевые соли высших жирных кислот, особенно олеиновой. Нерастворимые мыла представляют собой соли этих кислот с тяжелыми и щелочно-земельными металлами
Свинцовое мыло(образование): 2C17H35COONa+(CH3COO)2Pb(ацетат свинца)→(C17H35COO)2Pb↓-2CH3COONa
(это мыло можно растворить в бензоле)
Серин

Лецетин

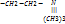
Ди - и трипептиды.
– этоорганические вещества, молекулы которых построены из аминокислот, соединённых пептидной связью. В зависимости от числа входящих в молекулу аминокислот различают дипептиды, трипептиды и т.д., а также полипептиды. Как правило, молекулы пептидов линейны, причём один конец цепи заканчивается карбоксильной группой (-СООН), а другой – аминогруппой (—NH2). Но цепь может быть и замкнута в циклическую структуру. Присоединение происходит за счет выделения воды из карбонильной группы одной а/к и аминогруппы другой. Так как белки синтезируются в виде полипептидных цепей, граница между полипептидом и простым белком условна. Пептидами являются многие важные для организмов вещества – некоторые гормоны, антибиотики, токсины.



51)Пиримидиновые основания. ПИРИМИДИНОВЫЕ НУКЛЕОТИДЫ
- группа природных веществ, производные пиримидина. Различаются характером и положением заместителей в пиримидиновом ядре. Представляют собой бесцветные, кристаллические вещества, с температурой плавления выше 300 °C, растворимые в воде, не растворимые в спиртах и полярных растворителях. Пиримидиновые основания получают путем кислотного гидролиза нуклеиновых кислот. Пиримидиновые основания широко распространены в животных, растительных тканях и в микроорганизмах. Биологически наиболее важными являются урацил (2,6-диоксипиримидин), цитозин (2-окси-б-аминопиримидин), тимин (5-метилурацил), входящие в состав нуклеиновых кислот, нуклеотидов и нуклеозидов.:
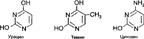
Благодаря способности специфически (по принципу комплементарности) взаимодействовать с пуриновыми основаниями П. о. участвуют в кодировании и передаче наследственной информации нуклеиновыми кислотами.
Нуклеозиды и нукпеотиды.
Нуклеиновые кислоты состоят из мононуклеотидов. Нуклеотид состоит из трёх компонентов: 1. азотистое основание (пуриновое или перимединовое), 2. сахар: рибоза (С5Н10О5) или дезоксирибоза C5H10O4.,фосфорная к-та. Пуриновые основания. Родоначальник – ПУРИН:

Пиримидиновые основания. ПИРИМИДИН:
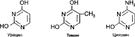
Азотистые основания: АМФи АТФ


Нуклеозиды – это нуклеотиды без фосфорной кислоты. Аденозин:
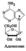 Прис.фосфорной к-ты возможно по трем положениям гидроксогрупп рибозы: 2, 3, 5. Аденин, гуанин и цитозин входят как в ДНК, так и РНК. Тимин – только в ДНК, урацил – только в РНК.
Прис.фосфорной к-ты возможно по трем положениям гидроксогрупп рибозы: 2, 3, 5. Аденин, гуанин и цитозин входят как в ДНК, так и РНК. Тимин – только в ДНК, урацил – только в РНК.
Схема строения РНК и ДНК.
Структура ДНК(А-Г-Ц-Т): цепь ДНК представляет собой углеводофосфатную последовательность, с которой соединены азотистые основания. Молекулы фосфорной кислоты соединяют собой молекулы оксирибозы, группы ОН 3 и 5 уг-род-а. Молекула ДНК имее 2 цепи нуклеотидов, расположенных параллельно друг другу. Эти две цепи удерживаются за счет водородных связей. Комплементарность обеспечивает одинаковое расстояние между азотистыми основаниями. Последовательность азотистых оснований одной цепи строго соответствует последовательность оснований другой цепи.
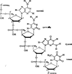
Структура РНК(А-Г-Ц-У). Нить РНК – этопоследовательность рибонуклеотидов, соединенных в одну цепь. (линейная структура). Соединение рибонуклеотидов между собойосуществляется эфирной связью между 3-ей –ОН рибозы одного нуклеотида и 5-ой –ОН рибозы следующего нуклеотида. Азотистые основания РНК – А и Г (пуриновые) и Ц и У (пиримидиновые). А и Г присоединяются к пентозе через N 9-ого положения. Ц и У – через атом N в 1-ом положении. Отличительная особенность ДНК от РНК то, что для неё не характерно устойчивое спиральное строение. Она линейна. РНК

54)Хромопротеиды. Структура гема.
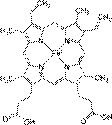
Это протеиды, состоящие из белков и окрашенных веществ. Они участвуют в процессах, связанных с преобразованием или переносом энергии (дыхание, фотосинтез, зрение и т. д.), отвечают за свето- и цветовосприятие. (Хролофилл – зеленый пигмент по структуре близок к гему). Это дыхательные пигменты (гемоглобин и миоглобин) и ряд ферментов (каталаза и пероксидаза). Гемопротеиды - железосодержащие белки, наиболее изучен - гемоглобин. Он состоит из белка ГЛОБИНА и небелковой части – красящего начала (ГЕМА), его производные это оксигемоглобин (присоединивший к себе О2) и карбоксигемоглобин (+ углекислый газ СО2). Характерной особенностью гемоглобина является его способность соединяться с окисью уг-род-а СО, после чего он теряет способность соединяться с кислородом. Этим объясняется ядовитое действие окиси уг-род-а. Формула гема:
Типы химических связей
1)Ионная связь: прочная химическая связь, образующаяся между атомами с большой разностью (>1,7 по шкале Полинга) электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.

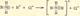 Наиболее ярко выражена в галогенидах щелочных металлов, напр., в NaCl, KF.
Наиболее ярко выражена в галогенидах щелочных металлов, напр., в NaCl, KF.
2)А. Ковалентная связь -образована общей для двух атомом парой электронов. Делится на неполяную –образована атома ми с одинаковой электроотрицаемостью. Полярную - образована атомами с различной электроотрицаемостью

 Б. Ковалентная: химическая связь, образованная перекрытием пары валентных электронных облаков. Обеспечивающие связь электронные облака называются общей электронной парой. Наиболее распространена в органической химии. Обладает высокой прочностью.
Б. Ковалентная: химическая связь, образованная перекрытием пары валентных электронных облаков. Обеспечивающие связь электронные облака называются общей электронной парой. Наиболее распространена в органической химии. Обладает высокой прочностью.
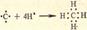 3)Донорно – акцепторная связь: химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора).
3)Донорно – акцепторная связь: химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора).
4)Водородная: форма объединения между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F, реже Cl,Br,S. Водородные связи могут быть межмолекулярными или внутримолекулярными
Характеристика соединений с поляризованной связью.
Это молекулы включающие ковалентные полярные связи.Хар-ся наличием полюсов (наз-ся ди полями. Чем выше разность электроотрицательных атомов тем более рекационно способна молекула.
Виды изомерии
Изомерия-явление сущ-ия Изомеров. Изомер-вещ-ва имеющие одинаковый сост-в атомов, но различное в строение.
А) Структурная изомер-я 1)Изомерия уг-род-ного скелета.
Различая во взаимном расположении атомов С.
2)Изомерия по положению кратной связи
(двойной).
3)Из положения функциональной группы Различия положения функциональной группы относительно уг-род-ного скелета.
В) Пространственная изомер-я
Связана с различным положением атомов или групп атомов относительно двойной связи.(цис-(ванна) и транс-изомеря(кресло), зеркальная изомерия)
48)Строение белковой молекулы (первичная, вторичная, третичная, четвертичная структуры).
Молекулы белков представляют собой линейные полимеры, состоящие из α-L аминокислот (которые являются мономерами). Белки длиной от 2 до нескольких десятков аминокислотных остатков часто называют пептидами, при большей степени полимеризации — белками, Выделяют 4 уровня структуры белка.
Первичная структура (цепь аминокислот)
Вторичная структура (α-спираль или β-складчатой структуры, фиксируется водородными связями между карбонильной и аминогруппами в составе полипептидной цепи
Третичная структура (глобула, которая фиксируется за счет следующих связей: дисульфидной, водородной (с участием боковых полярных группировок ОН, NH2, СООН), гидрофобных (с участием радикалов алифатических аминокислот). Четвертичная структура (комплекс глобул)
Коллоидные системы.
Они имеют размеры частиц дисперсной фазы от 0,1 мк до 1 ммк (или от 10-5 до 10-7 см). Такие частицы могут проходить через поры фильтровальной бумаги, но не проникают через поры животных и растительных мембран.
Коллоидные частицы при наличии у них электрического заряда и сольватно-ионных оболочек остаются во взвешенном состоянии и без изменения условий очень долго могут не выпадать в осадок.
Примерами коллоидных систем могут служить растворы альбумина, желатина, гуммиарабика, коллоидные растворы золота, серебра, сернистого мышьяка и др.
Ионно-дисперсные системы.
Это растворы различных электролитов, как, например, солей, оснований и т.д., распадающихся на соответствующие ионы, размеры которых весьма малы и выходят далеко за пределы
10-8 см.
Общие св-ва ДС:
Броуновское движение – это непрерывное беспорядочное движение частиц микроскопических и коллоидных размеров, не затухающие во времени. Это движение тем интенсивнее, чем выше температура и чем меньше масса частицы и вязкость дисперсионной среды.
Диффузией называется самопроизвольный процесс выравнивания концентрации молекул, ионов или коллоидных частиц под влиянием их теплового движения. Процесс диффузии идет самопроизвольно, поскольку он сопровождается увеличением энтропии системы.
Осмос – это односторонняя диффузия молекул растворителя через полупроницаемую мембрану при условии разности концентраций раствора по обе стороны мембраны.
Седиментация – это еще одно из явлений, связанных с молекулярно-кинетическими свойствами дисперсных систем.
-Устойчивость ДС
А) агрегативная устойчивость (это способность сохранять свою дисперстность эта устойчивость поддерживается наличием заряда и гидрофильной оболочки. При их потере происходит агрегация частиц путем слипания в более крупные. Данное явление называется коагуляцией. Крупные агрегаты постепенно оседают на дно под действием силы тяжести – седиментация. Коагулят, оседая на дно, постепенно уплотняется, молодой коагулят может вернуться в среду путем пептизации.)
Б) кинетическая способность. (это способность частиц удерживаться во взвешенном состояние. Тяжелые частицы оседают в нижние слои среды, а легкие в верхние.
.
Диализ. Электрофорез.
Диализ- это метод очистки белковых растворов от низкомолекулярных примесей. Для проведения диализа необходим цилиндр, у которого вместо дня ППМ, поры которой пропускают мелкие молекулы, но не пропускают молекулы белков. Цилиндр с раствором белка с примесями погружается в емкость с дистиллированной водой. Мелкие молекулы примесей свободно проходят через поры мембраны, равномерно распределяясь между областями внутри и снаружи цилиндра. Для полной очистки необходимо погружать цилиндр в проточную воду. С помощью диализа очищаются белковые растворы фармакологической промышленности. Этот метод лежит в основе «искусственной почки».
Электрофарез – это метод разделения белков на отдельные фракции. В основе работы аппарата эф лежит способность заряженных белковых молекул двигаться в электрическом поле к противоположно заряженному электроду. Различные молекулы – различная скорость, зависящая от молекулярной массы, суммарного заряда, формы. Аппарат для эф состоит из горизонтально расположенного носителя (гелиевого) и электродов, создающих электрическое поле. На носитель наносится раствор с электролитами. Исследуемый раствор наносят в стартовую зону и подают напряжение. Через определенный промежуток времени белки с разной молекулярной массой распределяются по зонам. Из каждой зоны белки можно извлечь и измерить количественно.
61.Явление осмоса. Осмотическое давление.
Представим, что сосуд с двумя горлами для залива раствора разделен мембраной M. В каждую часть сосуда зальем растворы, отличающиеся концентрацией. Поскольку мольные доли растворителя по обе стороны мембраны не совпадают, то стремление их к выравниванию приведет к переходу части растворителя в ту часть сосуда, где концентрация растворенного вещества больше. Увеличение количества растворителя эквивалентно возрастанию давления, и если мембрана способна к деформации, она изогнется в сторону с меньшей концентрацией растворенного вещества.
Осмотическое давление π – внутреннее давление растворенного вещества, численно равное тому внешнему давлению, которое нужно приложить, чтобы прекратить осмос; оно зависит от температуры и концентрации.
62.Скорость химической реакции. Факторы, влияющие на скорость химической реакции.
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ:
V = ± ((С2 - С1) / (t2 - t1)) = ± (DС / Dt)
где С1 и С2 - молярные концентрации веществ в моменты времени t1 и t2соответственно (знак (+) - если скорость определяется по продукту реакции, знак (-) - по исходному веществу).
Реакции происходят при столкновении молекул реагирующих веществ. Ее скорость определяется количеством столкновений и вероятностью того, что они приведут к превращению. Число столкновений определяется концентрациями реагирующих веществ, а вероятность реакции - энергией сталкивающихся молекул.
Факторы, влияющие на скорость химических реакций.
1. Природа реагирующих веществ. Большую роль играет характер химических связей и строение молекул реагентов. Реакции протекают в направлении разрушения менее прочных связей и образования веществ с более прочными связями. Так, для разрыва связей в молекулах H2 и N2 требуются высокие энергии; такие молекулы мало реакционно способны. Для разрыва связей в сильнополярных молекулах (HCl, H2O) требуется меньше энергии, и скорость реакции значительно выше. Реакции между ионами в растворах электролитов протекают практически мгновенно.
Примеры
Фтор с водородом реагирует со взрывом при комнатной температуре, бром с водородом взаимодействует медленно и при нагревании.
Оксид кальция вступает в реакцию с водой энергично, с выделением тепла; оксид меди - не реагирует.
2. Концентрация. С увеличением концентрации (числа частиц в единице объема) чаще происходят столкновения молекул реагирующих веществ - скорость реакции возрастает. Закон действующих масс (К. Гульдберг, П.Вааге, 1867г.)
3. Температура. При повышении температуры на каждые 10°C скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа).
4. Катализ. Вещества, которые участвуют в реакциях и увеличивают ее скорость, оставаясь к концу реакции неизменными, называются катализаторами. Механизм действия катализаторов связан с уменьшением энергии активации реакции за счет образования промежуточных соединений.
63.Катализ. Виды катализа.
Вещества, которые участвуют в реакциях и увеличивают ее скорость, оставаясь к концу реакции неизменными - катализаторы. Механизм действия катализаторов связан с уменьшением энергии активации реакции за счет образования промежуточных соединений.
При гомогенном катализе реагенты и катализатор составляют одну фазу (находятся в одном агрегатном состоянии),
при гетерогенном катализе - разные фазы (находятся в различных агрегатных состояниях). Резко замедлить протекание нежелательных химических процессов в ряде случаев можно добавляя в реакционную среду ингибиторы (явление " отрицательного катализа ").
Пред уг-вод-ы, их химические свойства.
Алканы (парафины) - это насыщенные (предельные) углево. Они имеют общую формулу СnН2n+2, В алканах атомы уг-род-а связаны между собой только простыми (одинарными) связями, а остальные валентности уг-род-а насыщены атомами водорода. Характерный суффикс для насыщенных уг-вод-ов-ан.,
СН4 - метан; С2Н6 - этан; С3Н8 - пропан
С4Н10 - бутан (2 изомера)
С5Н12 - пентан (3 изомера)
С6Н14 - гексан, С7Н16 - гептан
С8Н18 - октан С9Н20 - нонан С10Н22 – декан
Химические св-ва:
1)Замещение: CH4+Cl2→CH3Cl+HCl (хлористый метил)
CH3Cl+HCl→CH2Cl2+HCl (хлористый метилен) CH2Cl2+Cl2→CHCl3+HCl (хлороформ)
3)Нитрование: характерно для имеющим вторичный или третичный атом уг-род-а.

Р-я КОНОВАЛОВА
4)При температуре 100-500ºС и кислороде - крекинг
- р-я горения CH4+2O2 →CO2+H20(полное), 2СН4+О2à2СО+4Н2(неполное)
-Каталитическое окисление2СН3-СН2-СН2-СН3 + 5О2 →4СН3СООН (уксусная кислота),
-реакция отщипления: 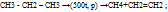 (крекинг)
(крекинг)

-изомеризация 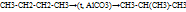
5) Галогенирование СH4+Cl2→CH3Cl+HCl
Получение алканов.
в промышленности:
1. Фракционированием природного газа и перегонкой нефти.
2. Синтез при  t (вольтова дуга),
t (вольтова дуга),
C + 2H2 →CH4
Химические способы получения:
1)Из солей орг кисл. Cплавление ацетата натрия со щелочью: СН3СOONa + NaOH →CH4 + Na2CO3
2)Синтез Вюрца: CH3Cl+2Na+ClCH2-CH3→2NaCl+C3H8
3)Из магний органических соединений: CH3Br+Mg→CH3MgBr
CH3MgBr+H2O→CH4+Mg(OH)Br
4)Синтез Бертло: C2H5I+HI→C2H6+I2
5)Из алкенов 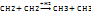
6) Восстановление галогенпроизводных алканов. CH3Cl+H2→(p,pt)→CH4+HCl






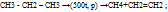 (крекинг)
(крекинг)
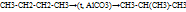
 t (вольтова дуга),
t (вольтова дуга),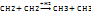

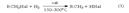


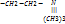








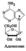 Прис.фосфорной к-ты возможно по трем положениям гидроксогрупп рибозы: 2, 3, 5. Аденин, гуанин и цитозин входят как в ДНК, так и РНК. Тимин – только в ДНК, урацил – только в РНК.
Прис.фосфорной к-ты возможно по трем положениям гидроксогрупп рибозы: 2, 3, 5. Аденин, гуанин и цитозин входят как в ДНК, так и РНК. Тимин – только в ДНК, урацил – только в РНК.



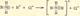 Наиболее ярко выражена в галогенидах щелочных металлов, напр., в NaCl, KF.
Наиболее ярко выражена в галогенидах щелочных металлов, напр., в NaCl, KF.
 Б. Ковалентная: химическая связь, образованная перекрытием пары валентных электронных облаков. Обеспечивающие связь электронные облака называются общей электронной парой. Наиболее распространена в органической химии. Обладает высокой прочностью.
Б. Ковалентная: химическая связь, образованная перекрытием пары валентных электронных облаков. Обеспечивающие связь электронные облака называются общей электронной парой. Наиболее распространена в органической химии. Обладает высокой прочностью.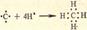 3)Донорно – акцепторная связь: химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора).
3)Донорно – акцепторная связь: химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора).


