Основные правила поведения в бактериологической лаборатории
1.В помещении лаборатории нельзя входить без специальной одежды: халата, сменной обуви.
2.В лабораторию нельзя вносить посторонние вещи, запрещается курить и приносить пищу.
3.При распаковывании заразного материала необходимо соблюдать осторожность: пробирки снаружи обтирать дезинфицирующим раствором; переливание жидкостей, содержащих патогенные микробы, производят над сосудом, содержащим дезинфицирующий раствор.
4.Если разбилась посуда, содержащая заразный материал (пробирки, чашка Петри и др.), немедленно производится обеззараживание предметов, одежды, стола и помещения.
5.После окончания работы дезинфицируют руки и поверхность рабочего стола.
6.Музейные культуры микробов ставят на хранение в холодильник, закрывают и опечатывают
7.Работники лаборатории подлежат обязательной вакцинации против тех инфекционных болезней, с возбудителями которых они работают. На кафедре микробиологии используются материалы, содержащие возбудителей III-IV групп, после разрешения председателя режимной комиссии Республиканской СЭС.
Правила забора материала для микробиологических исследований
При заборе и работе с клиническим материалом персонал должен использовать перчатки и халат. При этом необходимо соблюдать ряд правил.
1)Забор исследуемого материала следует провести до начала антибактериальной терапии или через 8-10 часов после приема последней дозы антибиотика. Необходимо соблюдать строжайшую асептику. Используют стерильный материал: а) ватные томпоны для взятия материала из раны, со слизистых оболочек (глаз, зева, носа); проволочную петлю для взятия материала из влагалища, анального отверстия; б) шприц для взятия крови, гноя; в) стерильную посуду для непосредственного сбора мочи, мокроты, испражнений.
Кровь для посева следует брать из вены на высоте подъема температуры; Посев производится в жидкую элективную среду в соотношении 1:10.
Моча здорового человека стерильна. От начала взятия пробы мочи до начала исследования в лаборатории должно проходить не более 1-2 часов.
Испражнения на патогенные энтеробактерии берут ректальными петлями, смоченными консервантом, и помещают в пробирку с консервирующей средой.
Слизь из носоглотки (на дифтерию) забирают стерильным тампоном натощак.
Спинно-мозговую жидкость получают в результате люмбальной пункции. 3-5мл ликвора помещают в пробирку (при транспортировке предохранять от охлаждения).
Мокроту собирают натощак после ополаскивания рта.
2)Транспортировку полученного материала следует проводить в максимально короткие сроки (2-3 часа) в специальных биксах или пеналах.
3)Направление прилагается к клиническому образцу в качестве сопроводительного документа (см. практические навыки 1.4).
Оформление направления на микробиологическое исследование
Направление на исследование является сопроводительным документом, который прилагается к инфекционному материалу, предназначенному для лабораторных исследований.
Составляется по следующей форме:
1) название материала;
2) учреждение, направляющее материал;
3) фамилия, имя, отчество больного;
4) возраст;
5) адрес обследуемого;
6) дата заболевания;
7) дата взятия материала;
8) предполагаемый клинический диагноз;
9) подпись врача, направляющего материал.
Поступивший в лабораторию инфекционный материал регистрируется в специальном журнале.
Пробирки
1. биологические – с крупным дном, неразвернутым краем;
2. центрифужные – сужены книзу, конической формы
3. преципитационные – очень узкие с внутренним диаметром 2-3мм
Стеклянные чашки Петри для выращивания микроорганизмов на плотных питательных средах. Их изготавливают из прозрачного стекла, не имеющего камней, пузырей. Высота чашки 20-30мм, диаметр 60-200мм
Пипетки
1. градуированные должны соответствовать параметрам ГОСТа
2. пастеровские – стеклянные трубки диаметром 5-7мм, у которых один конец оттянут над пламенем горелки в виде капилляра
Специальная лабораторная посуда должна быть чистой и стерильной. Мытье производят ершами с мылом и содой. Новую посуду следует до мытья прокипятить в 1-2% растворе хлористоводородной кислоты. Сушат посуду в сушильном шкафу.
Сухую посуду закрывают и помещают в пеналы. В пробирки вставляют ватные пробки и заворачивают в пачки по 5–10штук. К чашкам Петри подбирают крышки и завертывают по одной или несколько штук.
Пипетки закрывают ваткой с того конца, который берут в руки. Готовые пипетки заворачивают в бумагу и укладывают в пеналы.
Стерилизация проводится в сухожаровом шкафу при температуре 180°С в течение 1 часа.
Окраска мазка по Граму
Метод Грама введен в 1884 году датским микробиологом Гансом Христианом Грамом и применяется для выявления грамположительных и грамотрицательных бактерий (рис.1).
Методика окраски.
1 .На фиксированный мазок накладывают фильтровальную бумагу, пропитанную генцианвиолетом и наносят каплю воды на 2 минуты. Генцианвиолет основная краска.
2. Бумагу сбрасывают и, не промывая водой, наливают раствор Люголя на 1 минуту. Раствор Люголя протрава: усиливает действие основной краски у грамположительных бактерий.
3. Препарат обесцвечивают 3-5 каплями спирта в течение 30 секунд до прекращения отхождения фиолетовых струек краски. Спирт обесцвечивающий фактор.
4. Промывают водой.
5. Докрашивают водным фуксином Пфейффера в течение 1-2 минут. Водный фуксин дополнительная краска. Грамположитель-ные бактерии (кокки) сине-фиолетового цвета, грамотрицательные (палочковидные формы) розового цвета.
6. Промывают водой, высушивают фильтровальной бумагой и микроскопируют под иммерсией.
Способность грамположительных бактерий при окраске по Граму удерживать комплекс генцианвиолета с йодом связана со свойствами многослойного пептидогликана. Обработка спиртом вызывает сужение пор пептидогликана и тем самым задерживает краску. Наоборот, грамотрицательные бактерии после воздействия спиртом утрачивают краситель, обесцвечиваются и окрашиваются фуксином в красный цвет вследствие меньшего содержания пептидогликана, у них наиболее выражен липополисахаридный слой.
Окраска по способу Ожешки
Метод Ожешки применяется для выявления спор. Этапы окраски:
1) на нефиксированный мазок наносят 0,5% раствор соляной кислоты и подогревают на пламени спиртовки 2-3 минуты;
2) кислоту сливают, препарат промывают водой, высушивают и фиксируют над пламенем ;
3) окрашивают по Циль-Нильсену.
Споры бактерий окрашиваются в красный цвет, а вегетативные формы в синий (рис.5).
Микроскопические
Метод «раздавленной капли»
Культуру в изотоническом растворе хлорида натрия наносят на предметное стекло и сверху накладывают покровное. Капля материала должна быть такой величины, чтобы она заполняла все пространство между покровным и предметным стеклом и не выступала за пределы покровного. Препарат рассматривают с иммерсионной системой и слегка опущенным конденсором.
Метод «висячей капли»
Необходимо иметь предметное стекло с лупочкой. Каплю культуры наносят на покровное стекло. Сверху накладывают предметное стекло с лупочкой посредине, края которого предварительно обмазаны вазелином. Затем предметное стекло слегка прижимают к покровному, и препарат переворачивают покровным стеклом кверху. Получается герметично закрытая камера, в которой капля долго не высыхает.
Бактериологические
Метод Шукевича
Для этого каплю микробной взвеси наносят в конденсат скошенной плотной питательной среды в пробирке. Подвижные микробы (протей) способны подниматься вверх по скошенному агару, неподвижные формы остаются расти внизу на месте посева.
Метод Дригальского
Цель метода: Выделение чистой культуры аэробных и факультативно-анаэробных бактерий и их идентификации.
Исследуемыми материалами могут быть мокрота, гной, испражнение и др. в зависимости от локализации возбудителя инфекционного заболевания. Метод проводится в 4 этапа, при выделении гемокультуры – 5 этапов. Выделение чистой культуры аэробных и факультативно-анаэробных бактерий изучаем на примере выделения чистой культуры кишечной палочки (E coli) из ее смеси со стафилококком.
1-й этап. Получение изолированных колоний. Колонии – это размножившиеся особи одной бактериальной клетки, выросшие на поверхности твердой питательной среды в виде изолированного скопления.
Ход работы:
а) приготовление мазков из данной смеси микробов и окраска по Граму. Под микроскопом видны грамотрицательные кишечные палочки и грамположительные стафилококки ;
б) рассев смеси на чашку с МПА шпетелем (рис.10). Мы засеваем несколько измененным методом Дригальского. Вместо 3-х чашек с МПА берем одну. На поверхность питательной среды в чашке наносят петлёй каплю исследуемого материала в 3-х точках: первые две точки – ближе к стенке чашки, а третью точку – в центре, которую растирают прокаленным и охлажденным шпателем сначала в одном направлении, затем перпендикулярно в другом направлении (рис.11). Чашку надписывают (фамилия студента, номер группы, дата) и ставят в специальный цилиндр вверх дном, чтобы образующиеся капельки паров воды, попадающие на крышу, не стекали на поверхность среды и не размазывали посева;
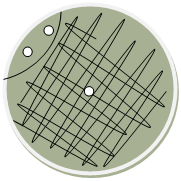
 Рис.11.
Рис.11.
в) инкубация посева в термостате при 370 в течение 18-24 часов.
2-й этап. Выделение чистой культуры, то есть культуры, содержащей одного вида бактерий.
Ход работы:
а) макроскопическое изучение колоний по величине, форме, окраске, характеру поверхности и краев, консистенции, структуре и размеру.
Просматривают чашку (не открывая) со стороны дна в проходящем свете, держа ее на уровне глаз на расстоянии 20-30 см. Видно, что посев смеси дал рост неоднородных колоний. Колонии стафилококка выпуклые, гладкие, блестящие, с ровным краем, размером 1-4 мм в диаметре, прозрачные, золотистые или белого цвета (рис.12). Колонии кишечной палочки слабовыпуклые, полупрозрачные, сероватого цвета, с ровным краем и гладкой блестящей поверхностью, размером 2-3 мм в диаметре (рис.13).
Колонии можно просмотреть с помощью лупы или под микроскопом (при малом увеличении) при этом лучше видна разница в структуре колоний;
б) микроскопическое исследование колоний.
Выбирают изолированные колонии того и другого микроба, из части каждой колонии делают мазки, окрашивают их по Граму и микроскопируют. Убеждаются, что золотистого цвета колонии содержат стафилококки - кокки располагаются скоплениями, грамположительны (рис.14), а серого цвета колонии - кишечные палочки, беспорядочно расположенные, грамотрицательные (рис.15);
в) остатки колоний кишечной палочки и стафилококков пересевают в пробирки с косым агаром. К пробиркам прикрепляют этикетку с указанием даты посева, группы, фамилии студента;
г) инкубация посевов в термостате при 370 в течение 18-24 часов.
3-й этап. Идентификация выделенной чистой культуры.
Ход работы:
а) макроскопическое определение роста культуры на скошенном МПА. Стафилококк на скошенном агаре растет в виде прозрачного налета золотистого или белого цвета, кишечная палочка - в виде сочного, блестящего, полупрозрачного налёта серого цвета;
б) проверка чистоты культуры. Готовят мазок, окрашивают его по Граму и просматривают под микроскопом (не менее 10 полей зрения). Во всех полях зрения чистая культура должна быть однородной морфологически и тинкториально;
в) идентификация выделенной чистой культуры бактерий проводится по биохимическим, антигенным свойствам, фагочувствительности, токсигенности (вирулентности) и по генетической структуре.
Реакция гемагглютинации (РГА)
Применяется для идентификация вирусов по гемагглютинирующей активности. Вирусы, обладающие гемагглютинирующими свойствами (имеющие гемагглютинин – гликопротеид суперкапсида), способны гемагглютинировать эритроцитов различных животных. Например, вирусы гриппа – куриных эритроцитов.
Компоненты реакции:
1) исследуемый материал – аллантоисная жидкость(гемагглютинин вируса гриппа?);
2) 5% суспензия куриных эритроцитов;
3) физиологический раствор.
Существует два способа постановки реакции: капельный способ на стекле и объемный способ в пробирке.
Капельный способ на стекле:
Опыт:1 капля аллантоисной жидкости + 1 капля 5% суспензии куриных эритроцитов.
Контроль: 1 капля физ. раствора + 1 капля 5% суспензии куриных эритроцитов. Хорошо перемешать сначала контрольную каплю, затем- опытную.
Наличие гемагглютинации (выпадение хлопьев красного цвет) в опыте при ее отсутствии в контроле (гомогенное покраснение) указывает на содержание вируса гриппа в исследуемом материале. Гемагглютинация – это склеивание эритроцитов под влиянием гемагглютинина вируса. Вид вируса гриппа (А,В,С) дифференцируют по антигенной структуре с помощью РСК, ИФА, а серотип – РТГА (практические навыки 9.7). Окончательную идентификацию также можно провести по генетической структуре (ПЦР).
Реакция фаголизиса
Реакция фаголизиса применяется для идентификации выделенной чистой культуры бактерий по фагочувствительности. Реакцию ставят в двух пробирках: №1 (опыт) и №2 (контроль). Реакция фаголизиса изучаем на примере идентификации выделенной чистой культуры S Shigella.sonnei из испражнения при подозрении на дизентерию.
| Компоненты
| Опыт
| Контроль
|
| 1. МПБ
2.Исследуемая дизентерийная культура (S.sonnei)
3. Монофаг S. sonnei
| +
+
+
| +
+
-
|
Посевы инкубируют в термостате 18-24 часов при 370 С.
При наблюдении за посевами впервые часы бульон в пробирках слегка мутнеет вследствие размножения бактерий. В дальнейшем в контрольной пробирке (без бактериофага) помутнение усиливается; в пробирке с бактериофагом через 6 часов происходит просветление в результате лизиса бактерий. Учет реакции проводятся по просветлению МПБ в результате лизируещего действия монофага на бактерии.
25 Реакция фаготипирования St . а ureus . Назначение, ингредиенты, учет реакции.
Определение фаготипа проводится с помощью специальных наборов типовых фагов и является одним из методов внутривидовой дифференциации бактерий. Реакция фаготипирования применяется с целью установления источников и путей передачи инфекции при госпитальных, кишечных заболеваниях и пищевых отравлениях.
Испытуемую суточную бульонную культуру S.aureus равномерно распределяют на поверхности подсушенного агара в чашке Петри. Дно чашки расчерчивают на 22 квадрата по числу фагов, затем капают фаги по одному в каждый квадрат. Посев инкубируют в термостате 18-24 часа при температуре 37°С.
На 2-й день проводят учёт результатов; фаготип культуры соответствует тому фагу, который вызывает её полный лизис (рис.21). Также проводится фаготипирование брюшнотифозных (44 типа) и паратифозных бактерий (15 типов), энтеропатогенных эшерихий (24 типа).
ОПРЕДЕЛЕНИЕ ОБЩЕГО МИКРОБНОГО ЧИСЛА (МЕТОД КОХА) И САНИТАРНО - ПОКАЗАТЕЛЬНЫХ МИКРОБОВ ВОЗДУХА
Для оценки санитарно-бактериологического состояния воздуха определяют следующих показателей: микробного числа воздуха (количество микробов в в 1м3 воздуха) методами осаждения по Коху и аспирации по Кротову, наличие зеленящего стрептококка путем посева воздуха на кровяной агар с добавлением генцианового фиолетового (среда Гарро), для обнаружения S. aureus – на желточно-солевой агар, для обнаружения других патогенных бактерий – соответствующие элективные питательные среды.
Определение микробного числа воздуха методом Коха проводится в 2 этапа:
1 этап. Отбор пробы воздуха. Стерильные чашки Петри с МПА открывают в месте отбора проб воздуха и выдерживают в течение 10 мин, после чего закрывают и инкубируют при 370С в течение 48 часов.
2 этап. Учет результатов. По количеству выросших колоний подсчитывают микробное число воздуха, пользуясь формулой Омелянского, в соответствии с которым считают, что на поверхность питательной среды площадью 100см2 в течение 5 мин оседает столько микроорганизмов, сколько их содержится в 10 л воздуха:
Х – количество микробов в 1м3 воздуха
X = 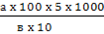 а – число колоний, выросших на чашке
а – число колоний, выросших на чашке
в – площадь чашки Петри, равная ПR 2
Метод Кротова является более точным методом определения микробного числа воздуха с помощью специального прибора. Основан на использовании щелевого аппарата конструкции Ю. А. Кротова. Прибор, смонтированный в портативном ящике, состоит из узла для отбора пробы, куда на специальную площадку помещают чашку Петри без крышки, электромотора, вентилятора и ротаметра. Вентилятор, вращаясь с частотой 4-5 тыс. об/мин, засасывает воздух, струя которого ударяется о поверхность питательной среды в чашке Петри, оставляя на ней мироорганизмы. Воздух выходит из прибора через ротаметр. Для равномерного распределения микроорганизмов на поверхности среды диск с чашкой вращается с частотой 60 об/мин. Скорость протягивания воздуха составляет 25 дм3/мин. При определении общей численности бактерий количество пропущенного воздуха должно составлять 100 дм3. Засеянные чашки вынимают из аппарата, закрывают их крышками, помещают на 24 ч в термостат при температуре 37 °С, затем вынимают и оставляют при комнатной температуре на 24 ч. Подсчитывают число выросших колоний и производят перерасчет на 1 м воздуха:
X = а/1000 • V,
где а - количество выросших на чашке колоний; V - объем пропущенного через прибор воздуха; 1000 - искомый объем воздуха, дм3.
Кроме количественной, дается качественная характеристика микрофлоры воздуха. Для этого проводят описание колоний бактерий, выросших на чашках Петри, и готовят микроскопические препараты из этих колоний. Так же проводят описание колоний бактерий
Реакция агглютинации (РА) на стекле.
РА на стекле - ориентировочная РА, наступающая в течении нескольких минут, применяется только с целью идентификации выделенной из организма больного чистой культуры бактерий по антигенной структуре.
В РА на предметном стекле, поставленной с целью идентификации возбудителя брюшного тифа по антигенной структуре участвуют 3 ингредиента:
1)выделенная чистая культура S.typhi на скошенном МПА? (корпускулярный АГ- агглютиноген);
2)диагностические видоспецифические антисыворотки с АТ-ми против S.typhi, S. paratyphi A и S. paratyphi B., полученные путем гипериммунизации кроликов соотвествующими бактериальными антигенами;
3)изотопический раствор хлорида натрия (электролит).
Паралелльно вставится три реакции на стекле:
а)1 капля физ. раствора + 1 капля диагностической сыворотки против S.typhi + бактерии со скошенного агара;
б)1 капля физ. раствора + 1 капля диагностической сыворотки против S. paratyphi A + бактерии со скошенного агара;
в)1 капля физ. раствора + 1 капля диагностической сыворотки против S. paratyphi В + бактерии со скошенного агара;
Хорошо перемешать. Наличие агглютинации (выпадение хлопьев белого цвета) указывает на присутствие соответствующего возбудителя, при отрицательной - наблюдается равномерное помутнение (рис.27). Агглютинация – это склеивание бактериальных клеток под влиянием специфических антител.
Опсоно-фагоцитарная реакция
Применяется для определения опсонинов – антител, стимулирующих фагоцитарную активность лейкоцитов, т.е. серодиагностики инфекций, например, бруцеллёза.
Усиление фагоцитоза происходит за счёт присоединения опсонинов с активными центрами (Fав – фрагмент) к детерминантам бактерий, а затем с помощью Fc – фрагментов к Fc – рецепторам фагоцитов. В нормальной сыворотке содержится небольшое количество опсонинов, которые проявляют свое действие в присутствии комплемента. В иммунной сыворотке опсонинов больше и их активность в меньшей степени зависит от комплемента.
| Компоненты
| Опыт
| Контроль
|
| Исследуемая сыворотка
Нормальная сыворотка
Суточная микробная культура (напр., стафилококковая)
Фагоциты – взвесь нейтрофилов
| +
-
+
+
| -
+
+
+
|
Инкубация при 37°С в течение 30 минут. Из каждой пробирки готовят мазки, окрашивают по Романовскому – Гимзе и считают под микроскопом количество микробов в 100 и более нейтрофилах, т.е. определяют фагоцитарный показатель.
Фагоцитарный показатель – количество микробов, поглощенных одним нейтрофилом.
Опсонический индекс – фагоцитарный показатель иммунной (исследуемой) сыворотки / фагоцитарный показатель нормальной сыворотки.
Чем выше опсонический индекс (должен быть > 1), тем выше иммунитет.
Реакция торможения гемагглютинации (РТГА) (определение серотипа вируса гриппа А)
РТГА относится к реакциям нейтрализации in vitro.
Механизм. У некоторых вирусов (например, вируса гриппа) есть гемагглютинин, вызывающий агглютинацию эритроцитов различных животных в зависимости от вида вируса. При наличии в сыворотке антител – антигемагглютининов наблюдается ингибированные гемагглютинирующей активности вирусов (рис.32).
Компоненты.
1) исследуемый материал – аллантоисная жидкость куриного эмбриона;
2) диагностические противогриппозные сыворотки с антителами против серотипов вируса гриппа А: А(Н1N1), А(Н2N2), А(Н3N2 и др.;
3) 3,5% взвесь куриных эритроцитов – индикатор реакции;
4) физиологический раствор.
Реакция ставится на стекле капельным способом. На стекло наносят по 1 капле диагностических сывороток и исследуемого материала, перемешивают, затем добавляют 1 каплю взвеси эритроцитов. При положительной реакции наблюдается гомогенное покраснение, а при отрицательной – выпадение хлопьев красного цвета (гемагглютинация).
Реакции непрямой иммунофлюоресценции (РИФ) (экспресс-диагностика и серологическая диагностика гриппа А)
В настоящее время широко применяются серологические реакции (СР), в которых участвуют меченые АГ или АТ. К ним относятся реакция иммунофлюоресценции, радиоиммунный и иммуноферментный методы, реакция иммуноблотинга, проточная цитометрия и электронная микроскопия.
Они применяются:
1) для серодиагностики инфекционных заболеваний, т. е. для выявления АТ с помощью набора известных конъюгированных (химически соединённых) с различными метками (ферментами, флюорохромными красителями), антигенов;
2) для определения микроорганизма или его серовара с помощью стандартных меченных диагностических антител (экспресс-диагностика).
Готовят диагностические сыворотки иммунизацией животных соответствующим АГ, затем выделяют иммуноглобулины и конъюгируют их со светящимися красителями (флюорохромами), ферментами, радиоизотопами.
Диагностических моноклональных антител получают с помощью гибридных клеток, образованных путем слияния иммунного В-лимфоцита с миеломной клеткой. Гибридомы способны быстро размножаться in vitro в культуре клеток и продуцировать при этом иммуноглобулин, характерный для взятого В-лимфоцита.
Меченые СР по специфичности не уступают другим СР, а по своей чувствительности они превосходят все СР.
Иммуноферментный анализ (ИФА): конкуретный способ (определение HBs -АГ вируса гепатита В) и непрямой способ (серологическая диагностика ВИЧ - инфекции)
Иммуноферментный анализ (ИФА)
В качестве метки используются ферменты: пероксидаза, щелочная фосфатаза и др.
Индикатором реакции является способность ферментов вызывать цветные реакции при действии на соответствующий субстрат. Например, субстратом для пероксидазы является раствор ортофенилдиамина (ОФД) или тетраметилбензидин (ТМБ).
Наиболее широко применяется твердофазный ИФА (рис.35), непрямой и конкурентные способы (рис.36).
Результаты ИФА можно оценить визуально и измерением оптической плотности на спектрофотометре (ИФА – анализаторе).
К преимуществам ИФА следует отнести:
- простота методов оценки реакции;
- стабильность конъюгатов;
- легко поддаётся автоматизации.
В качестве примеров приводятся следующие типы ИФА:
а) конкурентный тип(определение HBs -АГ вируса гепатита В)
Предназначен для выявления поверхностного антигена вируса гепатита В (HBs Ag) в сыворотках и плазме крови при диагностики вирусного гепатита В и определения носительства HBs Ag.
Компоненты:
1) исследуемый материал – сыворотка или плазма крови;
2) антитела к HBs Ag, адсорбированные на поверхности лунки полистиролого микропланшета;
3) конъюгат – мышиные моноклональные антитела к HBs Ag, меченые пероксидазой;
4) ортофенилендиамин (ОФД) – субстрат;
5) фосфатно – солевой буфер;
6) контрольные сыворотки:
- положительная (сыворотка с HBs Ag);
- отрицательная (сыворотка без HBs Ag).
Ход работы:
1. Внесение контрольных и исследуемых сывороток.
2. Инкубация 1 час при 37°С.
3. Отмывание лунок.
4. Внесение конъюгата.
5. Инкубация 1 час при 37°С.
6. Отмывание лунок.
7. Внесение ОФД. При наличии HBs Ag раствор в лунках желтеет.
8. Учёт ИФА проводят по оптической плотности с помощью фотометра. Степень оптической плотности будет обратно пропорциональной концентрации исследуемых HBs Ag.
Реакция протекает в три фазы:
1. HBs Ag исследуемой сыворотки (плазмы) связывается с гомологичными АТ, адсорбированными на поверхности лунки. Образуется ИК АГ-АТ. (HBs Ag – anti HBs АТ).
2. Антитела к HBs Ag, меченые пероксидазой связываются с оставшимися свободными детерминантоми HBs Ag комплекса АГ-АТ. Образуется комплекс АТ-АГ-меченые АТ (anti HBs АТ - HBs Ag - anti HBs АТ, меченые пероксидазой).
3. ОФД взаимодействуют с пероксидазой комплекса АТ-АГ-АТ и происходит жёлтое окрашивание.
в) непрямой тип(серологическая диагностика ВИЧ - инфекции)
Является основной тестовой реакцией диагностики ВИЧ – инфекции.
Цель: Серологическая диагностика ВИЧ-инфекции – обнаружение антител к антигенам ВИЧ.
Компоненты:
1) исследуемый материал – сыворотка крови (АТ к АГ-м ВИЧ);
2) синтетические пептиды имитирующие 2-х антигенов ВИЧ: gp 120 и gр 41, адсорбированные на поверхности полистироловой лунки;
3) антиглобулиновая сыворотка, меченная пероксидазой, полученная путём иммунизации кроликов глобулинами человека (АТ к АТ);
4) ОФД;
5) фосфатно-солевой буфер;
6) контрольные сыворотки:
- положительная;
- отрицательная.
Ход работы:
1. Внесение контрольных и исследуемых сывороток.
2. Инкубация 30 минут при 37°С.
3. Отмывание.
4. Внесение антиглобулиновой сыворотки меченой ферментом.
5. Инкубация 30 минут при 37°С.
6. Отмывание.
7. Внесение ОФД.
Реакция протекает в 3 фазы:
1. Антитела к ВИЧ исследуемой сыворотки связываются с гомологичными антигенами (gр 120 и gр 41), и на поверхности сорбента образуется ИК АГ-АТ ( АГ ВИЧ - АТ к ВИЧ).
2. Образование ИК АГ-АТ-АТ, меченое пероксидазой, т.к. АТ исследуемой сыворотки являются антигенами для антиглобулиновой сыворотки.
3. ОФД взаимодействует с пероксидазой комплекса АГ-АТ-АТ, и происходит жёлтое окрашивание раствора лунки. Степень ферментативной активности прямо пропорциональна концентрации исследуемых АТ.
Основные правила поведения в бактериологической лаборатории
1.В помещении лаборатории нельзя входить без специальной одежды: халата, сменной обуви.
2.В лабораторию нельзя вносить посторонние вещи, запрещается курить и приносить пищу.
3.При распаковывании заразного материала необходимо соблюдать осторожность: пробирки снаружи обтирать дезинфицирующим раствором; переливание жидкостей, содержащих патогенные микробы, производят над сосудом, содержащим дезинфицирующий раствор.
4.Если разбилась посуда, содержащая заразный материал (пробирки, чашка Петри и др.), немедленно производится обеззараживание предметов, одежды, стола и помещения.
5.После окончания работы дезинфицируют руки и поверхность рабочего стола.
6.Музейные культуры микробов ставят на хранение в холодильник, закрывают и опечатывают
7.Работники лаборатории подлежат обязательной вакцинации против тех инфекционных болезней, с возбудителями которых они работают. На кафедре микробиологии используются материалы, содержащие возбудителей III-IV групп, после разрешения председателя режимной комиссии Республиканской СЭС.




 Рис.11.
Рис.11.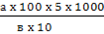 а – число колоний, выросших на чашке
а – число колоний, выросших на чашке


