Принципы терапии инфекционных больных базируются на комплексе этиологически и патогенетически обоснованного лечения с учетом индивидуальных особенностей состояния организма больного, тяжести и фазы болезни. При этом принимают во внимание все взаимосвязанные факторы, участвующие в развитии инфекционного заболевания. Используют различные лечебные средства, действие которых направлено на снижение активности возбудителя и нейтрализацию его токсинов, на повышение защитных сил организма в борьбе с инфекцией и др.
В отечественной литературе последних лет в нашей стране терапия инфекционных больных подробно освещена в монографии, написанной сотрудниками Военно‑медицинской академии им. С. М. Кирова «Избранные вопросы терапии инфекционных больных» (СПб., 2005) под общей редакцией Ю. В. Лобзина.
Режим является основой для осуществления лечебно‑восстановительных мероприятий. Режим представляет собой научно обоснованную регламентацию различных видов деятельности и отдыха больного с использованием разнообразных средств лечебного, восстановительного, профессионального и культурно‑воспитательного воздействия. Он определяет во времени частоту, интенсивность, продолжительность и чередование лечебных процедур, приемов пищи, культурно‑массовых и других мероприятий. Основным требованием при выборе и назначении режима является щажение динамического стереотипа, создание оптимальных условий для лечения и отдыха (например, соответствующие режим и диета, направленные на снижение нагрузки на дезинтоксикационную функцию печени при остром вирусном гепатите).
Диета. Питание при инфекционных заболеваниях является одной из составляющих частей комплексной терапии. Современная диетотерапия базируется на патогенетических принципах и направлена на коррекцию нарушенных функций организма. Существующие варианты лечебной диеты учитывают наличие у большинства больных острыми формами заболеваний интоксикации организма, лихорадки, изменения функций ряда органов и систем, изменений обмена веществ (водно‑электролитного, белкового, витаминного). Правильно подобранная диета восполняет дефицит питательных веществ и предоставляет достаточное энергетическое обеспечение организма, способствуя эффективности медикаментозной терапии.
В нашей стране принята система диет, обеспечивающая индивидуализацию лечебного питания. Назначается одна из наиболее подходящих диет с возможной коррекцией путем добавления или исключения отдельных продуктов и блюд.
Одна из составляющих диеты инфекционного больного – адекватное восполнение водного баланса, главным образом за счет питья, так как для клинической картины острых форм инфекционных болезней характерны значительные потери жидкости. Помимо восполнения водного баланса потребление жидкости – это компонент комплексной дезинтоксикационной терапии. Суточная потребность организма взрослого человека в воде составляет в среднем 2300 – 2700 мл.
Этиотропная терапия, т. е. воздействие на возбудителя инфекционного процесса, – основной компонент комплексного лечения больных. Ее принципы базируются на:
– уничтожении возбудителя, для чего используют антибактериальные, противовирусные, антипаразитарные лекарственные средства;
– блокировании возбудителя путем введения специфических сывороток и иммуноглобулинов (иммунотерапия);
– выведении из организма эндогенных и экзогенных токсинов, чужеродных белков, патогенетических продуктов и субстратов, агрессивных ферментов (эфферентная терапия), для чего используют плазмаферез, плазмосорбцию, гемосорбцию, лимфоцитоферез, ультрафиолетовое и лазерное облучение крови, аэроионотерапию, озонотерапию и особенно часто в практике инфекционного стационара энтеросорбцию.
Антибактериальные средства по происхождению включают:
– антибиотики – препараты природного происхождения, продуцируемые микроорганизмами (или их химические производные);
– химиотерапевтические средства – антимикробные и антипаразитарные химические вещества (химический синтез).
При лечении инфекционных больных важно учитывать характер действия антибактериального средства на возбудителя, так как эти лекарственные средства подразделяются на:
– бактерицидные (пенициллины, цефалоспорины, аминогликозиды и др.);
– бактериостатические (тетрациклины, хлорамфеникол и др.);
– «либо‑либо» – в зависимости от вида микроорганизма и концентрации антибиотика (макролиды, линкозамиды, гликопептиды и др.), по мере изучения препаратов этот вариант оказывается самым распространенным.
Одни лекарственные средства имеют узкий спектр антимикробного действия (например, пенициллин – на грамположительные бактерии и кокки, полимиксин – на грамотрицательные бактерии), другие – широкий спектр действия (аминогликозиды, тетрациклины, карбапенемы, аминопенициллины – на грамположительные и грамотрицательные бактерии), однако не существует препаратов с равной активностью в отношении всех возбудителей, поэтому желателен выбор препарата с известной избирательной активностью. Нередко комбинация препаратов с узким спектром может быть эффективнее одного препарата широкого спектра противомикробного действия.
По химической структуре антимикробные препараты подразделяются на ряд групп:
а) антибиотики: бета‑лактамные антибиотики (пенициллины, карбоксипенициллины), карбапенемы, цефалоспорины, монобактамы, аминоглюкозиды, макролиды, кетолиды, линкозамиды, тетрациклины, гликопептиды, рифампицины, полимиксины, оксазолидиноны, ингибиторы ДНК‑гиразы (хинолины, фторхинолоны);
б) сульфаниламиды;
в) нитрофураны;
г) производные хиноксалина;
д) противотуберкулезные препараты;
е) антимикотики и др.
Выбор того или иного антимикробного препарата определяется возбудителем инфекционного заболевания. Так, оксациллин, ампициллин, карбенициллин высокоэффективны в отношении грамположительных (стрептококки, стафилококки, пневмококки) и грамотрицательных (гонококки, менингококки) кокков, сибиреязвенной палочки, клостридий, возбудителя дифтерии, трепонем, лептоспир. Цефалоспорины цефоперазон и цефтазидим применяются при госпитальных инфекциях, так как они эффективны против синегнойной палочки. Левомицетин эффективен в отношении многих грамотрицательных и грамположительных бактерий, риккетсий и спирохет, поэтому широко используется в инфекционной практике. Тетрациклины и рифампицин обладают широким антибактериальным спектром действия, подавляют рост большинства грамположительных и грамотрицательных бактерий, риккетсий, хламидий. Аминогликозиды эффективны против большинства грамположительных и грамотрицательных бактерий, а также против микроорганизмов, устойчивых к пенициллину, левомицетину, тетрациклинам.
В клинической практике широкое распространение получили производные хинолона (офлоксацин, ципрофлоксацин, ципрофлюксазин и др.); они и сейчас остаются препаратами резерва и применяются при особо тяжелых формах инфекций, вызванных кишечными бактериями, а также хламидиями, микоплазмами.
До назначения антибактериального препарата производят забор материала (кровь, гной из миндалин, мокрота и т. д.) для выделения возбудителя болезни и определения его чувствительности к антибиотикам. Больным в тяжелом состоянии антибактериальная терапия назначается неотложно, при неуточненной этиологии заболевания используют препараты с широким спектром действия, в некоторых случаях – комбинацию препаратов. Больным с иммунодефицитом предпочтительнее назначать препараты бактерицидного действия: бета‑лактамы, аминогликозиды, ванкомицин, фосфомицин, фторхинолоны и др. (Лобзин Ю. В., 2005; 2011).
Сегодня на смену многим природным антибиотикам приходят препараты третьего и четвертого поколений, представленные главным образом полусинтетическими пенициллинами, цефалоспоринами, аминогликозидами, тетрациклинами, рифампицинами, которые по сравнению с природными антибиотиками обладают многими преимуществами, так как характеризуются кислотно– и ферментоустойчивостью, расширенным спектром действия, улучшенным распределением в тканях и жидкостях организма, измененным механизмом действия на бактериальную клетку, меньшим числом побочных эффектов (Лобзин Ю. В., 2011). Лечебный эффект от применения бактерицидных антибактериальных препаратов наступает через 1 – 2 дня, бактериостатических – через 3 – 4 дня.
Комбинированное использование различных антибактериальных препаратов часто ведет к повышению терапевтической эффективности, но нередко увеличивает частоту и тяжесть побочных реакций.
Вирусные инфекции приобретают все большую актуальность: по оценкам экспертов около миллиарда жителей планеты страдает «неизлечимыми» вирусными инфекциями, такими как вирусный гепатит В и С, ВИЧ‑инфекция и др. Ежегодные потери человеческих жизней от ОРВИ в три раза превосходят потери от ВИЧ/СПИДа. Хотя достижения вирусологии в ХХ в. огромны (удалось ликвидировать оспу, снизить до минимальных показателей заболеваемость полиомиелитом, добиться резкого снижения заболеваемости кори и других вирусных инфекций), кардинальных решений в вопросах диагностики и особенно лечения большинства вирусных инфекций не достигнуто. И все это несмотря на то, что мировым сообществом расходуется на решение актуальных проблем вирусологии триллионы долларов.
Противовирусные лекарственные средства для терапии и профилактики вирусных болезней используются сравнительно недавно. При разработке противовирусных лекарственных препаратов обязательно учитывается тот факт, что для своей репликации вирус использует метаболический аппарат клеткихозяина и свои ферментные системы. Определенные стадии процесса репликации, являющиеся уникальными для каждого вируса, можно использовать как специфические мишени для противовирусной терапии. Каждый лекарственный препарат должен отвечать определенным требованиям: а) он должен обладать высокой степенью избирательности, что обусловлено биологическими свойствами вирусов; б) должен быть минимально токсичен для незараженных клеток организма; в) не должен подавлять иммунную систему и неспецифические факторы защиты организма; г) не обладать тератогенным и онкогенным эффектами.
Учитывая значимость вирусных инфекций, среди наиболее интенсивно разрабатываемых в последние годы лекарственных средств антивирусные препараты выдвинулись на одно из первых мест. Поэтому на различных этапах доклинического и клинического изучения постоянно находятся тысячи соединений, обладающих антивирусной активностью, а фармацевтический рынок ежегодно пополняется десятками новых лекарственных препаратов. Наиболее интенсивно разрабатываются лекарственные средства с противовирусной активностью для лечения ВИЧ‑инфекции, вирусного гепатита В и С, гриппа и других острых респираторных вирусных инфекций.
По химическому составу и клиническому эффекту имеющиеся антивирусные препараты подразделяются на три большие группы:
– химиопрепараты;
– интерфероны и их индукторы;
– иммуномодуляторы.
Противовирусные препараты включают следующие группы лекарственных средств:
1. Препараты прямого действия:
– нуклеозидные и нуклеотидные;
– производные адамантана;
– синтетические аминокислоты;
– ингибиторы протеазы;
– нуклеозидные ингибиторы обратной транскриптазы;
– ненуклеозидные ингибиторы обратной транскриптазы;
– ингибиторы нейраминидазы;
– производные тиосемикарбазонов.
2. Интерфероны:
– α‑интерфероны;
– β‑интерфероны;
– γ‑интерфероны.
3. Индукторы интерферонов:
– синтетические низкомолекулярные соединения;
– азотистые основания;
– двуспиральные РНК;
– низкомолекулярные полифенолы.
4. Прочие:
– инозин пранобекс;
– амизон;
– арбидол;
– протефлазид;
– флавозид;
– энгистол.
Приведем примеры наиболее употребляемых лекарственных средств из группы химиопрепаратов, обладающих противовирусной активностью, которые применяются при наиболее распространенных вирусных инфекциях:
– грипп – адепремин, амантадин, арбидол, ремантадин;
– простой герпес – ацикловир (зовиракс), триаптен (фоскарнет), теброфен, валацикловир (валтрекс), видарабин;
– опоясывающий герпес – видарабин;
– цитомегаловирусная инфекция – ганцикловир;
– гепатит В – интерферон (пегилированный интерферон), ламивудин, фоскарнет;
– гепатит С – интерфероны альфа (пегилированный интерферон альфа), рибавирин;
– ВИЧ‑инфекция – ингибиторы обратной транскриптазы (абакавир, азидотимидин, зальцитабин, диданозин, ставудин, ламивудин, тенофовир), ненуклеозидные ингибиторы обратной транскриптазы (невирапин, ифавиренц), ингибиторы протеазы (ампренавир, индинавир, калетра, нелфинавир, саквинавир), ингибиторы слияния (энфувиртид).
Так как одними противовирусными препаратами сложно справиться с вирусными инфекциями, в их терапии определенное место занимают иммуноактивные средства: иммуномодуляторы, иммунокорректоры, иммуностимуляторы, иммунодепрессанты. Иммуномодуляторы в терапевтических дозах восстанавливают функции иммунной системы, иммунокорректоры нормализуют конкретное нарушенное то или иное звено иммунной системы (компоненты Т‑клеточного и В‑клеточного иммунитета, фагоцитоза, комплемента), иммуностимуляторы стимулируют иммунные процессы, усиливая иммунный ответ, иммунодепрессанты – лекарственные препараты, способные угнетать иммунные процессы, подавляя иммунный ответ.
Среди препаратов, влияющих на иммунную систему, применяют цитокины, иммуноглобулины, тимические факторы: миелопид, тактивин и другие лекарственные средства отечественного производства.
Патогенетическая терапия. Принципы патогенетической терапии разработаны в последние годы достаточно полно и основаны на результатах детального изучения важнейших характеристик гомеостаза и закономерностей его нарушения при инфекционных болезнях. Патогенетическая терапия проводится с учетом показателей кислотно‑основного состояния, минерального и водного обмена, реологических свойств крови, иммунного статуса организма, расстройств микроциркуляции в органах и тканях и т. д.
Элементами патогенетической терапии являются:
– заместительная терапия: восстановление ОЦК, электролитов, факторов свертывания крови и т. д.;
– корригирующая терапия: иммунокорригирующая терапия (в России примерно у 40 % взрослого населения выявляются различные иммунопатологические состояния, в силу чего идет медленное формирование иммунного ответа, имеет место неполноценность иммунного ответа, а иммунологический ответ часто сопровождается активацией аутоиммунных процессов);
– регуляторное воздействие, а именно попытка управления патологическим процессом при помощи современных технологий или применения некоторых препаратов, способных разнонаправленно влиять на реакции организма (оксигенобаротерапия, озонотерапия, некоторые варианты эфферентной терапии, иммуносорбция, фототерапия, новые методики вакцинотерапии и др.; на клеточном и молекулярном уровне: введение простагландинов, циклических нуклеотидов, регуляторных пептидов, интерферонов и их индукторов, интерлейкинов и антител к ним, тиопоэтинов);
– блокирование первичных патобиохимических реакций, катализируемых токсинами: токсические эффекты бактериальных ядов, обусловленные АДФ‑рибозилированием регуляторных и функциональных белковых образований, могут быть в определенной степени предотвращены назначением ингибиторов АДФрибозилирования (никотинамид и др.).
Среди препаратов патогенетической направленности первое место занимают дезинтоксикационные и корригирующие средства в форме коллоидных и кристаллоидных растворов. К коллоидным относятся растворы поливинилового спирта (полидез, поливинол), поливинилпирролидона (гемодез, гемовинил, перистон, неокомпенсан), частично гидролизованного декстрана (полиглюкин, реополиглюкин, зарубежные макродекс, реомакродекс), а также желатиноль, альбумин, протеины и т. д. Кроме внутривенных кристаллоидных препаратов, большое распространение получили оральные полиионные растворы, предназначенные для дезинтоксикации, а также (в первую очередь) для регидратации и реминерализации: оралит, регидрон, цитроглюкосолан.
В последние годы широкое применение в клинической медицине, в том числе в лечении инфекционных больных с выраженным интоксикационным синдромом, находят энтеросорбенты. В особо тяжелых случаях (вирусный гепатит, лептоспироз, менингококковая инфекция, сепсис и т. д.) в режиме интенсивной терапии и реанимации применяют и другие методы искусственного внепочечного очищения организма от токсинов (диффузионные, конвекционные, адсорбционные).
Эфферентная терапия. Трудно переоценить наиболее важное достижение ХХ в. – антибиотикотерапию (ученые разработали около двухсот различных антибактериальных средств). Сегодня антибиотики являются препаратами, наиболее широко используемыми в клинической практике для лечения больных различными инфекционными болезнями. Но антибиотики не эффективны против болезней, обусловленных вирусами, они не действуют также на таких возбудителей как грибы (дрожжеподобные грибы рода кандида), простейшие (амебы, лямблии), глисты. Повсеместно растет удельный вес бактерий, устойчивых к антибиотикам (если на разработку нового антибактериального препарата обычно необходимо потратить не менее 10 – 15 лет и сотни миллионов долларов, то возбудители успевают выработать резистентность к новому препарату всего за несколько лет).
Во многих ситуациях при бактериальных инфекциях не меньшее значение имеет патогенетическая терапия, а иногда она является ведущей в терапии больных, особенно с выраженным токсикозом. Особо важное значение она имеет при явлениях эндотоксикоза, характерного для патогенеза широко распространенных в мире диарейных заболеваний. При этом современные методы лечения, направленные на нейтрализацию действия эндотоксина, малоэффективны. В этих условиях важную роль в комплексном лечении больных приобретает эфферентная терапия.
Эфферентная терапия включает гемодиализ, перитонеальный диализ, плазмаферез, гемосорбцию, энтеросорбцию. Все лечебные мероприятия направлены на прекращение действия токсинов и их элиминацию из организма. В основе современных методов эфферентной терапии лежат шесть различных технологий: сорбционная, мембранная, центрифужная, преципитационная, электромагнитная и электрохимическая.
В условиях инфекционного стационара наиболее широко используют энтеросорбцию – метод лечения различных заболеваний, основанный на способности энтеросорбентов связывать и выводить из организма различные экзогенные вещества, микроорганизмы и их токсины, эндогенные промежуточные и конечныe продукты обмена, способные накапливаться или проникать в полость желудочно‑кишечного тракта в ходе течения различных заболеваний.
Механизмы действия энтеросорбентов делятся на 4 группы:
– сорбция в кишечнике энтеросорбентами экзотоксинов, ксенобиотиков, бактерий, бактериальных токсинов и других токсических продуктов, образующихся в кишечнике, таких как фенол, скатол, ароматические аминокислоты и др., а также потенциальных аллергенов; энтеросорбенты используют при лечении больных оcтрыми и хроническими отравлениями, инфекционными заболеваниями желудочно‑кишечного тракта, предупреждении проникновения в организм пищевых аллергенов, для связывания и выведения пищевого холестерина, желчных кислот, солей тяжелых металлов, радионуклидов, алкоголя;
– контактное воздействие препаратов на структуры желудочно‑кишечного тракта. Таким путем воздействуют на насыщенность слизистой оболочки различными ферментами, на коррекцию содержания в тканях кишечника ряда биологически активных веществ и сопровождающие их изменения функциональной активности желудочно‑кишечного тракта; чаще эти методы используют при лечении больных с нарушениями пищеварения неинфекционной этиологии, хронических заболеваний желудочно‑кишечного тракта, сопровождающихся повышенной функциональной активностью;
– усиление выведения в полость кишечника эндотоксинов из внутренних сред организма, обычно их используют при недостаточной эффективности систем элиминации и метаболизма эндотоксинов, что в той или иной мере имеет место при всех острых и хронических воспалительных процессах вне зависимости от локализации основного очага;
– усиление метаболизма и выведения эндотоксинов естественными органами детоксикации.
Пероральный путь введения энтеросорбентов наиболее эффективен, так как процесс сорбции начинается в желудке и завершается в тонкой кишке.
Используемые в настоящее время энтеросорбенты можно классифицировать в следующие группы: а) углеродные адсорбенты на основе активированного угля (карболен, карбоктин, гастросорб), гранулированных углей и углеволокнистых материалов (ваулен, актилен, «Днепр»); б) ионообменные материалы или смолы (кайексилит, холестирамин); в) энтеросорбенты на основе лигнина (полифепан, лигносорб); г) производные поливинилпирролидона (энтеродез, энтеросорб); д) другие (белая глина, алюминия гидроокись, алмагель, гастал, фосфалюгель, сукральфат, силикагели, цеолиты); е) природные: отруби злаковых, целлюлоза, альгинаты. Наиболее часто применяют углеродные сорбенты и энтеросорбенты на основе поливинилпирролидона, хотя они имеют малую сорбционную емкость и побочные эффекты при применении в течение длительного времени. Менее востребованы другие сорбенты в силу различных причин, среди которых недооценка врачами энтеросорбции, незнание достоинств и недостатков тех или иных сорбентов при конкретной патологии. Ионообменные материалы применяются в некоторых областях медицины, но они имеют слабо выраженный терапевтический эффект.
В группу «другие» включены сорбенты, применяемые при заболеваниях желудочно‑кишечного тракта, эффекты которых обусловлены их вязкостью, а не связывающей способностью.
В инфекционном стационаре при лечении острых инфекционных болезней наибольшее распространение получила энтеросорбция. В практике инфекциониста наиболее часто энтеросорбцию используют при острых кишечных инфекциях (ОКИ), которые в структуре инфекционной заболеваемости населения занимают второе место после острых респираторно‑вирусных инфекций. В России ежегодно регистрируется около 700 тыс. больных ОКИ. По данным ВОЗ (2000), в мире на начало нового века в год умерло от диарейных заболеваний 2,2 млн человек, из них 1,7 млн – дети в возрасте до 5 лет.
ОКИ (диарейные болезни) характеризуются отсутствием сезонности и возрастной избирательности заболеваемости, развитием нестойкого, кратковременного видоспецифического иммунитета, а это определяет повторное развитие инфекционного процесса, вызванного другим возбудителем в течение ограниченного времени. К тому же на современном этапе ОКИ характеризуются утяжелением клинического течения отдельных нозологических форм, развитием резистентности возбудителей к традиционно применяемым этиотропным препаратам в связи с широким и нередко бесконтрольным их применением. В связи с этими обстоятельствами в последние годы появились работы, в которых обосновывается целесообразность отказа в ряде случаев от традиционно применяемых антибактериальных средств при лечении больных и необходимости усиления патогенетической терапии. С этой точки зрения несомненный интерес представляют энтеросорбенты, которые, как показано многочисленными клиническими наблюдениями, оказывают дезинтоксикационный эффект и способствуют сокращению продолжительности диареи. Энтеросорбция при этих заболеваниях является этиологическим и патогенетическим способом терапии. Объясняется это тем, что сорбенты поглощают из многокомпонентных растворов эндо– и экзотоксины, а вещества с макро– и мезопорами, кроме того, могут фиксировать на своей поверхности возбудителей бактериальной и вирусной природы, т. е. оказывать этиотропный эффект. Помимо того, практически не изменяя состав нормальной кишечной микрофлоры, энтеросорбенты связывают токсические продукты, образующиеся в норме в кишечнике. Патогенетически наиболее существен детоксикационный эффект энтеросорбции, связанный с поглощением токсических продуктов, не только образующихся в кишечнике, но и секретируемых с пищеварительными соками.
Таким образом, эфферентная терапия – самостоятельная область медицины, которая постоянно развивается, предлагая новые, все более эффективные методы и препараты, которые выводят из организма многие ненужные и вредные вещества. Применяемые при эфферентной терапии сорбенты – препараты медицинского назначения, обладающие высокой сорбционной емкостью, способны связывать экзо– и эндогенные вещества путем ад– и абсорбции, ионообмена или комплексообразования. В странах СНГ наибольшее распространение получила энтеросорбция, для чего продается и применяется большое количество различных энтеросорбентов на основе как древесины, так и химически синтезированных материалов.
Методы интенсивной терапии и реанимации. Характер и объем неотложной помощи во многом зависит от характера патологического процесса. В инфекционном стационаре наиболее часто встречается ряд клинико‑патогенетических синдромов, требующих интенсивной терапии:
– инфекционно‑токсический шок;
– инфекционно‑токсическая энцефалопатия;
– церебральная гипертензия;
– дегидратационный синдром;
– острая дыхательная недостаточность;
– острая сердечная недостаточность;
– острая печеночная недостаточность;
– острая почечная недостаточность;
– синдром ДВС;
– анафилактический шок;
– токсические реакции на лекарства;
– хирургические осложнения.
Лечебная помощь таким больным осуществляется в отделениях (ОИТ) или палатах интенсивной терапии (первое в стране отделение интенсивной терапии было создано кафедрой инфекционных болезней Ленинградского медицинского института им. акад. И. П. Павлова на базе Инфекционной больницы им. С. П. Боткина). При оснащении ОИТ медицинской аппаратурой, инструментарием и другими необходимыми предметами учтено превалирование сердечнососудистой и дыхательной недостаточности, обусловленных инфекционно‑токсическим шоком. Известно, что этот синдром требует в первую очередь стабилизации гемодинамических показателей, сердечной деятельности и активной детоксикации. Для выполнения этих мероприятий в палате постоянно имеется достаточное количество белковых, коллоидных (декстраны, поливинилпирролидон, альбумин и др.) и кристаллоидных (изотонические растворы хлорида натрия и глюкозы, декстрозы и другие) препаратов, сердечных гликозидов, глюкокортикостероидов, наборов для катетеризации магистральных сосудов, капельниц.
Для борьбы с дыхательной недостаточностью обеспечивается возможность проведения следующих мероприятий:
– восстановление проходимости верхних дыхательных путей;
– кислородная терапия;
– искусственная вентиляция легких.
В оснащение ОИТ входит также все необходимое для интубации трахеи, наложения трахеостомы, устранения пневмоторакса. Имеются бронхолитические препараты и пеногасители. Необходимая помощь оказывается и при наличии психомоторного возбуждения, судорог, отека головного мозга. Для обеспечения борьбы с этими грозными осложнениями имеются нейроплегические средства, гипнотики, атарактики, осмо– и салуретики. Обязательны для этой палаты приспособления для промывания желудка и очищения кишечника.
Главной задачей отделения реанимации и интенсивной терапии является неспецифическое лечение опасных нарушений жизненно важных физиологических систем и органов. Для выполнения этой задачи требуется:
1. Контроль параметров, наиболее полно характеризующих деятельность основных систем и органов.
2. Интенсивная терапия грозных синдромов на фоне этиотропного лечения:
– токсико‑инфекционный шок;
– сердечно‑сосудистая недостаточность;
– дыхательная недостаточность;
– кишечные кровотечения (консервативное лечение).
3. Хирургические вмешательства при осложненном течении болезни: прободение язв, кишечные кровотечения, абсцессы инфекционной природы.
4. Активная детоксикация (гемо– и лимфосорбция), гипербарическая оксигенация.
5. Реанимация больных при асистолии, коматозных состояниях и т. д.
Эффективность интенсивной терапии определяется не только лечебными мероприятиями, но и интенсивным наблюдением за больным. Интенсивное наблюдение состоит в непрерывном фиксировании физиологических параметров, характеризующих течение заболевания. Этим целям служат мониторные установки и приборы, регистрирующие пульс, дыхание, артериальное давление, ЭЭГ, ЭКГ и другие показатели состояния больного. В структуру отделения интенсивной терапии инфекционного стационара включается круглосуточно работающая экспресс‑лаборатория, в которой проводится определение показателей водно‑электролитного обмена, кислотно‑основного состояния, свертывающей системы крови и других тестов, позволяющих оценить состояние больного.
Неотложные состояния при острых инфекционных заболеваниях связаны с развитием или угрозой развития инфекционно‑токсического шока, гиповолемического шока, острой дыхательной недостаточности, полиорганной недостаточности и обострением течения сопутствующих заболеваний.
Осложнения, возникающие при терапии больных. Современная терапия, как правило, носит комплексный характер, включая лекарственные средства разных групп без соблюдения их взаимодействия. По мнению американских специалистов, одновременное назначение нескольких лекарственных средств – это «ядовитый коктейль», а их побочные эффекты, соединившись, действуют иногда посильнее любой болезни. Многокомпонентностью лекарственных препаратов особенно «грешили» в прошлые столетия. Знаменитый врач древности Клавдий Гален (130 – 200 гг. н. э.) описывает рецепт лекарства, которое включает 63 ингредиента. Во французской же фармакопее XVI – XVII в. в териаку входит 71 ингредиент. Очень часто в нее включали все то, что не могло быть использовано в самостоятельном виде. Сохранилось предание, что один французский аптекарь говорил Клоду Бернару, будущему основоположнику физиологии, в то время проходившему практику в аптеке: «Не выбрасывайте это, мсье Клод, пойдет для териаки». Из фармакопеи Франции териака исчезла в 1788 г., причем ее исключение сопровождалось следующим комментарием: «Занимавшая столь долго и столь большое место в фармации и терапии, териака отныне покидает арену истории и переходит в область легенд». Подходы к терапии в Англии в викторианский период описывает Т. К. Олбатт в 1913 г. Будучи уже в возрасте 77 лет он писал: «Когда я начинал практиковать, было в обычае ко дням консультаций готовить письменный стол, перья, чернильницы для выписки рецептов – этих монументальных произведений. Для каждого симптома назначали особый медикамент и несколько добавочных для заболевания в целом. Предписание торжественно утверждалось и подписывалось двумя врачами и более; чем многословнее был рецепт, тем большее уважение к себе он внушал родственникам и друзьям заболевшего, которые смотрели на рецепт как на инструмент выздоровления. Если лекарства не давали ожидаемого результата, это значило, что врач консультирующий и врач лечащий не нашли нужного состава; если же, наоборот, успех был налицо, рецепт объявляли ценнейшим документом, как банковский билет».
Многокомпонентные лекарственные препараты широко используются и в настоящее время, но в отличие от прошлого при комбинации лекарств научно обосновывается их совместимость, влияние друг на друга, возможные химические воздействия и оправданность сочетанного введения.
За последние полвека появилось около 90 % всех существующих медикаментов, количество которых исчисляется десятками тысяч, что позволяет говорить о «фармацевтическом взрыве». В этих условиях особенно актуальной становится проблема оценки их положительного и отрицательного эффекта. Ибо, как правильно отмечают многие клиницисты, мы живем в период все более безопасной хирургии и все более опасной лекарственной терапии.
Учитывая значимость осложнений медикаментозной терапии, в 1967 г. был создан Международный центр по контролю побочного действия лекарственных веществ, координирующий работу национальных центров. Тем не менее медикаментозные осложнения играют существенную роль в негативных проявлениях терапии больных. При этом регистрация их существенно занижена и не оценивается в должной мере. Проведенные в США исследования показали, что целенаправленное выявление побочных реакций в 85 хирургических и 67 терапевтических больницах в течение 21 дня выявило побочные реакции в 7,1 % случаев, в то время как добровольная система сообщений врачами и медицинскими сестрами за 45‑дневный период наблюдений выявила медикаментозные реакции лишь в 0,08 %, что в 88,7 раза меньше. О том же положении свидетельствуют данные Подкомитета по нежелательным лекарственным реакциям при Комитете по безопасности лекарств Великобритании. При 1,5 млн выписанных за год рецептов на дегидрокодеин поступило лишь 32 сообщения о побочных реакциях, в то же время даже у практически здоровых людей этот препарат вызывает побочные реакции в 10 % случаев. Следовательно, побочных реакций зарегистрировано почти в 5 тыс. раз меньше, чем можно было ожидать.
В нашей стране нозологическую очерченность лекарственной болезни обосновал Е. М. Тареев (1956). Однако до сих пор продолжается обсуждение о правомочности применения термина «лекарственная болезнь» и его сути. Так, А. Д. Адо (1970; 1978), К. В. Бунин (1977) предлагали термином «лекарственная болезнь» обозначать всю группу нежелательных последствий активной лекарственной терапии, т. е. использовать его в качестве группового, а не нозологического понятия. Но до сих пор не только отсутствует единая классификация побочных реакций и осложнений медикаментозной терапии, но и не решены вопросы терминологии.
С клинической позиции мы считали целесообразным при классификации исходить из органопатологии, обусловленной побочными эффектами лекарственной терапии (табл. 11).
Таким образом, при назначении лекарственных препаратов всегда присутствует риск нежелательных эффектов. Согласно статистическим данным, в среднем побочные реакции возникают у 10 – 20 % госпитализированных больных, в развивающихся странах этот показатель составляет 30 – 40 %. По причине возникших побочных реакций от лекарств госпитализируется 2,5 – 28 % от общего числа больных. По данным США, вследствие развития побочных реакций ежегодно госпитализируется от 3,5 до 8,8 млн человек. От лекарственных осложнений ежегодно умирает до 200 тыс. человек. По данным Шведского комитета нежелательных лекарственных реакций, за 5 лет исследования поступило 4362 сообщения о побочных реакциях и осложнениях. Среди осложнений чаще всего регистрировались поражения кожи (25 %), печени (13 %), тромбоэмболические (10 %) и гематологические (10 %) осложнения. Среди лекарственных препаратов, обусловивших осложнения, чаще всего регистрировались оральные контрацептивы (25 %), химиотерапевтические препараты (19 %), анальгетики (14 %), психотропные средства (12 %) и препараты, действующие на сердечно‑сосудистую систему (9 %).
Таблица 11
Клиническая классификация медикаментозных осложнений (Белозеров Е. С., 1982)
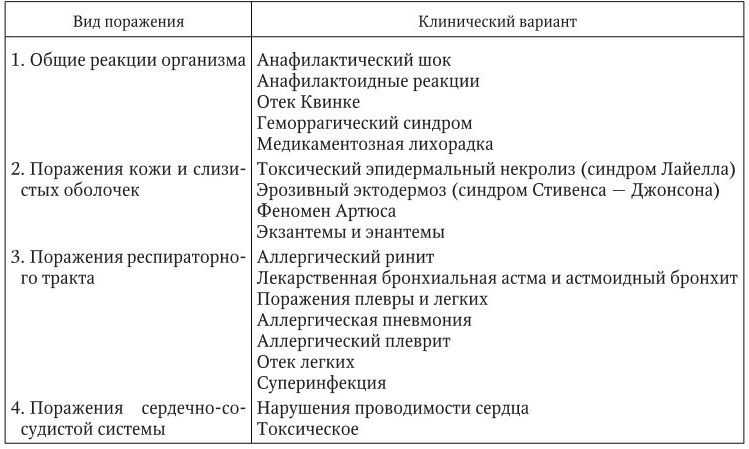
Особую опасность в плане осложнений лекарственной терапии играет полипрагмазия – одновременное назначение (нередко неоправданное) больному многих лекарственных веществ или лечебных процедур. Исследования показали, что






