Реакция получения осаждаемой формы:
Cl- + Ag+→ AgCl↓(крист.)
Схема или реакция получения гр.ф.:
AgCl → AgCl
Осаждаемое вещество (Х) – Ba 2+, осадитель (R) – H 2 SO 4
Реакция получения осаждаемой формы:
Ba2+ + SO42-→BaSO4↓(крист.)
Схема или реакция получения гр.ф.:
BaSO4→BaSO4
Осаждаемое вещество (Х) – SO 42-, осадитель (R) – BaCl 2
Реакция получения осаждаемой формы:
SO42- + Ba2+→BaSO4↓(крист.)
Схема или реакция получения гр.ф.:
BaSO4→BaSO4
Осаждаемое вещество (Х) – Mg 2+, осадитель (R) – (NH 4)2 HPO 4 в среде аммиачной буферной системы
Реакция получения осаждаемой формы:
Mg2+ + NH3 + HPO42-→MgNH4PO4↓(крист.)
Схема или реакция получения гр.ф.:
2MgNH4PO4→Mg2P4O7 + 2NH3↑ + H2O (пар)
Осаждаемое вещество (Х) – Ca 2+, осадитель (R) – (NH 4)2 C 2 O 4
Реакция получения осаждаемой формы:
Ca2+ + C2O42- →CaC2O4↓(крист.)
Схема или реакция получения гр.ф.:
· При 200℃:
CaC2O4→CaC2O4
· При 475-525℃:
CaC2O4→ СaCO3 + CO2↑
· При 900-1000℃:
CaC2O4→CaO + CO↑ + CO2↑
??? Осаждаемое вещество (Х) – PO43-,осадитель (R) – BaCl 2
Реакция получения осаждаемой формы:
PO43- + Ba2+ → Ba3(PO4)2↓
Схема или реакция получения гр.ф.:
Ba3(PO4)2→ Ba3(PO4)2
Осаждаемое вещество (Х) – Fe 2+, осадитель (R) – NH 3* H 2 O
Предварительная стадия – окисление до Fe3+
3FeSO4 + 4HNO3 → NO↑ + Fe(NO3)3 + Fe2(SO4)3 + 2H2O
Реакция получения осаждаемой формы:
Fe3+ + NH3*H2O→ Fe(OH)3↓(аморф.) + 3H2O
Схема или реакция получения гр.ф.:
2Fe(OH)3→ Fe2O3 + 3H2O (пар)
Осаждаемое вещество (Х) – Fe 3+, осадитель (R) – NH 3* H 2 O
Реакция получения осаждаемой формы:
Fe3+ + NH3*H2O→ Fe(OH)3↓(аморф.) + 3H2O
Схема или реакция получения гр.ф.:
2Fe(OH)3→ Fe2O3 + 3H2O (пар)
Модуль 3. рН. Основы титриметрии. Возможности КОТ.
Расчет рН водных растворов протолитов.
А) Расчет рН сильных кислот
| Концентрация кислоты, моль/л
| Концентрация Н+, моль/л
| рН
|
| С>10-2
| 1. Расчет I (9)
2. fдля Н+ (11)
3. a (H+) (10)
| (14)
pH = -lgaH+
|
| 10-5≤С≤10-2
| C(H+) = Cкисл.
| (15)
pH = -lgCкисл.
|
| C<10-5
| ΣС(Н+)=Скисл.+ Сн+(от Н2О)
| (16)
рН= -lg(ΣCн+)
|
(9) Ионная сила раствора I = ½*Σ(Сi*Zi2)
(10) Активная концентрация иона a = f*c
(11) Коэффициент активности иона f берется из таблиц, если известен заряд иона и ионная сила раствора f табл.
Расчет рОН растворов сильных оснований
| Концентрация основания, моль/л
| Концентрация ОН-, моль/л
| рОН
|
| С>10-2
| 1. расчет I (9)
2. f для OН+ (11)
3. a (OH+) (10)
| (17)
pOH = -lgaOH-
|
| 10-5≤С≤10-2
| C(OH-)=Cосн.
| (18)
рОН = -lgСосн.
|
| C<10-5
| ΣС(ОН-)=Сосн.+ Сон-(от Н2О)
| (19)
рОН=-lg(ΣCoн-)
|
Расчет рН растворов слабых кислот
Вариант 1 – очень слабая кислота
| Оценка α
| Концентрация Н+
Расчет рН
|
α≤5% (13)
или
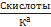 ≥ 400 ≥ 400
| Из формулы 12, считая, что [Н+] мала
[Н+]= 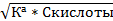 pH= ½*(pK1a-lgCкисл.)
pH= ½*(pK1a-lgCкисл.)
|
(12) Связь между константой ионизации и концентрацией протонов (гидроксид-ионов):
К ионизации кислоты = 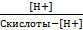 ; К ионизации основания =
; К ионизации основания = 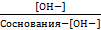
(13) Степень диссоциации (ионизации) + закон разбавления Оствальда:
α = 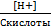 ≈
≈ 
Вариант 2 – кислота средней силы
| Оценка α
| Концентрация Н+
Расчет рН
|
α>5% (13)
или
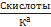 < 400 < 400
| Из формулы 12, решая квадратное уравнение
[Н+]= 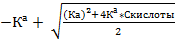 pH рассчитать по формуле 4
pH рассчитать по формуле 4
|
(4) Водородный показатель рН = -lg[Н+]
Б) Расчет рОН растворов слабых оснований
Вариант 1 – очень слабое основание
| Оценка α
| Концентрация Н+
Расчет рН
|
α≤5%
или
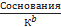 ≥ 400 ≥ 400
| Из формулы 12, считая, что [OН+] мала
[OН-]= 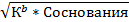 pОH= ½*(pK1b-lgCосн.)
pОH= ½*(pK1b-lgCосн.)
|
Вариант 2 – основание средней силы
| Оценка α
| Концентрация Н+
Расчет рН
|
α>5%
или
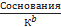 < 400 < 400
| Из формулы 12, решая квадратное уравнение
[OН-]= 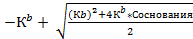 pOH рассчитать по формуле 5
pOH рассчитать по формуле 5
|
(5) Гидроксильный показатель pOH = -lg[OН-]



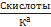 ≥ 400
≥ 400
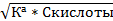 pH= ½*(pK1a-lgCкисл.)
pH= ½*(pK1a-lgCкисл.)
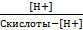 ; К ионизации основания =
; К ионизации основания = 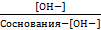
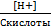 ≈
≈ 
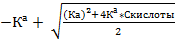 pH рассчитать по формуле 4
pH рассчитать по формуле 4
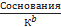 ≥ 400
≥ 400
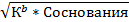 pОH= ½*(pK1b-lgCосн.)
pОH= ½*(pK1b-lgCосн.)
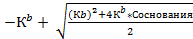 pOH рассчитать по формуле 5
pOH рассчитать по формуле 5



