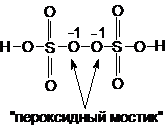|
|
| Мn – металл, активный (Р.Н.: активны, до Н2). Следовательно, – восстановитель (red).
Взаимодействует с окислителями (ox) с образованием соединений марганца(II).
|
|
|
|
|
| Ox = О2
| 1.
| Окисляется кислородом воздуха:
|
|
|
| 2Mn + O2 ¾® 2MnO (оксид марганца(II))
|
|
|
| Реакция идет количественно, если металл находится в мелко раздробленном состоянии. Если не так, оксидная пленка (MnO) препятствует дальнейшему окисления марганца.
|
|
|
|
|
| Ox = Неметалл
| 2.
| При нагревании легко окисляется неметаллами – галогенами, серой, азотом, фосфором, углеродом, кремнием:
|
|
|
| Mn + Cl2 ¾ t® MnCl2 (хлорид марганца(II))
| 3Mn + N2 ¾t® Mn3N2 (нитрид)
|
|
|
| Mn + S ¾t® MnS (сульфид марганца(II))
| 3Mn + 2P ¾t® Mn3P2 (фосфид)
|
|
|
|
| 2Mn + Si ¾t® Mn2Si (силицид)
|
|
|
|
|
| Ox = Н+
| 3.
| Хорошо растворяется
|
|
|
| а)
| в кислотах-неокислителях ─ с выделением водорода (и образованием марганца(II)):
|
|
|
|
|
|
|
|
|
|
|
| Mn + 2H+ ¾¾® H2↑ + Mn2+
| Примеры:
| Mn + 2HCl ¾¾® H2↑ + MnCl2,
|
|
|
|
|
|
| Mn + H2SO4 (разб.) ¾¾® H2↑ + MnSO4
|
|
|
|
| Mn + 2CH3COOH ¾¾® H2↑ + Mn2+ + 2CH3COO–
|
| Mn + 2CH3COOH ¾¾® H2↑ + (CH3COO)2Mn
|
|
|
|
|
|
|
|
| б)
| в H2O в присутствии хлорида аммония (NH 4 Cl), который вследствие гидролиза создает кислую среду и препятствует осаждению гидроксида Mn(ОН)2:
|
|
|
|
| Mn + 2H2O + 2NH4Cl ¾¾® H2↑ + 2NH4OH + MnCl2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Mn
| – 2e
| ¾¾®
| Mn2+
| 1
|
|
|
|
|
|
|
| 2H2O + 2NH4+ + 2e
| ¾¾®
| H2 + 2NH4OH
| 1
|
|
|
|
|
|
|
|
| Mn + 2H2O + 2NH4+
| ¾¾®
| Mn2+ + H2 + 2NH4OH
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| | | | | | | | | | | | | | | | | | | |
| Ox = «S+6»,
|
| в)
| В кислотах-окислителях с образованием солей марганца(II):
|
| «N +5»
|
|
| ─ и SO2 при действии H2SO4 (конц.):
| Mn + 2H2SO4 ¾¾ t® SO2↑ + 2H2O + MnSO4
|
|
|
|
| ─ и NO2 в случае использования HNO3 (конц.):
| Mn + 4HNO3 (конц.) ¾¾® 2NO2↑ + 2H2O + Mn(NO3)2
|
|
|
|
| ─ и NO при действии HNO3 (разб.):
| 3Mn + 8HNO3 (разб.) ¾¾® 2NO↑ + 4H2O + 3Mn(NO3)2
|
|
|
|
|
|
| ЗАДАНИЕ:
|
| Уравняйте реакции из п. 3 в, используя метод полуреакций.
|
|
|
|
| Ox = Оксид Ме
| 4.
| Восстанавливает оксиды многих металлов:
|
|
|
| 3Mn + Fe2O3 ¾t® 3MnO + 2Fe
| Примечание: Эта реакция используется при выплавке стали
|
|
|
|
|
|
| Ox = Ме n +
(соль Ме)
| 5.
| Взаимодействует с солями менее активных металлов (см. электрохимический ряд напряжений металлов).
|
|
| ЗАДАНИЕ:
| Приведите примеры самостоятельно. Подумайте, в каких условиях ─ В растворах? В расплавах?
|
| | | | | | | |
| Получение
| 6.
| 1.
| Алюмотермия (см. тему «Химия алюминия») – из оксидов, которые восстанавливают алюминием.
| |
|
|
|
| а)
| Реакция природного MnO2 с Al протекает очень бурно. Поэтому сначала MnO2 прокаливают:
| |
|
|
|
|
| 3MnO2 ¾t® Mn3O4 + О2↑
| |
|
|
|
|
| и получают смешанный оксид Mn3O4 (MnO2∙2MnO),
| |
|
|
|
| б)
| Который восстанавливают алюминием:
| |
|
|
|
|
| 3Mn3O4 + 8Al ¾t® 9Mn + 4Al2O3
| |
|
|
|
|
|
| |
|
|
| 2.
| Кремнийтермия – из оксида (MnO2), в качестве восстановителя используется кремний:
| |
|
|
|
|
| MnO2 + Si ¾t® Mn + SiО2
| |
|
|
|
|
|
| |
|
|
| 3.
| Электролиз раствора сульфата марганца(II):
| |
|
|
|
|
| MnSO4 ¾¾® Mn2+ + SO42–
| |
|
|
|
|
| КАТОД (–)
| Mn2+, Н2О
| АНОД (+)
| SO42–, Н2О
| |
|
|
|
|
|
| Mn2+ + 2е ¾¾® Mn
| 2
| 2Н2О – 4e ¾¾® О2 + 4Н+
| |
|
|
|
|
| 2Mn2+ + 2Н2О ¾ электролиз раствора ® 2Mn + О2 + 4Н+
| |
|
|
|
|
| 2MnSO4 + 2Н2О ¾ электролиз раствора ® 2Mn + О2↑ + 2Н2SO4
| |
|
|
|
|
|
| |
|
|
|
|
|
| |
|
Характеристика
|
|
II. М n (II) – соединения марганца(II)
|
|
Окислительно-восстановительная
|
|
Кислотно-основных свойств
|
|
|
|
Способность
|
|
|
| А
| MnO
| ─
|
Оксид марганца(II)
|
|
|
|
Основные свойства
|
| Б
| Mn (ОН)2
| ─
|
Гидроксид марганца(II)
|
Восстановители
|
| (категория II)
|
| В
| Mn2+ (MnSO4)
| ─
|
Соли марганца(II)
| (окислители в пареMn2+/ Mn )
|
| | | | | | | | | | | | | | | | | | |
| 1.
|
| В воде не растворяется!
|
|
|
|
|
|
|
|
| MnO + Н2О ¾х®
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 2.
|
| С образованием соли марганца(II) …
|
|
|
|
|
|
|
| а)
| ... растворяется в кислотах:
|
|
|
|
|
|
|
|
| Простая форма записи
|
|
|
|
|
|
|
|
| MnO + Н2SO4 (разб.) ¾® Н2О + MnSO4
|
|
|
|
|
|
|
|
| Реально (в водном растворе) образуется аквокомплекс гексааквомарганца(II) (см. II-В):
|
|
|
|
|
|
|
|
| MnО + 2Н+ + 5Н2О ¾® [Mn(Н2О)6]2+
|
|
|
|
|
|
|
|
| MnO + Н2SO4 (разб.) + 5Н2О ¾® [Mn(Н2О)6]SO4
|
|
|
|
|
|
|
| б)
| …взаимодействует с кислотными оксидами:
|
|
|
|
|
|
|
|
| MnO + SO3 ¾® MnSO4
|
|
|
|
|
|
|
|
| MnO + SiO2 ¾t (без доступа О2) ® MnSiO3
| ¾ ®
| 4.
|
| Легко окисляется кислородом (ох) воздуха:
|
|
|
|
|
|
|
|
| 2MnO + O2 ¾t® MnO2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Получение
|
|
|
|
| 6.
|
| Из MnСO3 – пиролизом в инертной (N2) атмосфере:
|
|
| 5.
|
| Из MnO2 – восстанавливают молекулярным водородом:
|
|
|
| MnСO3 ¾t (без доступа О2) ® MnO + CO2↑
|
|
|
|
| MnO2 + Н2 ¾t® MnO + Н2О↑
|
|
|
|
|
|
|
|
|
|
|
|
| В присутствии кислорода
| ¾ ®
| 7.
| →
| 6MnСO3 + О2 ¾t® 2Mn3O4 + 6СО2
|
|
|
|
|
|
|
|
|
|
| | | | | | | | | | | |
| 1.
| а)
| В воде не растворяется (труднорастворимый электролит).
|
|
|
|
|
|
|
|
| При нагревании теряет воду:
|
|
|
|
|
|
|
|
| Mn(ОН)2 ¾t (без доступа О2) ® MnO + Н2О
|
|
|
|
|
|
|
| б)
| Слабое основание – та часть, что растворяется, в растворе диссоциирует как слабый электролит.
Растворение и диссоциация заметны только в присутствии кислоты. Поэтому реальное поведение (в присутствии избытка Н+) Mn(OН)2можно отразить следующей схемой:
|
|
|
|
|
|
|
|
| Mn(ОН)2↓ ←Н+→ Mn2+ + 2ОН─
|
|
|
|
|
|
|
|
| ↓↓
|
|
|
|
|
|
| 2.
|
|
Способ получения:
|
|
|
|
|
|
|
|
| Из растворимых солей марганца(II) действием более сильного (или более растворимого) основания, чем Mn(OН)2, например:
|
|
|
|
|
|
|
|
| MnCl2 + 2NaOH ¾® Mn(ОН)2↓ + 2NaCl
|
|
|
|
|
|
|
|
| Mn2+ + 2ОН─ ¾® Mn(ОН)2↓
|
|
|
|
|
|
|
|
| Mn(OН)2 образуется в виде белого осадка
| ¾ ®
| 3.
|
| Mn(OН)2 легко окисляется кислородом (ох) воздуха,
|
|
|
|
|
|
|
|
| буреет вследствие перехода в Mn(OН)4:
|
| 4.
|
| Растворяется в кислотах, взаимодействует с кислотными
|
|
|
|
| 2Mn(OН)2 + О2 + 2Н2О ¾® 2Mn(OН)4
|
|
|
| оксидами – с образованием солей марганца(II):
|
|
|
|
|
|
|
|
| а)
| Mn(OН)2 + Н2SO4 (изб.) ¾® 2Н2О + MnSO4
|
|
|
|
| О2 + 2Н2О + 4e ¾® 4ОН–
| 1
|
|
|
| Mn(OН)2↓ + 2Н+ ¾® 2Н2О + Mn2+
|
|
|
|
| Mn(OН)2 + 2ОН– – 2е ¾® Mn(OН)4
| 2
|
|
|
| или реально в водных растворах
|
|
|
|
| О2 + 2Н2О + 2Mn(OН)2 + 4ОН – ¾® 4ОН – + 2Mn(OН)4
|
|
|
|
| Mn(OН)2↓ + 2Н+ + 4Н2О ¾® [Mn(Н2О)6]2+
|
|
|
|
|
|
|
|
| Mn(OН)2↓ + Н2SO4 + 4Н2О ¾® [Mn(Н2О)6]SO4
|
|
|
|
|
|
|
| б)
| Mn(OН)2 + SO3 (изб.) ¾® Mn(НSO4)2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
| В
|
Соли Mn (II)
|
| |
| | | | | | | | | | | | | | | | | | | | |
| 1.
|
| Большинство солей марганца(II) хорошо растворимы в воде. Катион Mn2+ в водном растворе существует в виде аквокомплекса, придающего раствору розоватую окраску:
|
|
| 5.
|
| Слабые восстановители: проявляют восстановительные свойства только в присутствии сильных окислителей, при этом окисляются …
| |
|
|
| MnCl2 ¾® Mn2+ + 2Cl–
|
|
|
| а)
| в кислой среде – до MnO4– («Mn+7»)
| |
|
|
| Mn2+ + 6Н2О ↔ [Mn(Н2О)6]2+
|
|
|
| б)
| в нейтральной – до MnO2 («Mn+4»)
| |
|
|
| В сухом виде кристаллогидраты солей тоже окрашены в бледно розовый цвет.
|
|
|
| в)
| в щелочной – до MnO42– («Mn+6»)
Примеры:
| |
|
|
| Не растворимы в воде: MnS, MnCO3, Mn3(PO4)3
|
|
|
|
|
|
| H2SO4
|
| |
|
|
|
|
|
|
| а)
| 1. 2MnSO4 + 5 (NH 4)2 S 2 O 8 + 8Н2О ¾¾¾¾¾®
| |
| 2.
|
| Гидролиз. Соли (разумеется, растворимые) по катиону
|
|
|
|
|
|
| Ag+ – кат.
|
| |
|
|
| (Mn2+) гидролизуются слабо.
|
|
|
|
|
| ¾¾® 2HMnO4 +10NH4HSO4 + 2H2SO4
| |
|
| а)
| В упрощенной форме записи:
|
|
|
|
|
| +4
|
| |
|
|
| Mn2+ + Н2О ↔ MnOН+ + Н+
|
|
|
|
| 2. 2MnSO4 + 5 PbO 2 + 6HNO3 ¾¾¾¾¾®
| |
|
|
| MnCl2 + Н2О ↔ MnOНCl + НCl
|
|
|
|
|
|
| +2
|
| |
|
|
|
|
|
|
|
|
| ¾¾® 2HMnO4 +3Pb(NO3)2 + 2PbSO4 + 2Н2О
| |
|
|
|
|
|
|
|
|
|
| |
|
| б)
| Реально (см. тему «Химия алюминия»):
|
|
| Примечания:
| 1.
| Превращение Mn2+ в HMnO4 сопровождается
| |
|
|
| [Mn(Н2О)6]2+ ↔ [MnОН(Н2О)5]+ + Н+
|
|
| визуальным эффектом – появлением малиновой (розовой в разбавленном растворе) окраски раствора, связанной с ионами
| |
| 3.
|
| MnCO3, MnS растворяются в более сильных кислотах, в частности:
|
|
| MnO4–. Эти реакции (а-1, а-2) используют в аналитической химии как качественные на ионы Mn2+.
| |
|
|
| MnCO3 + 2НCl (изб.) ¾® Н2О + СО2(↑) + MnCl2
|
|
|
| 2.
| (NH4)2S2O8 – персульфат аммония, соль
| |
|
|
| MnCO3↓ + 2Н+ ¾® Н2О + СО2(↑) + Mn2+
|
|
| надсерной (пероксидисерной) кислоты Н2S2O8
| |
|
|
|
|
|
|
|
|
| 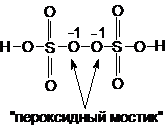
|
| |
|
|
| ЗАДАНИЕ:
| Запишите в аналогичном виде процесс растворения сульфида марганца(II) в соляной кислоте.
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| |
| 4.
|
| Соли марганца(II) взаимодействуют с более сильными
|
|
|
|
|
| |
|
|
| (или более растворимыми) основаниями (см. II-Б-2).
|
|
|
|
|
| |
|
|
|
|
|
|
| б)
| 1. 3MnSO4 + 2 KMnO 4 + 2Н2О ¾¾®
| |
|
|
|
|
|
|
|
|
| ¾¾® 5MnO2↓ + 2KHSO4 + H2SO4
| |
|
|
| .
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
| 2. Mn(NO3)2 + PbO2 ¾¾® MnO2↓ + Pb(NO3)2
| |
|
|
|
|
|
|
|
|
|
| |
|
| 6.
| В окислительно-восстановительной паре
|
|
|
| в)
| 1. 3MnSO4 + 2 KClO 3 + 12KOH ¾t, сплав¾®
| |
|
|
| Mn2+ + 2е ¾¾® Mn
|
|
|
|
|
| ¾¾® 3K2MnO4 + 6Н2О + 2KCl + 3K2SO4
| |
|
|
| катионы Mn2+ – окислители. Следовательно, соли
|
|
|
|
|
| |
|
|
| восстанавливаются до металла Mn
|
|
|
|
| 2. MnSO4 + 2 KOBr + 4KOH ¾t, сплав¾®
| |
|
|
| а)
| электролитически (см. I-6-3),
|
|
|
|
|
| ¾¾® K2MnO4 + 2Н2О + 2KBr + K2SO4
| |
|
|
| б)
| под действием более сильного восстановителя-
|
|
|
|
|
| |
|
|
| металла (см. Р.Н.)
|
|
|
|
| ЗАДАНИЕ:
| Реакции 5 а, б, в уравняйте методом полуреакций.
| |
|
Характеристика
|
|
Кислотно-основных
|
|
|
|
Способность
|
|
Свойств
|
| А
| MnO2
| ─
|
Оксид марганца(IV)
|
Амфотерны (категория III,
|
| Б
| Mn (ОН)4
| ─
|
Гидроксид марганца(IV)
|
Соли марганца(IV)
Red
|
|
|
|
| окислительно-восстановительная реакция
|
|
|
|
|
|
|
| Примечание:
| Эта реакция – один из лабораторных способов получения Cl2
|
|
| 5.
|
| Внутримолекулярные окислительно-восстановительная реакции с выделением кислорода идут …
|
|
|
|
|
|
|
| а)
| в присутствии горячих концентрированных серной или азотной кислот:
|
|
|
|
|
|
|
|
| 2MnO2 + H2SO4 (конц.) ¾¾® О2↑ + 2Н2О + MnSO4
|
|
|
|
|
|
|
|
| ↓
| ↓
|
|
|
|
|
|
|
|
|
|
| ox
| red
|
|
|
|
|
|
|
|
|
| б)
| при нагревании (в пределах 500 0С):
|
|
|
|
|
|
|
|
| MnO2 ¾t¾® О2↑ + MnO
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 6.
|
| В кислой среде иногда в присутствии сильного окислителя MnО2 способен проявлять восстановительные свойства, окисляясь при этом до «Mn+7» с образованием перманганат-ионов MnO4–
|
|
|
|
|
|
|
|
| 2MnO2 + 2 PbO2 + 6HNO3 ¾¾® 2HMnO4 +3Pb(NO3)2 + 2Н2О
|
|
|
|
|
|
|
| ЗАДАНИЕ:
| Будет ли сопровождаться эта реакция (III–А-6) визуальным эффектом?
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ЗАДАНИЕ:
| Все реакции из пунктов III–А-2, 3,6 следует уравнять методом полуреакций.
|
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
|
|
| Мn – металл, активный (Р.Н.: активны, до Н2). Следовательно, – восстановитель (red).
Взаимодействует с окислителями (ox) с образованием соединений марганца(II).
|
|
|
|
|
| Ox = О2
| 1.
| Окисляется кислородом воздуха:
|
|
|
| 2Mn + O2 ¾® 2MnO (оксид марганца(II))
|
|
|
| Реакция идет количественно, если металл находится в мелко раздробленном состоянии. Если не так, оксидная пленка (MnO) препятствует дальнейшему окисления марганца.
|
|
|
|
|
| Ox = Неметалл
| 2.
| При нагревании легко окисляется неметаллами – галогенами, серой, азотом, фосфором, углеродом, кремнием:
|
|
|
| Mn + Cl2 ¾ t® MnCl2 (хлорид марганца(II))
| 3Mn + N2 ¾t® Mn3N2 (нитрид)
|
|
|
| Mn + S ¾t® MnS (сульфид марганца(II))
| 3Mn + 2P ¾t® Mn3P2 (фосфид)
|
|
|
|
| 2Mn + Si ¾t® Mn2Si (силицид)
|
|
|
|
|
| Ox = Н+
| 3.
| Хорошо растворяется
|
|
|
| а)
| в кислотах-неокислителях ─ с выделением водорода (и образованием марганца(II)):
|
|
|
|
|
|
|
|
|
|
|
| Mn + 2H+ ¾¾® H2↑ + Mn2+
| Примеры:
| Mn + 2HCl ¾¾® H2↑ + MnCl2,
|
|
|
|
|
|
| Mn + H2SO4 (разб.) ¾¾® H2↑ + MnSO4
|
|
|
|
| Mn + 2CH3COOH ¾¾® H2↑ + Mn2+ + 2CH3COO–
|
| Mn + 2CH3COOH ¾¾® H2↑ + (CH3COO)2Mn
|
|
|
|
|
|
|
|
| б)
| в H2O в присутствии хлорида аммония (NH 4 Cl), который вследствие гидролиза создает кислую среду и препятствует осаждению гидроксида Mn(ОН)2:
|
|
|
|
| Mn + 2H2O + 2NH4Cl ¾¾® H2↑ + 2NH4OH + MnCl2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Mn
| – 2e
| ¾¾®
| Mn2+
| 1
|
|
|
|
|
|
|
| 2H2O + 2NH4+ + 2e
| ¾¾®
| H2 + 2NH4OH
| 1
|
|
|
|
|
|
|
|
| Mn + 2H2O + 2NH4+
| ¾¾®
| Mn2+ + H2 + 2NH4OH
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| | | | | | | | | | | | | | | | | | | |