



Методы получения индивидуальных генов, наработка их препаративных количеств путем клонирования - техника генной инженерии, включающая: выделение индивидуальных фрагментов ДНК любого происхождения, их стабильное воспроизведение в составе векторов, идентификация функций клонированных генов, их изменение и введение в клетки исходного или иного организма. Эта техника получила также название техники рекомбинантной ДНК.
Получение генов. Главную роль на 1 этапе выделения гена отводят эндонуклеазам рестрикции (рестриктазам). Эти ферменты разрезают ДНК вблизи или внутри определенных последовательностей нуклеотидов, которые одинаковы на обеих комплементарных цепях. Два разрыва на концах фрагмента образуют липкие концы, которые могут вновь замыкаться благодаря комплементарности оснований. Последовательности, узнаваемые рестриктазами, статистически разбросаны по геному. Чем короче последовательность, тем чаще она встречается, и тем короче фрагменты ДНК, образующиеся при рестрикции. Фрагменты рестрикции (рестрикты), можно разделить по их молекулярной массе и заряду при помощи электрофореза в геле. ДНК-зонды используют для поисков нужной комплементарной им иРНК, которую используют для синтеза кДНК (комплементарной ДНК) с помощью фермента обратной транскриптазы.
Клонирование генов. Для выделения нужного фрагмента ДНК в препаративных количествах его необходимо встроить в плазмиду - вектор, вскрытую той же рестриктазой, которую использовали для получения рестриктов геномной ДНК. Векторы — это молекулы ДНК, способные переносить включенные в них гены в клетку, где эти молекулы реплицируются автономно или после интеграции с геномом. В качестве векторов служат плазмиды, несущие гены устойчивости к антибиотикам. Например, плазмида рВR322 несет гены устойчивости к ампициллину(Ap) и тетрациклину(Tc). В гене Ар находится уникальный сайт для рестриктазы Pst1, а в гене Tc - для ВаmH1. Вскрывая вектор рВR322 по сайту ВаmН1 в гене Тc, в него можно встроить фрагменты, полученные при помощи той же рестриктазы за счет взаимодействия липких концов. Ковалентное соединение вектора и клонируемого фрагмента завершает полинуклеотидлигаза. Векторы типа плазмиды рВR322 называют векторами инактивации. Широко применяют также векторы на основе бактериофага, т.к.средняя часть генома не существенна для его литического размножения в Е. соli и может быть заменена на чужеродный фрагмент ДНК. Существуют множество типов векторов, сконструированных на основе различных плазмид и бактериофагов.
Не всегда удается получить фрагменты ДНК с липкими концами. Эти концы могут быть «пришиты» к фрагментам ДНК искусственно. Одну цепь таких молекул с тупыми концами наращивают за счет олигодезокси-А, а другую — за счет олигодезокси-Т при помощи нуклеотидилтрансферазы. Тупые концы наращивают также за счет синтетических линкеров - последовательностей, «узнаваемых» определенной рестриктазой или несколькими из них. После обработки соответствующей рестриктазой концы становятся липкими и фрагмент можно встроить в вектор, вскрытый той же рестриктазой.
Из методички
Метод рекомбинации заключается в следующем:
а) выделение ДНК из разных клеток и организмов;
б) получение гибридных (рекомбинантных) молекул ДНК;
в) введение рекомбинантных молекул ДНК в живые клетки;
г) создание условий для экспрессии секреции продуктов, кодируемых генами.
Целевые гены, кодирующие те или иные структуры, выделяются из плазмид или хромосом с помощью ферментов – рестриктаз, способных резать ДНК по определенным связам или синтезируются химически. Полученный целевой ген с помощью лигаз сшивают с геном вектора (плазмиды, бактериофаги, вирусы, космиды – гибрид плазмиды с фагом).
Рекомбинантная ДНК (плазмида, фаг, вирусная ДНК, космида) встраивается в микробы (E. сoli, дрожжи, вирусы и др.) или животную клетку, которая приобретает новое свойство – способность продуцировать нужные вещества (НВs-АГ вируса гепатита В, антигенов ВИЧ (р24,gp41, gp120 и др.), альфа-интерферона и др.
10. Молекулярно-биологические методы, использование в диагностике инфекционных болезней (ПЦР, метод молекулярных зондов).
Молекулярно-биологические исследования – группа методов, предназначенных для обнаружения в биологическом материале нуклеиновой кислоты (РНК, ДНК).
В основе молекулярно-биологических исследований лежит воспроизведение механизма дублирования наследственной информации в геноме. Последовательность нуклеотидов в одиночной цепи ДНК или РНК закономерно воспроизводится в последовательности нуклеотидов комплементарной цепи благодаря исключительным биологическим свойствам азотистых оснований и специфических ферментных систем.
Метод молекулярных зондов
Метод ДНК-зондов позволяет обнаруживать нуклеиновые кислоты (в том числе и вирусные) в любых материалах, включая патологический материал от больных животных. Он основан на способности одноцепочечных молекул нуклеиновых кислот соединяться в двухцепочечные, если они взаимно комплементарны.
Любой вирус включает одну специфичную для него молекулу ДНК (или РНК) со строго определенной последовательностью нуклеотидов. Чтобы обнаружить вирусную нуклеиновую кислоту в материале от больного, можно воспользоваться ее способностью после разделения цепей (если она двухцепочная) образовывать снова двойную цепь с комплементарной ей молекулой нуклеиновой кислоты, предварительно как-либо помеченной.
Такая меченая одноцепочная молекула нуклеиновой кислоты, комплементарная молекуле нуклеиновой кислоты определенного вируса, называется ДНК-зондом. Для каждого вида вируса зонд готовят заранее и вводят в него метку или в виде атомов радиоактивного фосфора (Р32), или в виде биотина, дающего изменение цвета, что позволяет обнаруживать зонд, а значит, и вирусную нуклеиновую кислоту, с которой зонд соединился в результате молекулярной гибридизации.
Методика обнаружения вирусной нуклеиновой кислоты в патологическом материале включает следующие этапы:
1) получение ДНК-зонда и его метка;
2) подготовка патологического материала к исследованию;
3) молекулярная гибридизация и удаление одноцепочечных нуклеиновых кислот;
4) обнаружение двухцепочных нуклеиновых кислот, включивших в себя зонд (по метке);
5) интерпретация результатов.
Получение ДНК-зонда - наиболее трудная задача. Она сводится к тому, что ДНК соответствующего вируса, на который хотят получить ДНК-зонд, разрезают на фрагменты (с помощью рестриктаз). Методом электрофореза выделяют тот фрагмент, который неизменно обнаруживается в ДНК вирусов разного происхождения и является наиболее консервативным.
Из бактерии кишечной палочки выделяют те плазмиды, которые содержат ген фермента, разрушающего какой-либо антибиотик (например, ген пенициллиназы). Плазмидные ДНК с вирусными вставками вводят в бактерии, которые затем клонируют в селективной среде, содержащей антибиотик, к которому бактерии стали нечувствительными. Накапливают массу бактерий и из них выделяют плазмидную ДНК (путем удаления белка).
Выделенную плазмидную ДНК, содержащую вирусные вставки, метят радиоактивным фосфором (Р32) и денатурируют путем нагрева до 80°С. Образовавшиеся одноцепочные молекулы ДНК будут иметь фрагменты, комплементарные фрагментам одной из нитей ДНК вируса. Это и есть ДНК-зонд.
Для получения ДНК-зонда на вирусную РНК выбирают на основе анализа генетической карты вируса необходимый фрагмент РНК, выделяют его, а затем путем обратной транскрипции получают ДНК-фрагмент, который и встраивают в плазмиду. Обычно ДНК-зонд готовят на каждый вирус заранее, нарабатывают его и хранят до использования.
С помощью ДНК-зонда можно обнаружить вирусные нуклеиновые кислоты в любом материале от больных животных. Для этой цели пригоден как свежий материал (ткани, смывы, кровь), так и высушенный, мороженный и даже частично разложившийся.
Из подлежащего исследованию материала выделяют ДНК, обрабатывают препаратами, разрушающими белки. После полного удаления белков осаждают ДНК при температуре -70°С, осадок отмывают спиртом и подвергают денатурации путем кипячения или обработки щелочью.
Полученные пробы из разных исследуемых материалов наносят на нейлоновую мембрану(фильтр), расчерченную простым карандашом на квадраты (для каждого материала свой номер квадрата). Также наносят отрицательный и положительный контроли. Зонд наносят на стекло, которое затем накладывают на фильтр так, чтобы получился контакт зонда с исследуемым материалом, и 20 мин выдерживают при температуре 80°С, после чего температуру снижают до 55°С, при которой идет гибридизация (около 2 часов). Затем фильтр отделяют от стекла, промывают, сушат и удаляют с него все несвязавшиеся одноцепочные молекулы ДНК, обрабатывая додецилсульфатом и цитратом натрия. Методом авторадиографии устанавливают, в каких квадратах выявляется радиоактивность, и визуально оценивают ее интенсивность. Потемнение фотопленки, контактирующей с определенными квадратами, свидетельствуют о наличии в материалах этих квадратов искомой нуклеиновой кислоты вируса.
Кратко метод ДНК-зондов сводится к следующему:
1. Получение одноцепочного фрагмента ДНК определенного вируса (ДНК-зонда) и его метка.
2. Выделение и патологического материала нуклеиновых кислот и их денатурация (расплетение двухцепочных молекул на одноцепочные).
3. Контакт образовавшихся одноцепочных молекул ДНК (или РНК) с ДНК-зондом при 55˚С, приводящий к образованию двухцепочных молекул (молекулярная гибридизация) в случаях их взаимной комплементарности.
4. Удаление всех негибридизированных одноцепочных молекул нуклеиновых кислот.
5. Обнаружение (по метке) образовавшихся двухцепочных молекул нуклеиновых кислот, которые и будут указывать на наличие в материале того вируса, на который был получен ДНК-зонд.
Достоинства: Высокие чувствительность и специфичность, универсальность, отсутствие необходимости в стерильной работе и математической обработке материалов.
Недостатки: Относительная технологическая сложность, и трудность получения ДНК-зонда.
11. Полимеразная цепная реакция (ПЦР). Принцип метода, достоинства. 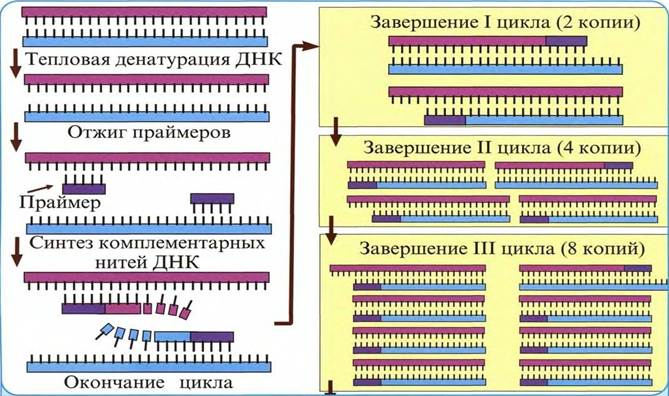
В основе ПЦР (метода амплификации ДНК in vitro) лежит способность однонитчатой ДНК (праймера) достраиваться и взаимодействовать по принципу комплементарности с ДНК искомого возбудителя при ее наличии в исследуемом материале.
Компоненты реакции:
1) исследуемый материал, содержащий молекулу ДНК микроорганизмов (испражнение, мокрота, выделенная чистая культура микроба и др.);
2) праймеры – короткие искусственно синтезированные молекулы ДНК, идентичные соответствующим участкам определяемой ДНК микроба;
3) фермент (ДНК- полимераза), обеспечивающий достраивание второй цепи ДНК;
4) смесь нуклеотидов – строительный материал, из которого синтезируется достраиваемая ферментом цепь ДНК;
Каждый цикл амплификации состоит из 3-х этапов:
1) денатурация ДНК, находящуюся в образце. Для этого нагревают реакционную смесь при t 93-950 С, в результате чего двухцепочечные молекулы ДНК расплетаются с образованием двух одноцепочечных;
2) отжиг – присоединение праймеров и ДНК микроба, что происходит в соответствии с правилами комплементарности при t 50-65°C.
3) элонгация – синтез второй цепи ДНК при участии полимеразы при t 72°C (рис.22).
В дальнейшем этапы денатурации, отжига и элонгации многократно повторяются. На каждом цикле количество синтезированных копий фрагмента ДНК определяемого микроба удваивается. Благодаря этому происходит многократное удвоение специфических фрагментов ДНК. Продукты синтеза первого цикла амплификации служат матрицей для второго цикла, а продукты синтеза второго цикла - матрицей для третьего цикла амплификации. Цикл амплификации проводится в термо-циклере (амплификаторе).
Достоиннства ПЦР:
1) высокая чувствительность и специфичность;
2) быстрота (применяется для экспресс-диагностики);
3) возможность идентификации труднокультивируемых микроорганизмов (внутриклеточных паразитов и персистирующих микроорганизмов);
4) возможность определения микроорганизмов непосредственно в клиническом материале без предварительного выделения чистой культуры.











