Всего цепь переноса электронов включает в себя около 40 разнообразных белков. Все они организованы в 4 больших мембраносвязанныхмульферментных комплекса.
Компоненты дыхательной цепи встроены в митохондриальную мембрану в виде 4 белково-липидных комплексов.
Комплекс I (НАДН-дегидрогеназа) включает ФМН и железосерный белок FeS (негемовое железо). Железосерный белок участвует в окислительно-восстановительном процессе.
Комплекс I окисляет НАДН, перенося с него 2 электрона на кофермент Q (KоQ) и перекачивает 4 протона из матрикса в межмембранное пространство митохондрии.
KoQ (убихинон) - производное бензохинона. Это некрупная липофильная молекула. Перемещаясь в липидном слое мембраны, убихинон обеспечивает передачу электронов между комплексами I - III и II — III.
Строение:
| Комплекс II (ФАД-зависимая дегидрогеназа) включает ФАД и железосерный белок. Обеспечивает вход в цепь дополнительных электронов за счет окисления сукцината.
| 
|
| Комплекс III (К oQ - цмтохром с редуктаза)включает цитохромы b и с1 и железосерный белок. Цитохромы- гемопротеины, в которых простетическаягеминовая группа близка к гему гемоглобина (у цитохрома b идентична).
| Комплекс III переносит электроны с убихинона на цитохром с и перекачивает 2 протона в межмембранное пространство. 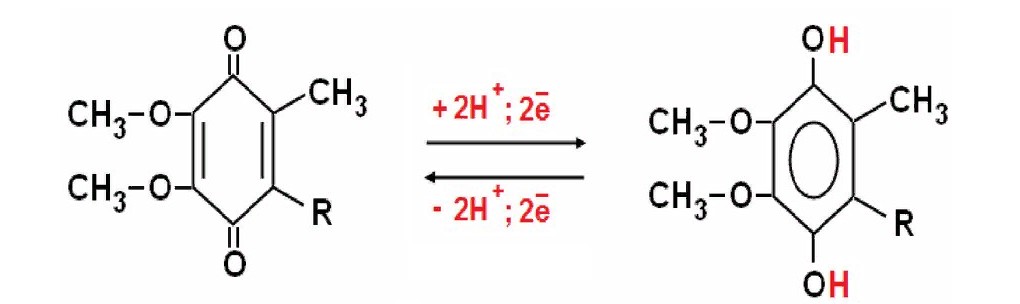
|
| Комплекс IV (цитохромоксидаза)состоит из цитохромов a и a 3, которые, помимо гема, содержат ионы меди. Комплекс IV катализирует перенос электронов с молекул цитохрома на O 2 и перекачивает 4 протона в межмембранное пространство.
| 
|
| Комплекс V - это фермент АТФ -синтетаза.
| 
|
Цитохром а3 - терминальный участок дыхательной цепи (цитохромоксидаза): происходит окисление цитохрома с и образование воды. В организме человека митохондриальная дыхательная цепь образует 300-400 мл воды за сутки (метаболическая вода).
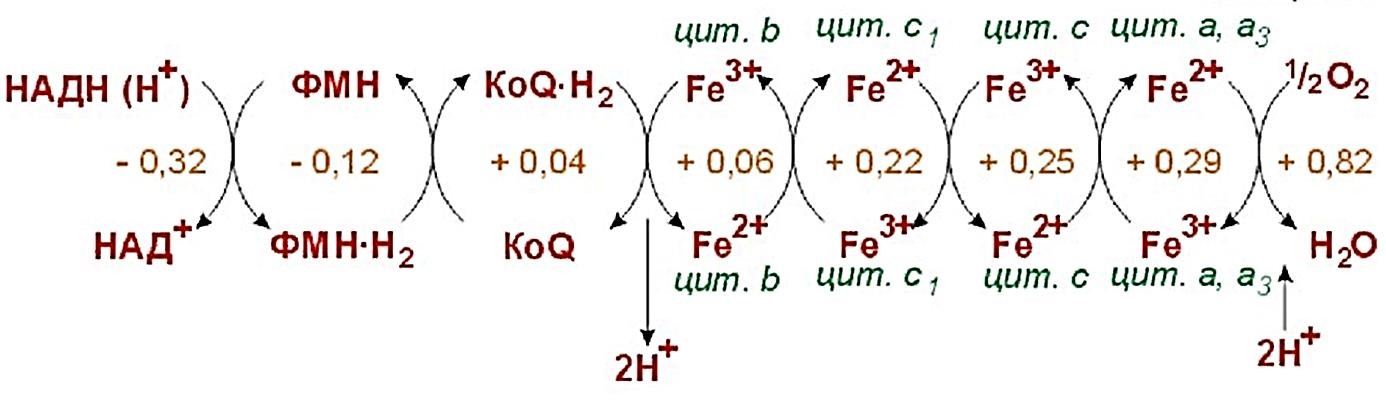
Компоненты дыхательной цепи митохондрий расположены в порядке убывания окислительно-восстановительного потенциала. Перемещение электронов в дыхательной цепи происходит по градиенту окислительно-восстановительного потенциала и является источником энергии для переноса протонов. Перенос двух электронов через каждый комплекс обеспечивает перекачку четырех протонов. В результате по сторонам мембраны возникает разность концентраций протонов и одновременно разность электрических потенциалов со знаком «плюс» на наружной поверхности. Электрохимический потенциал понуждает протоны двигаться в обратном направлении - с наружной поверхности внутрь. Однако мембрана непроницаема для них, за исключением участков, где располагается фермент протонная АТФ-синтаза.
Схематическое расположение для понимания:
Обьяснение:
Первая реакция.
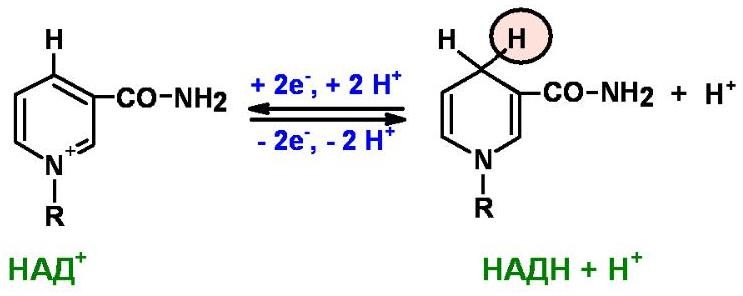
Берется Любой субстрат и восстанавливается и НАДН восстанавливается до НАД;
Далее ФМН восстанавливается до ФМН Н2;
Далее смотришь снизу вверх) КоQвосстанавливается до КоQН2;
Начинается второй комплекс цит. B:
Железо из 3х валетного восстанавливается до двухвалетного
и далее называешь по очереди комплексы цит.С1, цит. С,цит а,а3 (смотришь по схеме)
и в конце говоришь,что получается ½ кислорода и вода.
Некоторые нужные формулы:


Редокс-потенциал.
Редокс-потенциал (окислительно-восстановительный потенциал) определяет направление переноса протонов и электронов ферментами дыхательной цепи.
Редокс-потенциал выражается значением электродвижущей силы (в вольтах), к-я возникает в растворе между окислителем и восстановителем, присутствующих в концентрации 1,0 моль/л при 25˚ С.
Кофермент Q (КоQ),убихинон, подобно НАД и ФАД, может играть роль промежуточного переносчика водородных атомов, т.е. электронов и протонов. Убихинон синтезируется в тканях человека. Источником его образования служат мевалоновая кислота и продукты обмена фенилаланина и тирозина.
Кофермент Q принимает участие в реакциях окислительного фосфорилирования, является звеном в цепи переноса электронов в митохондриях. Ингибиторы работы убихинона останавливают реакции окислительного фосфорилирования.
Кофермент Q является звеном в цепи переноса электронов, принимает участие в переносе электронов с NADH-дегидрогеназного комплекса (комплекс I) и сукцинатдегидрогеназного комплекса (II) на комплекс III, и участвует таким образом в синтезе АТФ.

Цитохромы — группа гемсодержащих белков, обладающих свойством принимать и отдавать электроны за счет изменения валентности центрального атома железа в геме.
В дыхательной цепи цитохромы служат переносчиками электронов и располагаются соответственно величине окислительно—восстановительного потенциала следующим образом: B, С1, С, а, а3.
В цитохромах С и С1 дополнительные ковалентные связи формируются между тиогруппами цистеина и боковыми винильными группами гема. QН2—дегидрогеназа (комплекс III) представляет собой комплекс цитохромов b и С1. Этот фермент катализирует окисление восстановленного кофермента Q и перенос электронов на цитохром С. Электроны последовательно переносятся атомами железа цитохромов b и С1, а затем поступают на цитохром С. Протоны после окисления QH2 освобождаются в раствор.
Цитохромоксидаза включает комплекс цитохромов а и а3 (комплекс IV). Цитохромоксидаза кроме гема содержит ионы меди, которые способны менять валентность и таким способом участвовать в переносе электронов:

Цитохромоксидаза переносит электроны с цитохромаС на кислород. В переносе электронов участвуют сначала ионы железа цитохромов а и а3, а затем ион меди цитохрома а3. Молекула кислорода связывается с железом в гемецитохрома а3. Следовательно, переход электронов на кислород с иона меди цитохрома а3, происходит на молекуле фермента. Каждый из атомов молекулы кислорода присоединяет по два электрона и протона, образуя при этом молекулу воды.
45)Окислительное фосфорилирование и его механизм. Стехиометрический коэффициент окислительного фосфорилирования. Дыхательный контроль. Разобщение окисления и фосфорилирования, разобщающие факторы. Особенности митохондрий бурой жировой ткани
В клетке часто может создаваться ситуация, когда реакции окислительного фосфорилирования идут с определенными вариациями. Эти вариации могут являться следствием нарушений в организме или физиологической реакцией.