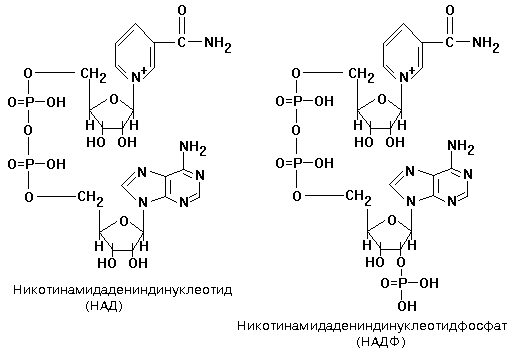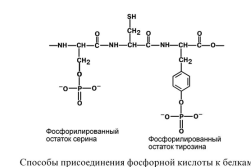
Фосфопротеины в качестве простетической группы содержат остатки фосфорной кислоты. Белковая часть (гидроксильные группы тирозина, серина или треонина) и фосфорная кислота образуют сложноэфирную связь.

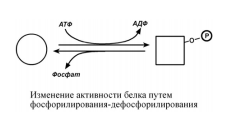
Фосфорилирование- процесс присоединения фосфорной кислоты к белку, осуществляется в посттрансляционный период. Фермент:протеинкиназа.
Обратный процесс- дефосфорилирование. Фермент:фосфатаза.
К белками этого класса относятся казеиноген молока; вителлин, вителлинин и фосвитин, выделенные из желтка куриного яйца; овальбумин, открытый в белке куриного яйца и др.
Казеин является фосфопротеидом, следовательно, фракции казеина содержат остатки фосфорной кислоты (органический фосфор), присоединенные к аминокислоте серину моноэфирной связью (О-Р)
ФП-основные протеины, входящие в состав нервной ткани, миелиновых волокон.
ФП присутствуют в каждой клетке нашего организма и являются питательными запасными белками.
Протеинкина́зы — подкласс ферментов киназ (фосфотрансфераз). Они модифицируют другие белки путем фосфорилирования остатков а\к, имеющих гидроксильные группы или гетероциклической аминогруппы гистидина.
Виды:
• Протеинкиназа А, или цАМФ-зависимая протеинкиназа, Состоит из 2-х регуляторных и 2-х каталитических СЕ. Регуляторные СЕ подавляют ферментативную активность комплекса. Для активации необходимо отделение регуляторных СЕ от комплекса. Мишени для протеинкиназы А - сердце.
Протеинкиназа А находится вблизи своих мишеней благодаря заякоривающим белкам
• Протеинкиназы С это семейство протеинкиназ, содержащее порядка десяти изоферментов, которые
классифицируют по вторичным посредникам на три семейства: 1)Традиционным (классическим) протеинкиназам С для активации требуется Ca2+, диацилглицерол или фосфатидилхолин. 2)Оригинальные протеинкиназы С активируются молекулами диацилглицерола, и не требуют Ca2+.
3) Нетипичные изоформы, не требуют ни Ca2+, ни диацилглицерола для активации.
- Протеинкиназа G цГМФ зависимые протеинкиназы (ПК-G) не способны к аутофосфорилированию.
Строение и функции клеточных мембран. Липидный состав и строение липидного бислоя. Белки мембран. Общие свойства мембран: жидкостность, кристалличность, асимметричность, избирательная проницаемость. Механизмы переноса веществ через мембраны: простая диффузия, первично активный транспорт (транспортные АТФ-азы), вторично активный транспорт (симпорт и антипорт). Мембранные белки-рецепторы, трансмембранная передача гормональных сигналов в клетку с помощью рецепторных комплексов.
Биологическая мембрана клетки является типичным примером липопротеинов клеток. Основа мембраны- липидный бислой, имеющий гидрофобные и гидрофильные части, между которому располагаются липиды. Липиды в биологических мембранах имеют одинаковое строение.
Белки различают:
-Периферические -располагаются на поверхности
-Интегральные - пронизывают липидный бислой
Функции данных белков: 1.структурная 2.ферментативная
3.транспортная или трансмембранный перенос 4.антигенная
Основные группы липидов в биологической мембране:фосфоглицериды,сфинголипиды и холестерин.
Свойства биомембраны:
1.Текучесть(жидкостность).Зависит от температуры: при уменьшении Tпревращаются в кристаллы. Также зависит от холестерина,т.е. чем его меньше,тем выше текучесть.
Температура плавления зависит:
а)чем больше остатков непредельных ЖК в составе липидов,тем температура плавления ниже
б)содержание холестерина в биомембране.Чем меньше холестерина,тем меньше температура плавления.
2.Асимметричность - наружный и внутренний слои отличаются по белково-липидному составу,плотности упаковки,рН среды и др. В наружном слое больше фосфотидилхолина(~70 % всех липидов),а во внутреннем слое больше фосфотидилсерина и тидилэтаноламина.
Гликолипиды или сфинголипиды образуются т/о на наружной поверхности мембраны.
3.Избирательная проницаемость: биомембраны являются своеобразными диэлектриками,поэтому ч/з них могут проникать соединения,растворимые в липидах,а что касается ионов водорастворимых соединений проникают с помощью специальных переносчиков(каналов).
Б/ря данному свойству снаружи и внутри мембраны м/б различный рН,различный градиент концентрации ионов Na,K,Ca,Cl.
4.Трансмембранный потенциал важен для передачи нервного возбуждения.
5.Динамичность- липиды биомембран постоянно передвигаются.
*Латеральная подвижность-боковые перемещения по одну сторону БМ.
*Вращательная диффузия- белки и липиды вращаются вокруг своей оси.
*Поперечная диффузия или перемещение фосфолипидов снаружи во внутрь или изнутри наружу - флип-флоп диффузия. Может осуществляться с помощью специальных белков,медленно(1-48 часов)
Флиппазы(внутрь),флоппазы(наружу),скрамблазы
ХСТ - исключение,легко проходит!
Транспорт:
а)Пассивный(без затраты энергии):-простая диффузия
-облегченная диффузия
б)Активный(с затратой энергии АТФ)
*Первичный активный транспорт.
Перенос некоторых неорганических ионов идёт против градиента концентрации при участии транспортных АТФ-аз (ионных насосов). Все ионные насосы одновременно служат ферментами, способными к аутофосфорилированию и аутодефосфорилированию. АТФ-азы различаются по ионной специфичности, количеству переносимых ионов, направлению транспорта. В результате функционирования АТФ-азы переносимые ионы накапливаются с одной стороны мембраны. Наиболее распространены в плазматической мембране клеток человека На+,К+-АТФ-аза, Са2+-АТФ-аза и Н+,К+,-АТФ-аза слизистой оболочки желудка.
Na+, К+-АТФ-аза
Этот фермент-переносчик катализирует АТФ-зависимый транспорт ионов Na+ и К+ через плазматическую мембрану. Nа+,К+-АТФ-аза состоит из субъединиц α и β; α - каталитическая большая субъединица, β - малая субъединица (гликопротеин). Активная форма транслоказы — тетрамер (αβ)2.
Na+,К+-АТФ-аза отвечает за поддержание высокой концентрации К+ в клетке и низкой концентрации Na+. Так как Nа+,К+-АТФ-аза выкачивает три положительно заряженных иона, а закачивает два, то на мембране возникает электрический потенциал с отрицательным значением на внутренней части клетки по отношению к её наружной поверхности.
Са2+-АТФ-аза
В цитозоле «покоящихся» клеток концентрация Са2+ составляет ~10'7 моль/л, тогда как вне клетки она равна ~2-10-3 моль/л. Поддерживает такую разницу в концентрации система активного транспорта ионов кальция; её основные компоненты — кальциевые насосы — Са2+-АТФ-азы и Na+,Ca2+ -обменники.
Са2+-АТФ-аза локализована не только в плазматической мембране, но и в мембране ЭР. Фермент состоит из десяти трансмембранных доменов, пронизывающих клеточную мембрану. Между вторым и третьим доменами находятся несколько остатков аспарагиновой кислоты, участвующих в связывании кальция. Область между четвёртым и пятым доменами имеет центр для присоединения АТФ и аутофосфорилирования по остатку аспарагиновой кислоты. Са2+-АТФ-азы плазматических мембран некоторых клеток регулируются белком кальмодулином. Каждая из Са2+-АТФ-аз плазматической мембраны и ЭР представлена несколькими изоформами.
Нарушение активности Са2+-АТФ-азы при патологии. Одна из причин нарушения работы

+Са2+-АТФ-азы — активация перекисного окисления липидов (ПОЛ) мембран. Окислению подвергаются как ацильные остатки жирных кислот в составе фосфолипидов, так и SH-группы в активном центре фермента. Нарушение структуры липидного окружения и структуры активного центра приводит к изменению конформации АТФ-азы, потере сродства к ионам кальция и способности к аутофосфорилированию. АТФ-аза перестаёт выкачивать ионы кальция из цитозоля клетки, повышается концентрация внутриклеточного кальция, Са2+ усиливает мышечное сокращение, возрастает тонус мышечной стенки, что приводит к повышению АД. Не последнюю роль нарушение функционирования Са2+-АТФ-азы играет в развитии атеросклероза, рака, иммунных патологий.
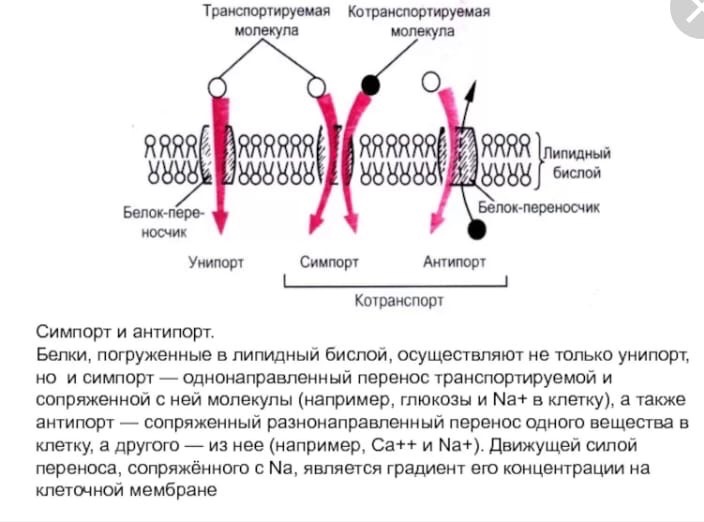
*Вторичный активный транспорт.
Перенос некоторых растворимых веществ против градиента концентрации зависит от одновременного или последовательного переноса другого вещества по градиенту концентрации в том же направлении (активный симпорт) или в противоположном (активный антипорт). В клетках человека ионом, перенос которого происходит по градиенту концентрации, чаще всего служит Na+.
Примером такого типа транспорта может служить Nа+,Са2+-обменник плазматической мембраны (активный антипорт), ионы натрия по градиенту концентрации переносятся в клетку, а ионы Са2+ против градиента концентрации выходят из клетки.
По механизму активного симпорта происходят всасывание глюкозы клетками кишечника и реабсорбция из первичной мочи глюкозы, аминокислот клетками почек. перенос через мембрану макромолекул И частиц: ЭНДОЦИТОЗ И ЗКОЦИТОЗ
Транспортные белки обеспечивают перемещение через клеточную мембрану полярных молекул небольшого размера, но они не могут транспортировать макромолекулы, например белки, нуклеиновые кислоты, полисахариды или ещё более крупные частицы. Механизмы, с помощью которых клетки могут усваивать такие вещества или удалять их из клетки, отличаются от механизмов транспорта ионов и полярных соединений.
Трансмембранная передача сигнала
Важное свойство мембран — способность воспринимать и передавать внутрь клетки сигналы из внешней среды. «Узнавание» сигнальных молекул осуществляется с помощью белков-рецепторов, встроенных в клеточную мембрану клеток-мишеней или находящихся в клетке. Клетку-мишень определяют по способности избирательно связывать данную сигнальную молекулу с помощью рецептора.
Если сигнал воспринимается мембранными рецепторами, то схему передачи информации можно представить так:
• взаимодействие рецептора с сигнальной молекулой (первичным посредником);
• активация мембранного фермента, ответственного за образование вторичного посредника;
• образование вторичного посредника цАМФ, цГМФ, ИФ3, ДАТ или Са2+;
• активация посредниками специфических белков, в основном протеинкиназ, которые, в свою очередь, фосфорилируя ферменты, оказывают влияние на активность внутриклеточных процессов.
Несмотря на огромное разнообразие сигнальных молекул, рецепторов и процессов, которые они регулируют, существует всего несколько механизмов трансмембранной передачи информации: с использованием аденилатциклазной системы, инозитолфосфатной системы, каталитических рецепторов, цитоплазматических или ядерных рецепторов.
сигнальные молекулы — гормоны, МЕДИАТОРЫ, ЭЙКОЗАНОИДЫ, ФАКТОРЫ РОСТА, NO)
Сигнальными молекулами могут быть неполярные и полярные вещества. Неполярные вещества, например стероидные гормоны, проникают в клетку, проходя через липидный бислой. Полярные сигнальные молекулы в клетку не проникают, но связываются специфическими рецепторами клеточных мембран. Такое взаимодействие вызывает цепь последовательных событий в самой мембране и внутри клетки. К полярным сигнальным молекулам относят белковые гормоны (например, инсулин), нейромедиаторы (например, АХ, ГАМК), факторы роста, цитокины, эйкозаноиды.
Рецепторы
По локализации различают мембранные, цитоплазматические и ядерные рецепторы. По другой классификации все рецепторы можно разделить на быстроотвечающие (в пределах мсек) и медленноотвечающие, в пределах нескольких минут или даже часов, что характерно для гормонов, передающих сигнал на внутриклеточные рецепторы.
Рецепторы первого типа — интегральные олигомерные белки, содержащие субъединицу, имеющую центр для связывания сигнальной молекулы и центральный ионный канал.
Рецепторы второго типа, локализованные в мембранах и не связанные с каналами, подразделяют на 2 большие группы: каталитические рецепторы, обладающие собственной тирозинкиназной или гуанилатциклазной активностью, и рецепторы, взаимодействующие через G-белок с мембранным ферментом. Связывание лиганда (например, гормона) с рецептором на наружной стороне клеточной мембраны приводит к изменению активности цитоплазматического фермента, который, в свою очередь, инициирует клеточный ответ, т.е. через мембрану переносится информация, а не заряды или какие-либо растворённые молекулы.
В случае цитоплазматических рецепторов через мембрану проходит гормон, а информация о присутствии гормона в клетке с помощью рецептора передаётся в ядро.
Различные клетки организма в зависимости от выполняемых ими функций имеют определённый набор рецепторов. В мембране одной клетки может быть более десятка разных типов рецепторов. Взаимодействуя с рецептором, внеклеточные химические посредники оказывают влияние на метаболизм и функциональное состояние (пролиферация, секреция и т.д.) клеток-мишеней.
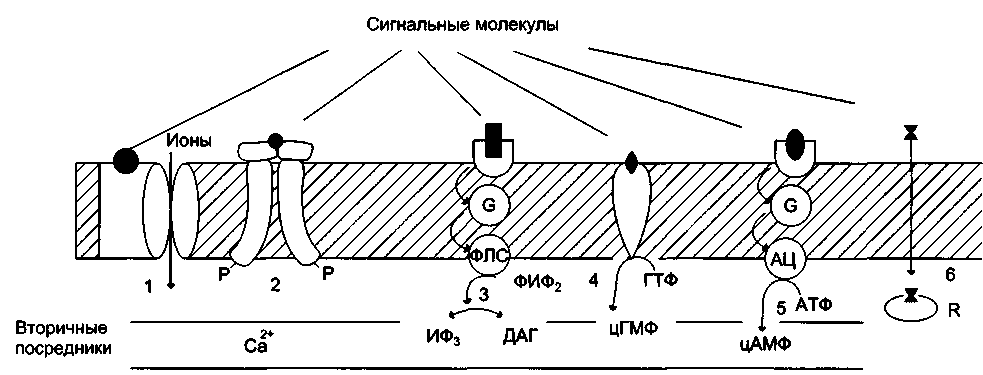 +Участие рецепторов в трансмембранной передаче сигнала. Рецепторы: 1 — связанные с ионными каналами, например рецептор ГАМК; 2— с каталитической активностью (рецептор инсулина); 3— передающие сигнал на фосфолипазу С, например α1-адренорецептор; 4 — с каталитической активностью (гуанилатциклаза, рецептор ПНФ); 5 — передающие сигнал на аденилатциклазу, например β-адренорецепторы; 6 — связывающие гормон в цитозоле или ядре, например рецептор кортизола.
+Участие рецепторов в трансмембранной передаче сигнала. Рецепторы: 1 — связанные с ионными каналами, например рецептор ГАМК; 2— с каталитической активностью (рецептор инсулина); 3— передающие сигнал на фосфолипазу С, например α1-адренорецептор; 4 — с каталитической активностью (гуанилатциклаза, рецептор ПНФ); 5 — передающие сигнал на аденилатциклазу, например β-адренорецепторы; 6 — связывающие гормон в цитозоле или ядре, например рецептор кортизола.
13. Липопротеины плазмы крови. Методы разделения липопротеинов плазмы крови, характеристика отдельных фракций: ХМ, ЛПОНП, ЛПНП, ЛПВП. Диагностическое значение их определения. Аполипопротеины.
| Липопротеины (ЛП) - сложные белки, содержащие в простетической группе разные липиды. Строение ЛП:гидрофобное ядро (ТАГ, ЭХС) и гидрофильный слой на поверхности (ФЛ, ХС, белки – апопротеины)
Белки в липопротеинах называются апобелками, их выделяют несколько видов: А, В, С, D. В каждом типе липопротеинов преобладают соответствующие ему апобелки. ЛП: *Простые(состоят из 3х элементов).Это ЖК, ХС, ТАГ *Сложные: включают в себя P,N,S. В фосфорсодержащих соединениях роль спиртовой группы выполняет глицерин. Также они содержат в составе холин,серин,инозиты. Все они называются фосфоглицериды.
| Сфинголипиды- содержат в роле спирта сфингозин. Сложные липиды встречаются в составе плазмы крови. 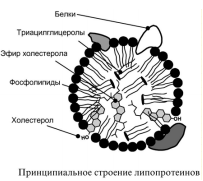
|
ЛП крови выполняют транспортную функцию. Они гетерогенны, т.е. их можно разделить с помощью электрофореза или ультрацентрифугирования.
Выделяют четыре основных класса липопротеинов:
- хиломикроны (ХМ),
- липопротеины высокой плотности (ЛПВП,á-липопротеины, á-ЛП),
- липопротеины низкой плотности (ЛПНП, â-липопротеины, â-ЛП),
- липопротеины очень низкой плотности (ЛПОНП, пре-â-липопротеины, пре-â-ЛП).
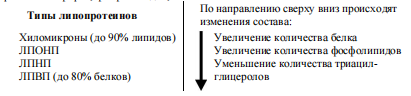
Липопротеины различаются по составу, т.е. по соотношению триацилглицеролов, холестерола и его эфиров, фосфолипидов, белков
ЛП сыворотки крови подразделяют на отдельные классы в зависимости от подвижности (с белками крови) и от плотности при ультрацентрифугировании. Различают ХМ, ЛПОНП, ЛПНП, ЛПВП.

Общая характеристика ХМ
1. Формируются в кишечнике из ресинтезированных жиров.
2. В их составе преобладают ТАГ (до 90%), мало белка, фосфолипидов и холестерола.
3. апоВ48, это структурный липопротеин. В плазме крови ХМ получают от ЛПВП белки апоС-II и апоЕ.
4. В норме натощак не обнаруживаются, в крови появляются после приема пищи, поступая из лимфы через грудной лимфатический проток, и исчезают через 10-12 часов.
5. Не атерогенны.
Функция
Транспорт экзогенных ТАГ из кишечника в ткани, запасающие или использующие жиры, в основном, в жировую ткань, миокард, скелетные мышцы, лактирующую молочную железу, в меньшей степени в костный мозг, легкие, почки, селезенку. На эндотелии капилляров этих тканей есть Е- липопротеинлипаза.
Общая характеристика ЛПОНП
1. Синтезируются в печени из эндогенных и экзогенных липидов,
2. В их составе преобладают ТАГ, около 40% от массы составляют белки, ФЛ и ХС.
3. апоВ-100, выполняющий структурную функцию
4. В норме концентрация 1,3-2,0 г/л,
5. Слабо атерогенны.
Функция
Транспорт эндогенных и экзогенных ТАГ от печени в ткани, запасающие и использующие жиры.
Общая характеристика ЛПНП
1. Образуются в гепатоцитах denovo и в сосудистой системе печени под воздействием печеночной ТАГ-липазы из ЛПОНП.
2. примерно 25% - белки, немного меньше половины составляет холестерин, остальное ФЛ и ТАГ.
3. апоВ-100.
4. Самые атерогенные.
Функция
1. Транспорт холестерола
2. Транспорт полиеновых жирных кислот в виде эфиров ХС
Общая характеристика ЛПВП
1. Образуются в печени denovo, в плазме при распаде хиломикронов, мало в стенке кишечника.
2. В составе частицы примерно половину занимают белки, еще четверть ФЛ, ХС и ТАГ.
3. апо А1.
4. Антиатерогенные.
Функция
1. Транспорт свободного ХС от тканей к печени.
2. Фосфолипиды ЛПВП являются источником полиеновых кислот для синтеза клеточных фосфолипидов и эйкозаноидов.
История учения о ферментах. Сходство и отличие ферментов и неорганических катализат-в. Классификация и номенклатура ферментов. Классы, подклассы, подподклассы. Примеры.
Ферменты – это биологические катализаторы белковой природы.
Катализаторы – это вещества, принимающие участие в химических реакциях, ускоряя их, но сами в них не расходующиеся. Ферменты катализируют химические реакции, происходящие в организме.
Учение о ферментах выделено в самостоятельную науку – энзимологию. Термин «энзим» (от греч. en zyme – в дрожжах), так же, как и «фермент» (от лат. fermentatio – брожение), означает процесс, связанный с выделением газов, брожением.
1783 г – Спалланцани доказал, что переваривание пищи – химический процесс, а не механический. Этими работами положил начало развитию энзимологии (конец 18 века)
I научное представление о ферментах - 1814 г., К.С. Кирхгоф нашел и объяснил действие амилазы.
В XIX в. Луи Пастер, изучая превращение углеводов в этиловый спирт под действием дрожжей, пришел к выводу, что этот процесс кат-ся некой жизненной силой, находящейся в дрожжевых кл-х (феномен брожения).
В 1897 году Э. Бюхнер опубликовал работу «Спиртовое брожение без дрожжевых клеток», в которой экспериментально показал, что бесклеточный дрожжевой сок осуществляет спиртовое брожение так же, как и неразрушенные дрожжевые клетки (выделил дрожжевой фермент зимазу).
Сходства ферментов и катализаторов:
1. Катализируют энергетически возможные реакции.
2. Энергия химической системы остается постоянной.
3. В ходе катализа направление реакции не изменяется.
4. Не расходуются в процессе реакции.
Отличия ферментов от катализаторов:
1. Скорость ферментативной реакции выше.
2. Обладают высокой специфичностью.
3. Реакции проходят в физиологических условиях: 37 оС, р, рН.
Классификация и номенклатура ферментов.
Классификация ферментов осуществляется по типу катализируемой реакции и ее механизму, выделяют 7 классов: (2018 г.):
I. ОКСИДОРЕДУКТАЗЫ - ферменты, катализирующие окислительно-восстановительные реакции. Класс насчитывает 22 подкласса. Примером подклассов могут служить ферменты, действующие на СН-ОН-группу, на СН-СН-группу, на СН-NН2-группу и на гемсодержащие доноры. На подподклассы деление производится в зависимости от акцептора – НАД+ или НАДФ+, дисульфиды, кислород.
*дегидрогеназы, редуктазы, оксидазы, пероксидазы, монооксигеназы, диоксигеназы.
II. ТРАНСФЕРАЗЫ - катализируют реакции переноса химических групп с молекулы одного вещества на молекулу другого вещества. В подклассы выделяются в зависимости от состава переносимой группы (одноуглеродные фрагменты, альдегидные и кетогруппы, фосфорсодержащие, азотсодержащие группы). На подподклассы деление производится в зависимости от вида переносимой группы – метил, карбоксиметил или формил, аминогруппы.
*С1-трансферазы, амино-трансферазы, гликозил-трансферазы, фосфо-трансферазы.
III. ГИДРОЛАЗЫ - катализируют реакции разрушения химических связей с участием воды. Примером подклассов служат группы ферментов, действующие на сложные эфиры, на простые эфиры, на пептиды, на углерод-углеродные связи. Гидролазы представлены ферментами ЖКТ (пепсин, трипсин, липаза, амилаза и другие) и лизосомальными ферментами. Осуществляют распад макромолекул, образуя легко адсорбируемые мономеры.
*эстеразы, пептидазы, гликозидазы, амидазы
IV. ЛИАЗЫ - катализируют реакции разрушения химических связей без участия воды. Выделяют 7 подклассов. Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту двойной связи. Лиазы являются сложными ферментами. Коферментами служат пиридоксальфосфат, тиаминдифосфат, участвует магний, кобальт. Примером подклассов являются ферменты, например, действующие на углерод-углеродные связи, углерод-кислородные связи, углерод-азотные связи. Среди подподклассов выделяют карбоксилиазы, гидролиазы
*С-С-лиазы, С-О-лиазы, C - N лиазы
V. ИЗОМЕРАЗЫ - катализируют реакции изомерных превращений. Подклассы выделяют в зависимости от типа реакции. Например, выделяют рацемазы (обратимое превращение L- и D-стереоизомеров) и эпимеразы (превращения D,L-изомеров, -D-глюкозу), другие b-D-глюкозу в a имеющих более одного центра асимметрии, например, подклассы – цис-транс-изомеразы, внутримолекулярные трансферазы (мутазы), внутримолекулярные оксидоредуктазы. Среди подподклассов выделяют действующие на аминокислоты и их производные, на углеводы и их производные, перемещающие С=С-связи
*цис-транс-изомеразы, внутримолекулярные трансферазы, эпимеразы
VI. ЛИГАЗЫ (СИНТЕТАЗЫ) - катализируют реакции синтеза. Примером подклассов служат группы ферментов по виду образуемой связи: углерод-кислород, углерод-сера, углерод-азот, углерод-углерод. Среди подподклассов выделяют ферменты, синтезирующие соединения типа кислота-тиол, амиды.
* образование С-С, С-О, C - S, C - N связей
VII. ТРАНСЛОКАЗЫ – переносят ионы через мембраны.
Номенклатура
1) Существует тривиальная номенклатура – названия сложившееся исторически. Например, пепсин, трипсин. Для некоторых ферментов к названию субстрата добавляется окончание "-аза" – уреаза, амилаза, липаза.
2) Рабочая номенклатура – название фермента составляется из названия субстрата или продукта реакции, типа катализируемой реакции и окончание –аза, например лактат-де-гирогеназа.
3) Систематическая, научная - L-лактат-НАД-оксидредуктаза.
4) По классификации ферментов каждый фермент имеет свой шифр, который записывается 4 цифрами, например фермент
Алкогольдегидрогеназа: 1.1.1.1.
Лактатдегидрогеназа 1.1.1.27
Обозначения цифр:
· 1-класс
· 2-подкласс
· 3-подподкласс
· 4- порядковый номер
Например, шифр уреазы выражается цифрами 3.5.1.5. Это означает, что уреаза относится к 3-му классу (первая цифра) ферментов, все представители которого катализируют реакции гидролиза. Вторая цифра (5) говорит о том, что уреаза принадлежит к 5-му подклассу этого класса, куда зачислены все ферменты, ускоряющие гидролиз С - N-связей, не являющихся пептидными. Третья цифра шифра (1) указывает на принадлежность уреазы к подподклассу 5-го подкласса, члены которого ускоряют гидролиз линейных амидов, а последняя цифра (5) - порядковый номер уреазы в этом подподклассе.
15. Современные представления о химической природе и строении ферментов. Активный (каталитический) и аллостерический центры. Ферменты-протеины и ферменты-протеиды. Химическая природа и структура коферментов: НАД, НАДФ, ФАД, ФМН, КоАSH, ГДФ, пиридоксальфосфат, ТГФК.
По хим. пр ферменты – это белки, они имеют несколько уровней структурной организации. Очень большое количество ферментов не имеют 4-ую структуру, т.е. являются олигомерами.
Свойства ферментов:
-амфотерность (могут существовать в растворе в виде анионов, катионов и амфионов);
-электрофоретическая подвижность благодаря наличию в них положительных и отрицательных зарядов,
-в изоэлектрической точке не обнаруживают подвижности в эл. поле.
-неспособны к диализу через полупроницаемые мембраны.
-легко осаждаются из водных растворов при низких температурах методами высаливания или осторожным добавлением ацетона, этанола и других веществ и при этом не теряют своих каталитических свойств.
Строение ферментов
Существуют два типа ферментов.
1) Ферменты — простые белки, состоят только из аминокислот (пепсин, трипсин, РНКаза и др.). (Ферменты-протеины)
2) Ферменты — сложные белки. (Ферменты-протеиды) Имеют в своем составе белковую часть, состоящую из аминокислот – апофермент, и небелковую часть – кофактор.
Примером сложных ферментов являются сукцинатдегидрогеназа (содержит ФАД), аминотрансферазы (содержат пиридоксальфосфат),различные пероксидазы (содержат гем), лактатдегидрогеназа (содержит Zn2+), амилаза (содержит Ca2+).
Кофакторы являются:
а) орг. вещ-ми — производными витаминов (т.е. коферментами) и др. соединениями (гем, глутатион);
б) ионами металлов Mg, Cu, Mo, Zn, Fe.
Активный центр ферментов
Под активным центром подразумевают уникальную комбинацию аминокислотных остатков в молекуле фермента, обеспечивающую непосредственное связывание ее с молекулой субстрата и прямое участие в акте катализа.. Расположен в узком гидрофобном углублении (щели) поверхности молекулы фермента. Установлено, что у сложных ферментов в состав активного центра входят также простетические группы.
В активном центре условно различают:
1- каталитический центр, непосредственно вступающий в химическое взаимодействие с субстратом.
2- связывающий центр, или контактную («якорную») площадку, которая отвечает за связывание и ориентацию субстрата в активном центре, обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом.
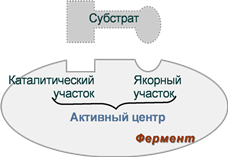
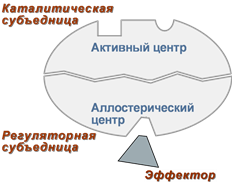
Схема строения фермента Схема строения аллостерического фермента
Аллостерический центр
(allos – чужой) – центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы, называемой активатором или ингибитором вызывает изменение конфигурации белка-фермента и, как следствие, скорости ферментативной реакции.
Аллостерические ферменты являются полимерными белками, активный и регуляторный центры находятся в разных субъединицах.
Химическая природа и структура коферментов: НАД, НАДФ, ФАД, ФМН, КоАSH, ГДФ, пиридоксальфосфат, ТГФК.
Коферменты в каталитических реакциях осуществляют транспорт различных групп атомов, электронов или протонов. Коферменты связываются с ферментами:
- ковалентными связями;
- ионными связями;
- гидрофобными взаимодействиями и т.д.
Один кофермент может быть коферментом для нескольких ферментов. Многие коферменты являются полифункциональными (например, НАД, ПФ). В зависимости от апофермента зависит специфичность холофермента.
Все коферменты делят на две большие группы: витаминные и невитаминные.
Коферменты витаминной природы – производные витаминов или химические модификации витаминов.
1 группа: тиаминовые – производные витамина В1. Сюда относят:
- тиаминмонофосфат (ТМФ);
-тиаминдифосфат (ТДФ) или тиаминпирофосфат (ТПФ) или кокарбоксилаза;
- тиаминтрифосфат (ТТФ).


ТПФ имеет наибольшее биологическое значение. Входит в состав декарбоксилазы кетокислот: ПВК, a-кетоглутаровая кислота. Этот фермент катализирует отщепление СО2.
Кокарбоксилаза участвует в транскетолазной реакции из пентозофосфатного цикла.
2 группа: флавиновые коферменты, производные витамина В2. Сюда относят:
- флавинмононуклеотид (ФМН);
- флавин аденин динуклеотид (ФАД).
Ребитол и изоалоксазин образуют витамин В2. Витамин В2 и остаток фосфорной к-ты образуют ФМН. ФМН в соединении с АМФ образуют ФАД.
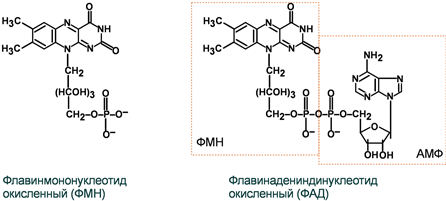
ФАД и ФМН являются коферментами дегидрогеназ. Эти ферменты катализируют отщепление от субстрата водорода, т.е. участвуют в реакциях окисления–восстановления. Например СДГ – сукцинатдегидрогеназа – катализирует превращение янтарной к-ты в фумаровую.
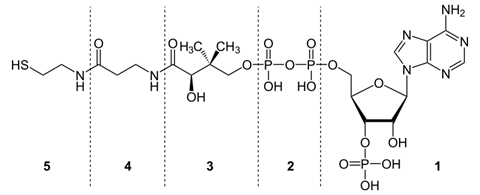
3 группа: пантотеновые коферменты, производные витамина В3 – пантотеновой кислоты. Входят в состав кофермента А, НS-КоА.
Кофермент А (коэнзим А, КоА, СоА, HSKoA) - кофермент ацетилирования; один из важнейших коферментов, принимающий участие в реакциях переноса ацильных групп при синтезе и окислении жирных кислот и окислении пирувата в цикле лимонной кислоты.
Молекула КоА состоит из остатка адениловой кислоты (1), связанной пирофосфатной группой (2) с остатком пантотеновой кислоты (3), которая в свою очередь связанна пептидной связью с аминокислотой в-аланином (4) (эти две группы представляют собой остаток пантотеновой кислоты), соединённой пептидной связью с остатком в-меркаптоэтаноламина (5).
4 группа: никотинамидные, производные витамина РР - никотинамида:
Представители:
- никотин-амид-аденин-динуклеотид (НАД);
- никотин-амид-аденин-динуклеотид-фосфат (НАДФ).
НАД, NAD -- кофермент, входит в состав ферментов группы дегидрогеназ, катализирующих ОВР; выполняет функцию переносчика электронов и водорода, которые принимает от окисляемых веществ. Восстановленная форма (NADH) способна переносить их на другие вещества.
Это динуклеотид, молекула которого построена из амида никотиновой кислоты и аденина, соединённых между собой цепочкой, состоящей из двух остатков D-рибозы и двух остатков фосфорной кислоты; применяется в клинической биохимии при определении активности ферментов крови.
НАДФ, NADP - кофермент некоторых дегидрогеназ - ферментов, катализирующих ОВР в живых клетках. NADP принимает на себя водород и электроны окисляемого соединения и передаёт их на другие вещества. В хлоропластах растительных клеток NADP восстанавливается при световых реакциях фотосинтеза и затем обеспечивает водородом синтез углеводов при темновых реакциях.
NADP, -- кофермент, отличающийся от NAD содержанием ещё одного остатка фосфорной кислоты, присоединённого к гидроксилу одного из остатков D-рибозы, обнаружен во всех типах клеток.
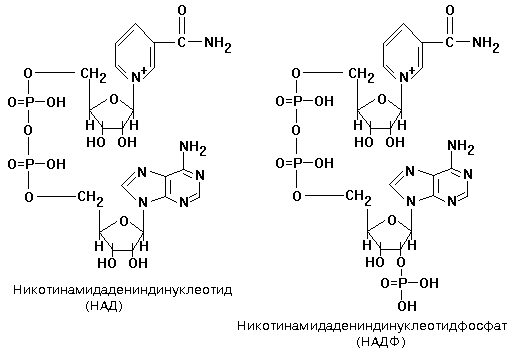
5 группа: пиридоксиновые, производные витамина В6.
| Пиридоксальфосфат (PLP) — наиболее важный кофермент в метаболизме а\к. Ф* принимает участие и в других реакциях аминокислот, таких, как декарбоксилирование и дегидратирование.
| 
|
6 группа: фоливые коферменты
Коферментные функции фолиевой кислоты связаны не со свободной формой витамина, а с восстановленным его птеридиновым производным. Восстановление сводится к разрыву двух двойных связей и присоединению четырех водородных атомов в положениях 5, 6, 7 и 8 с образованием тетрагидрофолиевой кислоты (ТГФК). Оно протекает в 2 стадии в животных тканях при участии специфических ферментов, содержащих восстановленный НАДФ. Сначала при действии фолат-редуктазы образуется дигидрофолиевая кислота (ДГФК), которая при участии второго фермента – дигидрофолат-редуктазы – восстанавливается в ТГФК:
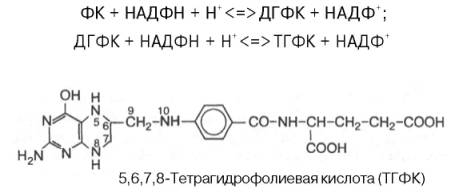
Коферменты невитаминной природы – вещества, которые образуются в процессе метаболизма.
1) Нуклеотиды – УТФ, УДФ, ТТФ и т.д. УДФ-глюкоза вступает в синтез гликогена.
УДФ-гиалуроновая к-та используется для обезвреживания различных веществ в трансверных реакциях (глюкоуронил трансфераза).
Гуанозин-дифосфат (ГДФ, GDP,) — нуклеотид, эфир пирофосфорной кислоты с гуаниловым нуклеозидом. ГДФ состоит из пирофосфата, сахара пентозы рибозы и азотистого основания гуанина.
ГДФ:
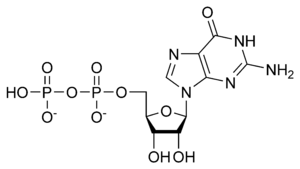
2) Производные порфирина (гем): каталаза, пероксидаза, цитохромы и т.д.
3) Пептиды. Глутатион – это трипептид (ГЛУ-ЦИС-ГЛИ), он участвует в ОВР, является коферментом оксидоредуктаз (глутатионпероксидаза, глутатионредуктаза). 2GSH«(над стрелкой 2Н) G-S-S-G. GSH является восстановленной формой глутатиона, а G-S-S-G – окисленной.
4) Ионы металлов, например Zn2+ входит в состав фермента АлДГ (алкогольдегидрогеназы), Cu2+ - амилазы, Mg2+ - АТФ-азы (например, миозиновой АТФ-азы).
16. Ферменты. Изменения энергетической диаграммы реакции при участии ферментов. Понятие о механизме действия холинэстеразы. Специфичность ферментов. Виды специфичности. Теории специфичности.
Ферменты – это биологические катализаторы белковой природы.
Катализаторы – это вещества, принимающие участие в химических реакциях, ускоряя их, но сами в них не расходующиеся. Ферменты катализируют химические реакции, происходящие в организме.
Изменение энергетической диаграммы при участии фермента:
Для осуществления химической реакции необходимо, чтобы реагирующие вещества имели суммарную энергию выше, чем величина, называемая энергетическим барьером реакции.
Согласно общепринятым представлениям о механизме ферментативного катализа, субстрат S и фермент E находятся в равновесии с очень быстро образующимся фермент-субстратным комплексом FE, который сравнительно медленно распадается на продукт реакции P с выделением свободного фермента; т.о., стадия распада фермент-субстратного комплекса на продукты реакции является скоростьопределяющей (лимитирующей).
Исследование зависимости скорости ферментативной реакции от концентрации субстрата при неизменной концентрации фермента показали, что с увеличением концентрации субстрата скорость реакции сначала увеличивается, а затем перестает изменяться.
Характерной особенностью действия ферментов является также высокая чувствительность активности ферментов к внешним условиям – рН среды и температуре. Ферменты активны лишь в достаточно узком интервале рН и температуры, причем для ферментов характерно наличие в этом интервале максимума активности при некотором оптимальном значении рН или температуры; по обе стороны от этого значения активность ферментов быстро снижается.
Механизм действия ферментов







 +Участие рецепторов в трансмембранной передаче сигнала. Рецепторы: 1 — связанные с ионными каналами, например рецептор ГАМК; 2— с каталитической активностью (рецептор инсулина); 3— передающие сигнал на фосфолипазу С, например α1-адренорецептор; 4 — с каталитической активностью (гуанилатциклаза, рецептор ПНФ); 5 — передающие сигнал на аденилатциклазу, например β-адренорецепторы; 6 — связывающие гормон в цитозоле или ядре, например рецептор кортизола.
+Участие рецепторов в трансмембранной передаче сигнала. Рецепторы: 1 — связанные с ионными каналами, например рецептор ГАМК; 2— с каталитической активностью (рецептор инсулина); 3— передающие сигнал на фосфолипазу С, например α1-адренорецептор; 4 — с каталитической активностью (гуанилатциклаза, рецептор ПНФ); 5 — передающие сигнал на аденилатциклазу, например β-адренорецепторы; 6 — связывающие гормон в цитозоле или ядре, например рецептор кортизола.