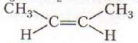Задание 1. Для вещества С5Н10 циклопентан построить изомеры, используя три вида изомерии и дать названия по систематической номенклатуре.
Задание 2. Получить двумя способами метилциклопропан.
Задание 3. Охарактеризовать химические свойства метилциклобутана и написать уравнения химических реакций. Дать названия полученным веществам.
Непредельные углеводороды. Алкены.Алкадиены. Алкины.
(Олефины).
| Углеводороды
| Характеристика веществ
|
| Общая формула
| Представитель
| Число связей
|
| Алкены
| СnH2n
| CH2 = CH2
| Одна двойная связь
|
| Алкадиены
| СnH2n-2
| CH2 = CH- СH = CH2
| Две двойные связи
|
| Алкины
| СnH2n-2
| 
| Одна тройная связь
|
Алкены– Это непредельные УВ, в молекулах которых содержится одна двойная связь.
Гомологический ряд
1. C2H4этен этилен CH2 = CH2
2. C3H6пропен CH2 = CH – CH3 
3. C4H8 бутен CH2 = CH – CH2 – CH3
4. C5H10пентен CH2 = CH – CH2 – CH2 – CH3 Общая формула С nH2n
Cтроениеалкенов. Строение молекулы этилена.
1. Атом С находится в состоянии SP2
2. Угол между связями = 120 º
3. Пи-связь располагается перпендикулярно сигма связи.
4. Длина двойной связи короче одинарной и = 0,134 нм.
5. Так как ядра всех атомов находятся в одной плоскости, следовательно молекула этилена – плоская.
Изомерия и номенклатура
1. Углеродную цепь нумеруют с той стороны, к которой ближе двойная связь.
2. В главную цепь обязательно должна входить двойная связь, даже если она не самая длинная.
А) 6 5 4 3 2 1 б) 1 2 3 4 5 6 в) 5 4 3 2 1
C – C – C – C – C = C C – C = C – C – C – CC – C – C = C – C
│ │7 │ │
C – C – C С C C
3- пропилгексен– 1гептен – 2 3, 4 – диметилпентен– 2
Изомерия
1. Изомерия углеродного скелета (см.примеры выше б) и в):
Количество атомов С= 7, но разное строение молекул.
2. Изомерия положения двойной связи:
1 2 3 4 1 2 3 4
CH2= CH – CH2 – CH3 CH3 – CH = CH – CH3
бутен – 1 бутен -2
3. Изомерия между классами органических соединений (алкены и циклоалканы)
CH2= CH – CH2 – CH3CH2─ CH2
бутен – 1 │ │
СH2 ─ CH2
Циклобутан
4. Пространственная изомерия (цис- транс изомерия) CH3 – CH = CH – CH3
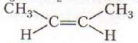

Цис – форма Транс – форма
Если заместители находятся по одну сторону от двойной связи, то это Цис – изомеры, если по разные, то это Транс – изомеры.
Получение: В промышленности:
1. Крекинг алканов нефти при нагревании до 400 - 700º С.
С8Р18→С4H10 + C4H8
октанбутан бутен
2. Дегидрирование алканов
CH3 – CH2 –CH3 → CH2 = CH – CH3 + H2
Пропан пропен
В лаборатории:
1. Дегидратация спиртов при нагревании с водоотнимающим средством H2SO4
CH3 – CH2 – OH → CH2= CH2 + H2O
Этанол этен
2. Дегидрирование моногалогеналканов под действием спиртовых растворов щелочей
CH3 – CH2 – Br + NaOH → CH2= CH2 + NaBr+ H2O
бромэтан этен
CH3 – CH2 – CH – CH3 + NaOH →CH3 – CH = CH – CH3 + NaBr + H2O
│ бутен - 2
Br
2-бромбутан
Правило Зайцева: Водород отщепляется от наименее гидрированного атома углерода.
3. Дегалогенированиедигалогеналканов при нагревавниис активными металлами
CH2 – CH – CH3 + Mg → CH2= CH – CH3 + MgBr2
│ │ пропен
Br Br
1,2 – дибромпропан
Химические свойства этилена
Электронная плотность Пи- связи подвижна и легко вступает в реакции присоединения с электрофильными частицами (с «+» заряженными ионами).
Электрофильная частица (H+) взаимодействует с Пи-связью и образует Пи копмлекс, который потом превращается в карбо- катион:
H H A
│ + │ │
─ С = C ─ + H+ → ─ C ─ C ─ A ─ →─ C ─ C ─
│ ││ │ │ │
Карбо - катион взаимодействует с анионом (с «─» заряженными ионами), образуя новую сигма – связь.
Реакция присоединения
1.1. Гидрирование: CH2= CH2 + H2 → CH3 – CH3
1.2. Галогенирование: CH2= CH2 + Br2 → CH2Br – CH2Br
1.3. Гидрогалогенирование: а) CH2= CH2 +HBr → CH3 – CH2Br
б)CH2= CH – СH3 +HBr → CH3 – CHBr – CH3
(реакция б) идет по правилу Марковникова)
1.4. Гидратации (в присутствии минеральных кислот)CH2= CH2 + H2O → CH3 – CH2 – OH
Этанол-спирт
1.5. Полимеризации: n CH2= CH2→Р.Т.К→(─ СH2─ CH2─)n
Этенполиэтен
Реакция окисления
2.1. Реакция горения: C2H4 + 3O2 →2 CO2 + 2 H2O
2.2. Этилен обесцвечивает раствор перманганата калия и бромной воды:
CH2= CH2 + 2KMnO4 + 4H2O→ 3 CH2 – CH2 + 2KOH + 2 MnO2
│ │
OH OH
Этиленгликоль (в производства антифризов, лавсана, взрывчатых веществ)
2.3. Каталитическое окисление при нагреве до 200ºС.
2 CH2= CH2 + O2 → 2 CH2─ CH2
\ ̸
O (оксид этилена)