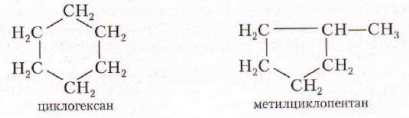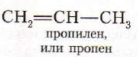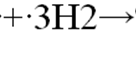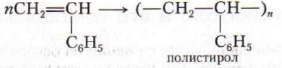Углеводороды (УВ).
Углеводороды – это органические вещества, состоящие только из атомов углерода и водорода.
| Классификация углеводородов
|
| Ациклические
(алифатические)
(незамкнутые цепи)
| Циклические
(замкнутые цепи)
|
| Предельные
(насыщенные углеводороды имеют только одинарные связи)Алканы
| Непредельные
(ненасыщенные углеводороды имеют двойные и тройные связи)Алкены.
Алкадиены.
Алкины
| Ароматические
Арены
| Алициклические
Циклоалканы
|
|
CH3-CH2-CH3
|
CH2=CH-CH3
CH2=CH-CH=CH2
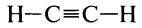
| 
| 
|
Предельные углеводороды.Алканы
(насыщенные, парафины, улеводороды ряда метана)
Алканы – Это углеводороды до предела насыщенные атомами водорода, в молекулах которых все связи одинарные.
Гомологический ряд алканов.
1. CH4 – метан CH4 газt кип. = – 161,6 ºС
2. C2H6 – этанCH3 – CH3 газ
3. C3H8 – пропан CH3 – CH2 – CH3 газ
4. C4H10 – бутан CH3 – CH2 – CH2 – CH3 газ
5. C5H12– пентан CH3 – CH2 – CH2- CH2 – CH3жидкостьt кип. = +36,07 ºС
6. C6H14 – гексан CH3 – CH2 – CH2 – CH2 – CH2 – CH3 жидкость
7. C7H16 – гептан CH3 – CH2 – CH2 – CH2 – CH2 – CH2 – CH3 жидкость
8. C8H18–октан CH3 – (CH2)6 – CH3
9. C9H20– нонан CH3 – (CH2)7 – CH3
10. C10H22 – декан CH3 – (CH2)8 – CH3
Общая формула алканов: CnH2n+2
Гомологи – вещества, которые отличаются друг от друга на одну или несколько групп атомов –CH2 (группа атомов - CH2 называется «гомологическая разность»).
Номенклатура алканов
Номенклатура – это система названий. Правила систематической номенклатуры разработаны комиссией при международном союзе по теоретической и прикладной химии (IUPAC)
| Номенклатура
|
| Тривиальная
| Рациональная
| Международная, (систематическая)
|
| Метан, этан, изобутан
| триметилметан
| 2.3 –диметилпентан
|
*В дальнейшем названия органическим соединениям будем давать согласно международной номенклатуре, в отдельных случаях будем использовать тривиальную номенклатуру.
Чтобы пользоваться международной номенклатурой, необходимо подробно ознакомиться с понятием «радикал» и явлением изомерии.
Радикал – частица с одним неспаренным электроном, которая образуется при симметричном разрыве химической связи.
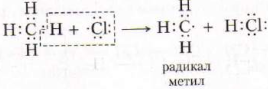
Названия радикалов образуются от названий соответствующих предельных УВ, с заменой суффикса – ан на – ил и называются алкилами.
Гомологический ряд алкилов.
- CH3 метил Общая формула алкилов CnH2n+1
- С2 H5 этил
- C3H7 пропил
- C4H9 бутил
- C5H11пентил
- C6H13гексил
Составление названий предельных углеводородов по правилу:
· Выбираем длинную цепь атомов углерода и нумеруем с того конца, к которому ближе разветвление:
· В начале названия ставим цифры, от которых отходят разветвления (радикалы), затем суммируем одинаковые радикалы (2-ди; з-три; 4- тетра; 5-пента и …) и в конце читаем пронумерованную цепь.
Пример:
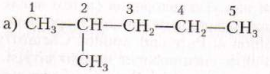

2 – метилпентан 2,2 – диметилбутан
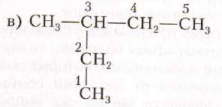
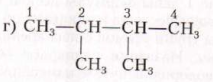
3-метилпентан 2,3 –диметилбутан
Задание: Назовите вещества:
Упр.1

Упр.2 Изобразите структурную формулу:
А) 2.2.4 –триметилпентан;
Б) 3 – метил – 3 – этилпентан;
В) п – бутан (п – нормальное строение…без разветвлений)
Метан. CH4
Метан – это простейший представитель гомологического ряда алканов.
Связи в молекуле ковалентные слабо-полярные. Кристаллическая решетка – молекулярная.
Пространственное строение молекулы метана. (см. тему «Химическая связь», раздел - неорганическая химия).
1. В молекуле метана 4- сигма связи;
2. Атом С находится в Sp3 – гибридизации;
3. Угол между осями гибридных облаков = 109º28;
4. Длина связи 0,154 нм.;
5. Молекула метана имеет форму тетраэдра.
Физические свойства метана: газ без цвета и запаха, почти в 2 раза легче воздуха, малорастворим в воде.
D возд.(СH4) – относительная плотность метана по воздуху.
D возд.(СH4)= Mr(CH4) / Mr(возд) = 16/29
Метан называют болотным газом, рудничным, нефтяным, природным.
Получение метана.
В промышленности:
1. Из природного газа в котором содержится 90% метана;
2. Синтез из угля и водорода: C + 2H2 (при t =400º P,k) → CH4
3. Реакция Фишера- Тропша. Метан получают из синтез – газа:
CO + 3H2 (300º P, K) →CH4 + H2O
nCO + (2n+1) H2=CnH2n+2 + nH2O
4. Метан образуется при гниении органических остатков. Это перспективный способ переработки бытовых отходов для микробиологической промышленности.
В лаборатории:
1. Гидролиз карбида алюминия: Al4C3 + 12 H-OH → 4Al(OH)3 + 3CH4
2. Реакция Дюма. Сплавление ацетата натрия со щелочами:
CH3COONa + NaOH → CH4 + Na2CO3
CnH2n+1COONa+NaOH=CnH2n+2 + Na2CO3
Химические свойства метана.
При обычных условиях алканы химически инертны (малоактивны), т.к. связи в молекулах очень прочные.
1. Реакция окисления.
1.1. Горение. При полном сгорании метана образуется углекислый газ и вода,а при неполном – угарный газ и сажа. CH4 + 2O2 = CO2 + 2 H2O
1.2. Каталитическое окисление. В присутствии катализатора при окислении метана образуются различные кислородсодержащие соединения:
2CH4 + O2(t,k) →2 CH3-OH (метиловый спирт) R-OH Алканолы
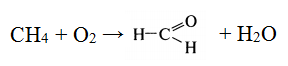 (муравьиный альдегид)
(муравьиный альдегид) 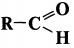 Альдегиды
Альдегиды
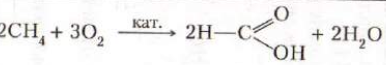 (муравьиная к-та)
(муравьиная к-та) 
2. Метан не обесцвечивает бромную воду и раствор перманганата калия. Это качественная реакция.
CH4 + Br2 → (не протекает)
CH4 + KMnO4 → (не протекает)
3. Дегидрирование( отщепление водорода). При нагревании метана без доступа воздуха образуется ацетилен, а затем сажа и водород:
1 cтадия:2 CH4 (1500º) →C2H2 + 3H2
Ацетилен(этин)
2 стадия: C2H2 (tº) → 2C + H2
сажа
**  Структурная формула ацетилена. Класс алкины. Тройная связь.
Структурная формула ацетилена. Класс алкины. Тройная связь.
4. Реакция замещения.( протекает по свободно-радикальному механизму).
4.1. Галогенирование. Метан взаимодействует с галогенами при нагревании под действием ультрафиолетового облучения, образуя хлорметан,дихлорметан, трихлорметан, тетрахлорметани хлороводород.
1.стадия: CH4 + Cl2 →CH3Cl + HCl
2.стадия: CH3Сl + Cl2 →CH2Cl2+ HCl
3.стадия: CH2Cl2 + Cl2 →CHCl3 + HCl
хлороформ
4.стадия:CHCl3 + Cl2 → CCl4 + HCl
растворитель (четыреххлористый углерод)
Механизм цепной реакции (свободно-радикальный)
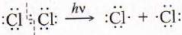
 затем радикал.метил снова взаимодействует с хлором и
затем радикал.метил снова взаимодействует с хлором и
все повторяется. Обрыв цепи может произойти, если исчезнуть свободные радикалы.
Получение алканов.
1. Основной источник УВ – природный газ, который содержит метан, этан, пропан, бутан, а также нефть и уголь.
2. Реакция Фишера – Тропша:
Пример: 4 CO + 9H2 →C4H10 + 4H2O (реакция горения бутана)п = 4
3. Гидрирование (присоединение водорода) непредельных УВпри tº и катализаторе.
CnH2n + H2 →CnH2n+2C4H8 + H2 →C4H10
алкеныалканыбутен бутан
CnH2n-2 + 2H2 → CnH2n+2C2H2 + 2H2 →C2H6
алкиныалканыэтин этан
Реакция Дюма.
Сплавление солей органических кислот(ацетата натрия) со щелочами:
CH3-CH2-COONa + NaOH →CH3-CH3 + Na2CO3
этилата натрия этан
Реакция Вюрца.
Нагревание галогеналканов с натрием:
CH3 – Br+ 2Na+ Br – CH3 →CH3 - CH3 + 2NaBr
бромметан бромметан этан
Окисление
C3H8 + 5O2 →3 CO2 + 4 H2O (горение)
пропан
1 2 3 4 5 6 7
1) CH3 – CH2 – CH2– CH2 – CH2– CH2– CH3 → (1 с 6)→ (метилбензол) + 4Н2
1 2 3 4 5 6 7
2) CH3 – CH2 – CH2– CH2 – CH2– CH2– CH3 → (1 с 5)→(этилциклопентан) + Н2
1 2 3 4 5 6 7
3) CH3 – CH2 – CH2– CH2 – CH2– CH2– CH3 → (1 с 4)→(пропилциклобутан) + H2
1 2 3 4 5 6 7
4) CH3 – CH2 – CH2– CH2 – CH2– CH2– CH3 → (2с4)→(метилпропилциклопропан)+H2
3. Крекинг – это расщепление УВ с образованием молекулы с меньшей молекулярной массой.
C8H18→C4H10 + C4H8; С4H10→C2H6 + C2H4; С4H10→CH4 + C3H6
октан бутан бутен; бутан этанэтен; бутанметанпропен
|
Крекинг
|
| Термический
| Каталитический
|
| 450 - 700º
| 400 - 500º С
|
| Р= 5-7 МПа
| Р= 7-8 МПа
|
| -
| Катализаторы: алюмосиликаты
|
| Состав: алканы, алкены
| Состав: только алканы
|
| Менее устойчив при хранении, так как легко окисляется и полимеризуется из – за Пи- связи в алкенах. Для устранения этого вредного действия к бензину добавляют антиокислители.
| Стоек при хранении, так как нет Пи –связи и нет процессов окисления и полимеризации.
|
| Высокое октановое число
| Высокое октановое число
|
4. Изомеризация – это процесс образования изомеров при нагревании алканов с определенными катализаторами.
С H3 – СH2 – СH2 – СH2 – СH3→ СH3 – СH – СH2 –С H3
│
С H3
пентан2-метилбутан
Реакция замещения
А) Галогенирования. Алканы взаимодействуют с галогенами под действием ультрафиолетового излучения или при нагревании, образуя галоген-алканы и галоген-водород.
Реакция идет по свободно-радикальному механизму и называется цепной.
ПРАВИЛО:
При галогенировании сначала замещается атом водорода у третичного атома углерода, затем у вторичного и в последнюю очередь у первичного.
Пример1.
1 2 3 4 1 2 3 4
СH3 – СH – СH2 –СH3 + Br2 → СH3 – СBr – СH2 –СH3 + HBr
│ │
С H3 CH3
2- метилбутан 2-бром-2-метилбутан
Пример 2.
СH3 CH3
│ │
СH3 – С – СH2 –СH3 + Br2 → СH3 – С – СHBr –СH3 + HBr
│ │
С H3 CH3
2,2 - диметилбутан2,2- диметил-3-бромбутан
Развитие цепных реакций связано с именем лауреата Нобелевской премии Николая Николаевича Семенова. 1956 г.
Б) Реакция нитрования (+ HO-NO2 Реакция Коновалова)
Алканы взаимодействуют с азотной кислотой (разбавленной) при нагревании и повышенном давлении, образуя нитроалканы и воду (см.правило)
Пример1.
1 2 3 4 1 2 3 4
СH3 – СH – СH2 –СH3 + HO-NO2 → СH3 – СNO2– СH2 –СH3 + H2O
│ │
С H3 CH3
2- метилбутан 2-нитро-2-метилбутан
Применение: Метан является исходным продуктом для получения:
Топлива, синтетического каучука, растворителей, типографской краски (сажа), резины, газа для резки и сварки металлов (ацетилен), синтетического бензина.
Циклоалканы
(циклопарафины, нафтены)
Циклоалканы – это предельные УВ, с общей формулой CnH2n
Важнейшие представители:
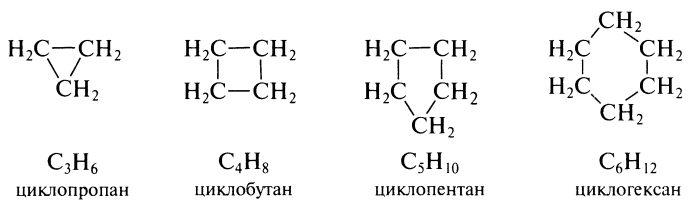
Особенности строения
1. Каждый атом углерода имеет 4 сигма связи, следовательно:
2. Каждый атом С находится в состоянии sp3 – гибридизации;
3. Угол между связями зависит от размера цикла. В простейших циклах (C3 –C5) углы сильно отличаются от 109º28, поэтому в таких молекулах возникает напряжение, следовательно связи между атомами легко разрываются и у таких веществ высокая реакционная способность.
4. Свободное вращение атомов углерода вокруг сигма связей невозможно.
Изомерия и номенклатура
1. Изомерия углеродного скелета:
C6H14
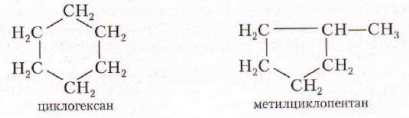
2. Изомерия между классами органических соединений (циклоалканы и алканы имеют одну одинаковую формулу CnH2n);
C3H6:
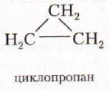
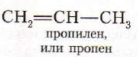
Физические свойства
1. Циклопропан и циклобутан – газы
2. От С5 – С 10 – жидкости, следующие – твердые;
3. T пл и кип. выше, чем у соответствующих алканов;
4. Не растворимы в воде, но растворимы в некоторых органических растворителях.
Получение
1. Получают из нефти (С5- С6);
2. Основной способ - это одновременное дегалогенирование и циклизация дигалогеналканов при нагревании с натрием или с магнием:
СH2 – СH2 – СH2 –СH2 + Mg →CH2─ CH2 + MgBr2
│ │ │ │
Br Br CH2─ CH2
1,4- дибромбутанциклобутан
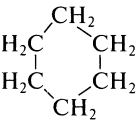
3. Каталитическое гидрирование ароматических УВ при нагревании и в присутствии катализаторов (Ni, Pt, Pd):

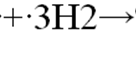

бензол циклогексан
Химические свойства.
1. Окисление. Циклоалканы ярко горят.
C6H12 + 9O2 →6CO2 + 6H2O
циклогексан
По химическим свойствам малые и большие циклы отличаются.
Малые циклы (С3 – С5) склонны к реакциям присоединения;
Большие циклы (С6) – к реакциям замещения.
2. Гидрирование (t,k)
CH2─ CH2
│ │ + H2 →СH3 – СH2 – СH2 –СH3
CH2─ CH2 бутан
циклобутан
3. А)Галогенирование (присоединение)
CH2─ CH2
│ │ + Br2 →СH2– СH2 – СH2 –СH2
CH2─ CH2 │ │
Br Br
1,2- дибромбутан
Б) Галогенирование (замещение)
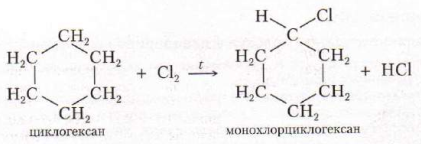
Дегидрирование (- H2)

С6H12→C6H6 + 3H2
5. Гидрогалогенирование (по правилу Марковникова)
Правило: Водород присоединяется к наиболее гидрированному атому углерода, а галоген – к наименее гидрированному.
СH3─CH─CH2
│ │ + HBr→ CH3- CH – CH2 – CH2 – CH2
CH2─ CH2 │ │
BrH
метилциклобутан 2-бромпентан
6. Как и алканы, циклоалканы не обесцвечивают бромную воду и раствор перманганата калия, но при действии сильных окислителей в определенных условиях реакция возможна.
Применение:
1. Циклопропан применяют в медецине для наркоза;
2. Циклогексан– для получения бензола;
3. Метилциклогексан – для получения толуола.
Химические свойства этилена
Электронная плотность Пи- связи подвижна и легко вступает в реакции присоединения с электрофильными частицами (с «+» заряженными ионами).
Электрофильная частица (H+) взаимодействует с Пи-связью и образует Пи копмлекс, который потом превращается в карбо- катион:
H H A
│ + │ │
─ С = C ─ + H+ → ─ C ─ C ─ A ─ →─ C ─ C ─
│ ││ │ │ │
Карбо - катион взаимодействует с анионом (с «─» заряженными ионами), образуя новую сигма – связь.
Реакция присоединения
1.1. Гидрирование: CH2= CH2 + H2 → CH3 – CH3
1.2. Галогенирование: CH2= CH2 + Br2 → CH2Br – CH2Br
1.3. Гидрогалогенирование: а) CH2= CH2 +HBr → CH3 – CH2Br
б)CH2= CH – СH3 +HBr → CH3 – CHBr – CH3
(реакция б) идет по правилу Марковникова)
1.4. Гидратации (в присутствии минеральных кислот)CH2= CH2 + H2O → CH3 – CH2 – OH
Этанол-спирт
1.5. Полимеризации: n CH2= CH2→Р.Т.К→(─ СH2─ CH2─)n
Этенполиэтен
Реакция окисления
2.1. Реакция горения: C2H4 + 3O2 →2 CO2 + 2 H2O
2.2. Этилен обесцвечивает раствор перманганата калия и бромной воды:
CH2= CH2 + 2KMnO4 + 4H2O→ 3 CH2 – CH2 + 2KOH + 2 MnO2
│ │
OH OH
Этиленгликоль (в производства антифризов, лавсана, взрывчатых веществ)
2.3. Каталитическое окисление при нагреве до 200ºС.
2 CH2= CH2 + O2 → 2 CH2─ CH2
\ ̸
O (оксид этилена)
Реакция тримеризации

Получение алкинов
1. Дегидрирование метана. При нагревании метана без доступа воздуха образуется ацетилен:2 CH4 (1500º) →C2H2 ↑+ 3H2
2. Гидролиз карбида кальция: СaC2 + H2O → C2H2 ↑+ Ca(OH)2
Получение алкадиенов
1. Дегидрирование бутана при t = 560 – 600 º C в присутствии катализаторов

2. Дегидрирование и дегидратация этилового спирта при t = 425º C и катализаторов Al2O3 и ZnO

Этот способ был разработан С.В.Лебедевым в 1932 году.
Строение бензола.
1. Варианты записи молекулы бензола С6H6:


Формула Кекуле Современная формула ФормулаКекуле
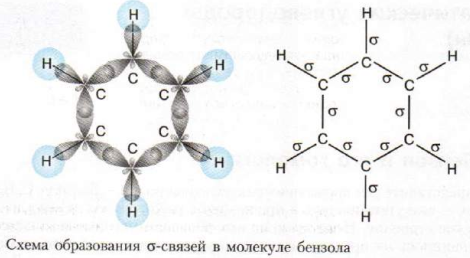
2. Атом С находится в состоянии SP2– гибридизации → три гибридных облака.
3. Угол между осями гибридных облаков= 120º
4. Последний P – электрон не затронут гибридизацией, его электронное облако формы «восьмерки» расположено перпендикулярно плоскости б – связей. При перекрывании этих р – облаков образуется единая Пи система (ядро), которая обозначается кругом, расположенным внутри бензольного кольца или тремя Пи – связями (формула Кекуле).
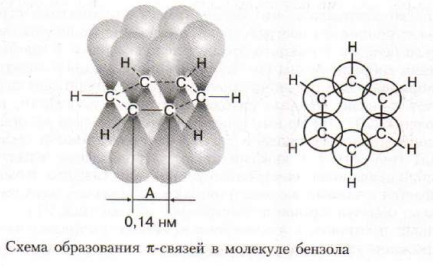
Вывод: Молекула бензола устойчива благодаря Длине связи = 0,139 = 0.140 нм, (это меньше чем у алканов(0,154 нм)) и сопряжению молекулы из-за Пи - связей(вид сопряженных связей C= C – C = C – как у алкадиенов) → Бензол более стоек к действию окислителей, реакции присоединения затруднены, а реакции замещения протекают легко.
Изомерия и номенклатура
Общая формула С n H2n-6
При замещении атомов водорода на радикалы, образуются гомологи бензола: 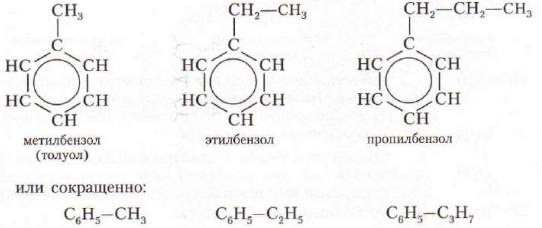


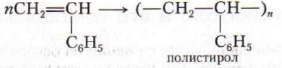
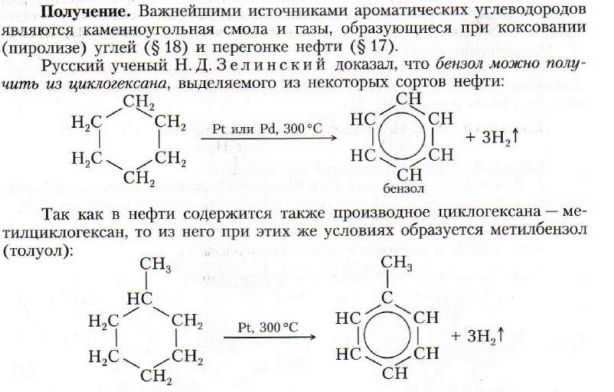
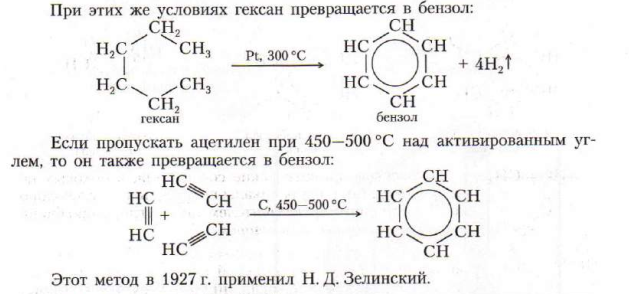
Получение
Реакция замещения
1.1. Галогенирования (при tº и К)
C6H6 + Br2 →C6H5Br + HBr
(реакция в молекулярном виде, запишите в структурном!)
1.2. Нитрования (в присутствии H2SO4)
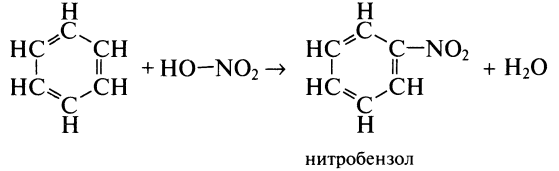
(реакция в структурном виде, запишите в молекулярном!)
1.3. Реакция Фриделя – Крафтса (действие на бензол галогеналкана при катализаторе AlCl3) 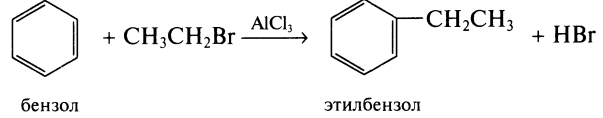
(реакция в структурном виде, запишите в молекулярном!)
Реакция присоединения
2.1. Реакция галогенирования
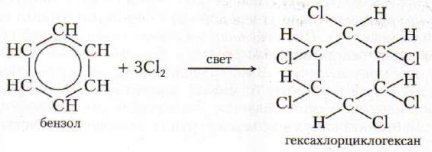
(реакция в структурном виде, запишите в молекулярном!)
2.2. Реакция гидрирования:
C6H6 + 3H2→ C6H12 (циклогексан)
(реакция в молекулярном виде, запишите в структурном!)
Углеводороды (УВ).
Углеводороды – это органические вещества, состоящие только из атомов углерода и водорода.
| Классификация углеводородов
|
| Ациклические
(алифатические)
(незамкнутые цепи)
| Циклические
(замкнутые цепи)
|
| Предельные
(насыщенные углеводороды имеют только одинарные связи)Алканы
| Непредельные
(ненасыщенные углеводороды имеют двойные и тройные связи)Алкены.
Алкадиены.
Алкины
| Ароматические
Арены
| Алициклические
Циклоалканы
|
|
CH3-CH2-CH3
|
CH2=CH-CH3
CH2=CH-CH=CH2
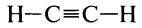
| 
| 
|
Предельные углеводороды.Алканы
(насыщенные, парафины, улеводороды ряда метана)
Алканы – Это углеводороды до предела насыщенные атомами водорода, в молекулах которых все связи одинарные.
Гомологический ряд алканов.
1. CH4 – метан CH4 газt кип. = – 161,6 ºС
2. C2H6 – этанCH3 – CH3 газ
3. C3H8 – пропан CH3 – CH2 – CH3 газ
4. C4H10 – бутан CH3 – CH2 – CH2 – CH3 газ
5. C5H12– пентан CH3 – CH2 – CH2- CH2 – CH3жидкостьt кип. = +36,07 ºС
6. C6H14 – гексан CH3 – CH2 – CH2 – CH2 – CH2 – CH3 жидкость
7. C7H16 – гептан CH3 – CH2 – CH2 – CH2 – CH2 – CH2 – CH3 жидкость
8. C8H18–октан CH3 – (CH2)6 – CH3
9. C9H20– нонан CH3 – (CH2)7 – CH3
10. C10H22 – декан CH3 – (CH2)8 – CH3
Общая формула алканов: CnH2n+2
Гомологи – вещества, которые отличаются друг от друга на одну или несколько групп атомов –CH2 (группа атомов - CH2 называется «гомологическая разность»).
Номенклатура алканов
Номенклатура – это система названий. Правила систематической номенклатуры разработаны комиссией при международном союзе по теоретической и прикладной химии (IUPAC)
| Номенклатура
|
| Тривиальная
| Рациональная
| Международная, (систематическая)
|
| Метан, этан, изобутан
| триметилметан
| 2.3 –диметилпентан
|
*В дальнейшем названия органическим соединениям будем давать согласно международной номенклатуре, в отдельных случаях будем использовать тривиальную номенклатуру.
Чтобы пользоваться международной номенклатурой, необходимо подробно ознакомиться с понятием «радикал» и явлением изомерии.
Радикал – частица с одним неспаренным электроном, которая образуется при симметричном разрыве химической связи.
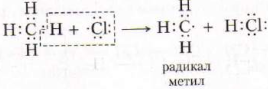
Названия радикалов образуются от названий соответствующих предельных УВ, с заменой суффикса – ан на – ил и называются алкилами.
Гомологический ряд алкилов.
- CH3 метил Общая формула алкилов CnH2n+1
- С2 H5 этил
- C3H7 пропил
- C4H9 бутил
- C5H11пентил
- C6H13гексил
Составление названий предельных углеводородов по правилу:
· Выбираем длинную цепь атомов углерода и нумеруем с того конца, к которому ближе разветвление:
· В начале названия ставим цифры, от которых отходят разветвления (радикалы), затем суммируем одинаковые радикалы (2-ди; з-три; 4- тетра; 5-пента и …) и в конце читаем пронумерованную цепь.
Пример:
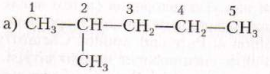

2 – метилпентан 2,2 – диметилбутан
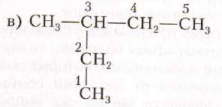
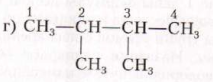
3-метилпентан 2,3 –диметилбутан
Задание: Назовите вещества:
Упр.1

Упр.2 Изобразите структурную формулу:
А) 2.2.4 –триметилпентан;
Б) 3 – метил – 3 – этилпентан;
В) п – бутан (п – нормальное строение…без разветвлений)
Метан. CH4
Метан – это простейший представитель гомологического ряда алканов.
Связи в молекуле ковалентные слабо-полярные. Кристаллическая решетка – молекулярная.
Пространственное строение молекулы метана. (см. тему «Химическая связь», раздел - неорганическая химия).
1. В молекуле метана 4- сигма связи;
2. Атом С находится в Sp3 – гибридизации;
3. Угол между осями гибридных облаков = 109º28;
4. Длина связи 0,154 нм.;
5. Молекула метана имеет форму тетраэдра.
Физические свойства метана: газ без цвета и запаха, почти в 2 раза легче воздуха, малорастворим в воде.
D возд.(СH4) – относительная плотность метана по воздуху.
D возд.(СH4)= Mr(CH4) / Mr(возд) = 16/29
Метан называют болотным газом, рудничным, нефтяным, природным.
Получение метана.
В промышленности:
1. Из природного газа в котором содержится 90% метана;
2. Синтез из угля и водорода: C + 2H2 (при t =400º P,k) → CH4
3. Реакция Фишера- Тропша. Метан получают из синтез – газа:
CO + 3H2 (300º P, K) →CH4 + H2O
nCO + (2n+1) H2=CnH2n+2 + nH2O
4. Метан образуется при гниении органических остатков. Это перспективный способ переработки бытовых отходов для микробиологической промышленности.
В лаборатории:
1. Гидролиз карбида алюминия: Al4C3 + 12 H-OH → 4Al(OH)3 + 3CH4
2. Реакция Дюма. Сплавление ацетата натрия со щелочами:
CH3COONa + NaOH → CH4 + Na2CO3
CnH2n+1COONa+NaOH=CnH2n+2 + Na2CO3
Химические свойства метана.
При обычных условиях алканы химически инертны (малоактивны), т.к. связи в молекулах очень прочные.
1. Реакция окисления.
1.1. Горение. При полном сгорании метана образуется углекислый газ и вода,а при неполном – угарный газ и сажа. CH4 + 2O2 = CO2 + 2 H2O
1.2. Каталитическое окисление. В присутствии катализатора при окислении метана образуются различные кислородсодержащие соединения:
2CH4 + O2(t,k) →2 CH3-OH (метиловый спирт) R-OH Алканолы
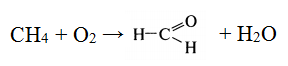 (муравьиный альдегид)
(муравьиный альдегид) 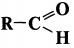 Альдегиды
Альдегиды
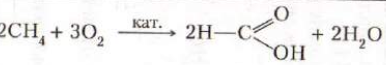 (муравьиная к-та)
(муравьиная к-та) 
2. Метан не обесцвечивает бромную воду и раствор перманганата калия. Это качественная реакция.
CH4 + Br2 → (не протекает)
CH4 + KMnO4 → (не протекает)
3. Дегидрирование( отщепление водорода). При нагревании метана без доступа воздуха образуется ацетилен, а затем сажа и водород:
1 cтадия:2 CH4 (1500º) →C2H2 + 3H2
Ацетилен(этин)
2 стадия: C2H2 (tº) → 2C + H2
сажа
**  Структурная формула ацетилена. Класс алкины. Тройная связь.
Структурная формула ацетилена. Класс алкины. Тройная связь.
4. Реакция замещения.( протекает по свободно-радикальному механизму).
4.1. Галогенирование. Метан взаимодействует с галогенами при нагревании под действием ультрафиолетового облучения, образуя хлорметан,дихлорметан, трихлорметан, тетрахлорметани хлороводород.
1.стадия: CH4 + Cl2 →CH3Cl + HCl
2.стадия: CH3Сl + Cl2 →CH2Cl2+ HCl
3.стадия: CH2Cl2 + Cl2 →CHCl3 + HCl
хлороформ
4.стадия:CHCl3 + Cl2 → CCl4 + HCl
растворитель (четыреххлористый углерод)
Механизм цепной реакции (свободно-радикальный)
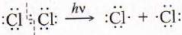
 затем радикал.метил снова взаимодействует с хлором и
затем радикал.метил снова взаимодействует с хлором и
все повторяется. Обрыв цепи может произойти, если исчезнуть свободные радикалы.
Получение алканов.
1. Основной источник УВ – природный газ, который содержит метан, этан, пропан, бутан, а также нефть и уголь.
2. Реакция Фишера – Тропша:
Пример: 4 CO + 9H2 →C4H10 + 4H2O (реакция горения бутана)п = 4
3. Гидрирование (присоединение водорода) непредельных УВпри tº и катализаторе.
CnH2n + H2 →CnH2n+2C4H8 + H2 →C4H10
алкеныалканыбутен бутан
CnH2n-2 + 2H2 → CnH2n+2C2H2 + 2H2 →C2H6
алкиныалканыэтин этан
Реакция Дюма.
Сплавление солей органических кислот(ацетата натрия) со щелочами:
CH3-CH2-COONa + NaOH →CH3-CH3 + Na2CO3
этилата натрия этан
Реакция Вюрца.
Нагревание галогеналканов с натрием:
CH3 – Br+ 2Na+ Br – CH3 →CH3 - CH3 + 2NaBr
бромметан бромметан этан



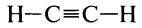


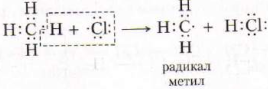
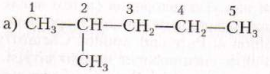

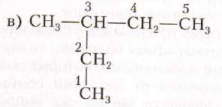
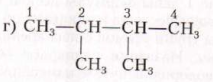

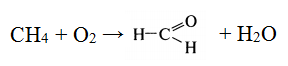 (муравьиный альдегид)
(муравьиный альдегид) 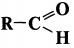 Альдегиды
Альдегиды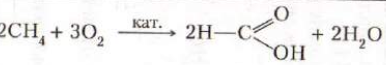 (муравьиная к-та)
(муравьиная к-та) 
 Структурная формула ацетилена. Класс алкины. Тройная связь.
Структурная формула ацетилена. Класс алкины. Тройная связь.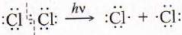
 затем радикал.метил снова взаимодействует с хлором и
затем радикал.метил снова взаимодействует с хлором и