Во́лны де Бро́йля — волны, связанные с любыми микрочастицами и отражающие их волновую природу.
Модель демонстрирует мысленный эксперимент по прохождению пучка электронов через узкую щель. Подлетая к экрану с щелью, частицы взаимодействуют с ней как волны де Бройля. Поведение частиц в пространстве между экраном с щелью и фотопластинкой описывается с помощью Ψ-функции. Квадрат модуля пси-функции определяет вероятность обнаружения частицы в том или ином месте. Таким образом, попадание частиц в различные точки фотопластинки является вероятностным процессом. Если бы частицы двигались вдоль определенных траекторий, то на фотопластинке частицы регистрировались бы только напротив щели (геометрическое изображение щели), но в действительности на пластинке наблюдается интерференционная картина (экспериментальное распределение). Можно изменять в некоторых пределах ширину щели и наблюдать дифракционное размытие электронного пучка на фотопластинке. Чтобы пучок стал хорошо виден, необходимо после нажатия кнопки "Запуск" подождать некоторое время.
ПРИНЦИП НЕОПРЕДЕЛЕННОСТИ 1927, физический закон, который утверждает, что нельзя одновременно точно измерить координаты и импульс микроскопического объекта, т.к. процесс измерения нарушает равновесие системы. Произведение этих двух неопределенностей всегда больше ПОСТОЯННОЙ ПЛАНКА. Этот принцип был впервые сформулирован Вернером Гейзенбергом.


где x, p,E, t - неопределенности (погрешности) измерения координаты, импульса, энергии и времени, соответственно; h - постоянная Планка.
Принцип неопределенности. Экспериментальные исследования свойств микрочастиц (атомов, электронов, ядер, фотонов и др.) показали, что точность определения их динамических переменных (координат, кинетической энергии, импульсов и т.п.) ограничена и регулируется открытым в 1927 г. В. Гейзенбергом принципом неопределенности. Согласно этому принципу динамические переменные, характеризующие систему, могут быть разделены на две (взаимно дополнительные) группы:
1) временные и пространственные координаты (t и q);
2) импульсы и энергия (p и E).
При этом невозможно определить одновременно переменные из разных групп с любой желаемой степенью точности (например, координаты и импульсы, время и энергию). Это связано не с ограниченной разрешающей способностью приборов и техники эксперимента, а отражает фундаментальный закон природы. Его математическая формулировка дается соотношениями:
Обычно достаточно точно указывают значение энергии микрочастицы, так как эта величина сравнительно легко определяется экспериментально.
Укажем примеры полных наборов(наборы одновреено измеримых величин),используемых для задания состояний, например, электрона и фотона. Каждый изнаборов включает четыре величины (в связи с этим говорят, что микрообъект имеетчетыре степени свободы). Для описания состояний электрона используютследующие наборы:
x, y, z, σ,
Δpx, Δpy, Δpz,σ,
E, l, m, σ
(напомним, что l,m, σ – соответственно орбитальное, магнитное испиновое квантовые числа). Подчеркнем, что координаты и составляющие импульсамикрообъекта (в данном случае электрона) попадают в разные полные наборывеличин; указанные физические величины одновременно неизмеримы. Именно поэтомуклассические соотношения E = p2/2m + U(r), M = (r. p) не работают припереходе к микрообъектам; ведь в каждое из этих соотношений входит икоордината, и импульс.
3
Волновая функция
Состояние частицы в классической механике задаётся радиус-вектором и импульсом. Что означает задать состояние? Это означает на столько охарактеризовать объект, чтобы дальше соответствующий раздел науки мог предсказать, как этот объект будет развиваться. Понятно, что смысл этих слов в различных разделах физики различен. Вот, мы недавно электричество рассматривали, что значит дать исчерпывающее описание объекта с точки зрения электричества? Надо дать распределение плотности заряда и плотности тока. Что значит задать состояние объекта с точки зрения теоретической механики? Это значит задать распределение масс, то есть плотность обычную, и напряжения. В квантовой механике мы не можем задать вот эти переменные.
Состояние частицы в квантовой механике задаётся волновой функцией 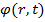 , то есть функцией координат и времени, заданной в каждой точке пространства, это комплексная функция. Значит, что вы должны уловить: в классической механике мы задаём координаты и импульс частицы, в квантовой механике этого сделать нельзя, а вот когда мы хотим охарактеризовать состояние частицы, мы должны задать вот такую функцию.
, то есть функцией координат и времени, заданной в каждой точке пространства, это комплексная функция. Значит, что вы должны уловить: в классической механике мы задаём координаты и импульс частицы, в квантовой механике этого сделать нельзя, а вот когда мы хотим охарактеризовать состояние частицы, мы должны задать вот такую функцию.
Волновая функция содержит исчерпывающую информацию о состоянии частицы, то есть она позволяет дать ответы на все разумные вопросы относительно характеристик частицы. Слово «разумные» я употребил тут не ради красного словца, а со смыслом. Дело в том, что те вопросы, которые в рамках классической механике выглядят и являются разумными, не являются разумными в квантовой механике. Ну, сейчас проиллюстрируем это дело. Волновая функция имеет такой смысл: это прежде всего комплексная функция, и  - это есть вероятность того, что частица будет обнаружена в окрестности точки, в элементе объёма
- это есть вероятность того, что частица будет обнаружена в окрестности точки, в элементе объёма  . Первое важное обстоятельство: предсказания в квантовой механике носят принципиально вероятностный характер, это означает, что законы природы на фундаментальном уровне носят вероятностный характер.
. Первое важное обстоятельство: предсказания в квантовой механике носят принципиально вероятностный характер, это означает, что законы природы на фундаментальном уровне носят вероятностный характер.
Это надо прокомментировать. Скажем, вопрос, где находится частица, является неразумным, на него не может быть дан ответ, потому что само понятие частица находится в какой-то точке оказывается лишённым смысла. Вот, молекулы воздуха тут летают, тоже вводится вероятностное описание (просто мы не можем уследить за каждой из этих молекул), мы знаем, что она где-то есть, но мы не знаем где она. Поставим ящик, мы можем рассчитать вероятность того, что она находится в ящике. Там вероятность это мера нашего незнания, в квантовой механике эта вероятность чисто реальная: пока мы частицу не обнаружили, она потенциально находится всюду, не то, что она где-то есть, а мы не знаем где, само представление, что она где-то есть, лишено смысла. Она потенциально находится всюду, где волновая функция отлична от нуля. А когда мы локализуем это (экран поставили, там электроны обнаруживаются), вот только в этом акте измерения это потенциальное нахождение всюду оно актуализируется. Есть разница в представлениях, что она где-то есть и мы не знаем где, и тем, что она потенциально всюду, пока мы её не поймали в этой точке. Ещё раз повторю, все фундаментальные законы носят вероятностный характер.
В прошлый раз мы остановились на обсуждении волновой функции и на такой формуле: 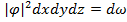 . Ещё раз повторю, что вот эта вещь (короче можно записать в таком виде|
. Ещё раз повторю, что вот эта вещь (короче можно записать в таком виде|  ) это вероятность того, что частица будет обнаружена в элементе объёма dV в окрестности точки. Волновая функция задана на всём пространстве, и вероятность обнаружения частицы в разных точках различна. Я уже говорил, ещё раз повторю, что в квантовой теории предсказания носят принципиально вероятностный характер, это связано не с тем, что частица по теории вероятности обнаружится, а с тем, что частица где-то есть, а мы не знаем где. Ситуация более драматичная: частица потенциально есть всюду, где
) это вероятность того, что частица будет обнаружена в элементе объёма dV в окрестности точки. Волновая функция задана на всём пространстве, и вероятность обнаружения частицы в разных точках различна. Я уже говорил, ещё раз повторю, что в квантовой теории предсказания носят принципиально вероятностный характер, это связано не с тем, что частица по теории вероятности обнаружится, а с тем, что частица где-то есть, а мы не знаем где. Ситуация более драматичная: частица потенциально есть всюду, где 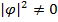 , и потом где-то она обнаруживается (что-то такое происходит, где-то там частица провзаимодействовала с чем-то).1)
, и потом где-то она обнаруживается (что-то такое происходит, где-то там частица провзаимодействовала с чем-то).1)
Если волновая функция частицы известна, то, очевидно, известно всё, что можно знать. Волновая функция исчерпывающе описывает состояние частицы, то есть может дать ответы на все разумные вопросы. Нюанс только в том, что вопросы, которые в рамках классической физики разумны, например, вопрос, где находится частица, разумный, он здесь оказывается неразумным, и ответ на него дать нельзя. Какие вопросы разумны, какие нет, мы дальше увидим по ходу дела, но в квантовой механике обнаружилось, что не на всякий вопрос, сформулированный на обыденном языке, может быть дан ответ.2) Нашей задачей будет научиться давать ответы на разумные вопросы. А пока двигаемся дальше.
Наличие в окружающем нас мире «противоестественных» (с классической точки зрения) состояний, объективность их существования подтверждены физическими экспериментами, и этот факт является прямым следствием одного из самых фундаментальных принципов квантовой механики — принципа суперпозиции состояний. Или лучше сказать наоборот: это неотъемлемое свойство природы нашло свое отражение в основном теоретическом принципе квантовой механики. Сформулировать его можно следующим образом.
Принцип суперпозиции состояний: если система может находиться в различных состояниях, то она способна находиться в состояниях, которые получаются в результате одновременного «наложения» друг на друга двух или более состояний из этого набора.
СУПЕРПОЗИЦИИ СОСТОЯНИЙ ПРИНЦИП -важнейший постулат квантовой механики, лежащий в основе её физ. содержания и матем. аппарата. Необходимость С. с. п. обусловлена корпускулярно-волновым дуализмом - всеобщим и универсальным свойством природы. С. с. п. позволяет устранить противоречие между волновым и корпускулярным описанием явлений (существовавшим в рамках классич. представлений о частицах как материальных точках, движущихся по определ. траекториям) и описать волновые явления в терминах корпускулярных представлений. Согласно С. с. п., линейная суперпозиция любых возможных состояний системы, взятых с произвольными (комплексными) коэф., является также возможным состоянием системы (подробнее см. в ст. Квантовая механика).
Уравне́ние Шрёдингера — уравнение, описывающее изменение в пространстве (в общем случае, в конфигурационном пространстве) и во времени чистого состояния, задаваемого волновой функцией, в гамильтоновых квантовых системах/ Его можно назвать уравнением движения квантовой частицы
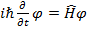 где
где 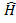 - оператор Гамильтона - аналог классической функции Гамильтона, в которой p и r заменены на операторы импульса p и координаты x.
- оператор Гамильтона - аналог классической функции Гамильтона, в которой p и r заменены на операторы импульса p и координаты x.

4
Свободная частица — частица, движущаяся в отсутствие внешних полей. Так как на свободную частицу (пусть она движется вдоль оси х) силы не действуют, то потенциальная энергия частицы U(x) = const и ее можно принять равной нулю. Тогда полная энергия частицы совпадает с ее кинетической энергией. В таком случае уравнение Шредингера (217.5) для стационарных состояний примет вид
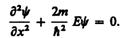 (219.1)
(219.1)
Прямой подстановкой можно убедиться в том, что частным решением уравнения (219.1) является функция y(х) = Аеikx, где А = const и k = const, с собственным значением энергии
 (219.2)
(219.2)
Функция представляет собой только координатную часть волновой функции Y(x, t). Поэтому зависящая от времени волновая функция, согласно (217.4),
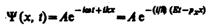 (219.3)
(219.3)
(здесь и). Функция (219.3) представляет собой плоскую монохроматическую волну де Бройля (см. (217.2)).
Из выражения (219.2) следует, что зависимость энергии от импульса

оказывается обычной для нерелятивистских частиц. Следовательно, энергия свободной частицы может принимать любые значения (так как волновое число k может принимать любые положительные значения), т. е. ее энергетический спектр является непрерывным.
Таким образом, свободная квантовая частица описывается плоской монохроматической волной де Бройля. Этому соответствует не зависящая от времени плотность вероятности обнаружения частицы в данной точке пространства
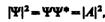 т. е. все положения свободной частицы в пространстве являются равновероятными.
т. е. все положения свободной частицы в пространстве являются равновероятными.
Гармонический осциллятор в квантовой механике представляет собой квантовый аналог простого гармонического осциллятора, при этом рассматривают не силы, действующие на частицу, а гамильтониан, то есть полную энергию гармонического осциллятора, причём потенциальная энергия предполагается квадратично зависящей от координат. Учёт следующих слагаемых в разложении потенциальной энергии по координате ведёт к понятию ангармонического осциллятора.
5
Атом водорода в квантовой механике
Уравнением движения микрочастицы в различных силовых полях является волновое уравнение Шредингера.
Для стационарных состояний уравнение Шредингера будет таким:

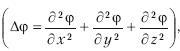 , m – масса частицы, h – постоянная Планка, E – полная энергия, U – потенциальная энергия.
, m – масса частицы, h – постоянная Планка, E – полная энергия, U – потенциальная энергия.
Уравнение Шредингера является дифференциальным уравнением второго порядка и имеет решение, которое указывает на то, что в атоме водорода полная энергия должна иметь дискретный характер:
E1, E2, E3…
Эта энергия находится на соответствующих уровнях n =1,2,3,…по формуле:
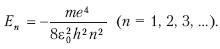
Самый нижний уровень E соответствует минимальной возможной энергии. Этот уровень называют основным, все остальные – возбужденными.
По мере роста главного квантового числа n энергетические уровни располагаются теснее, полная энергия уменьшается, и при n =E>0 электрон становится свободным, несвязанным с конкретным ядром, а атом – ионизированным.
Полное описание состояния электрона в атоме, помимо энергии, связано с четырьмя характеристиками, которые называются квантовыми числами. К ним относятся: главное квантовое число п, орбитальное квантовое число l, магнитное квантовое число m1, магнитное спиновое квантовое число ms.
трона в пространстве, то есть волновая функция в пространстве характеризуется тремя системами. Каждая из них имеет свои квантовые числа: п, l, ml.
Каждой микрочастице, в том числе и электрону, также свойственно собственное внутреннее сложное движение. Это движение может характеризоваться четвертым квантовым числом ms. Поговорим об этом подробнее.
A. Главное квантовое число п, согласно формуле, определяет энергетические уровни электрона в атоме и может принимать значения п = 1, 2, 3…
Б. Орбитальное квантовое число /. Из решения уравнения Шредингера следует, что момент импульса электрона (его механический орбитальный момент) квантуется, то есть принимает дискретные значения, определяемые формулой
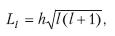 где Ll – момент импульса электрона на орбите, l – орбитальное квантовое число, которое при заданном п принимает значение i = 0, 1, 2… (n – 1) и определяет момент импульса электрона в атоме.
где Ll – момент импульса электрона на орбите, l – орбитальное квантовое число, которое при заданном п принимает значение i = 0, 1, 2… (n – 1) и определяет момент импульса электрона в атоме.
B. Магнитное квантовое число ml. Из решения уравнения Шредингера следует также, что вектор Ll (момент импульса электрона) ориентируется в пространстве под влиянием внешнего магнитного поля. При этом вектор развернется так, что его проекция на направление внешнего магнитного поля будет
Llz = hml
где ml называется магнитным квантовым числом, которое может принимать значения ml = 0, ±1, ±2,±1, то есть всего (2l + 1) значений.
Учитывая сказанное, можно сделать заключение о том, что атом водорода может иметь одно и то же значение энергии, находясь в нескольких различных состояниях (n – одно и то же, а l и ml– разные).
При движении электрона в атоме электрон заметно проявляет волновые свойства. Поэтому квантовая электроника вообще отказывается от классических представлений об электронных орбитах. Речь идет об определении вероятного места нахождения электрона на орбите, то есть местонахождение электрона может быть представлено условным «облаком». Электрон при своем движении как бы «размазан» по всему объему этого «облака». Квантовые числа n и l характеризуют размер и форму электронного «облака», а квантовое число ml– ориентацию этого «облака» в пространстве. 

Резкая серия(буква s является начальной буквой наименования серии: sharp — резкий).

Главная серия:(principal — главный), 
Диффузная серия:(diffuse — диффузный). 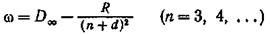
Основная серия (серия Бергмана)(fundamental — основной).: 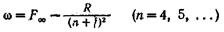
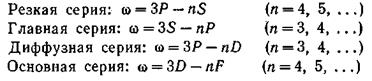

СПИНОВОЕ КВАНТОВОЕ ЧИСЛО - квантовое число, определяющее величину спина квантовой системы (атома, иона, атомного ядра, молекулы), т. е. её собств. (внутр.) момента кол-ва движения (момента импульса). Спиновый момент импульса s квантуется: его квадрат определяется выражением  , где s - С. к. ч. (называемое часто просто спином). Проекция вектора s на произвольное направление z также квантуется: для частиц с ненулевой массой
, где s - С. к. ч. (называемое часто просто спином). Проекция вектора s на произвольное направление z также квантуется: для частиц с ненулевой массой  (где ms - магнитное спиновое число), т. е. принимает 2s + 1 значений. Число s может принимать целые, нулевые или полуцелые значения.
(где ms - магнитное спиновое число), т. е. принимает 2s + 1 значений. Число s может принимать целые, нулевые или полуцелые значения.
6
Принцип неразличимости тождественных частиц в квантовой механике. Симметричные и антисимметричные состояния тождественных микрочастиц. Фермионы и бозоны. Принцип Паули.
Основа квантовой статистики – принципиальная неразличимость одинаковых частиц. Перестановка местами двух квантовых частиц не приводит к новому микросостоянию. Волновые ф-ии должны быть симметричными или антисимметричными по отношению к перестановке любой пары частиц, причем первый случай имеет место для частиц с целым спином, а второй с полуцелым. Для системы частиц, описывающейся антисимметричными ф-ями справедлив принцип Паули: в каждом квантовом состоянии может находиться одновременно не более одной частицы. Статистика, основанная на этом принципе, называется статистикой Ферми-Дирака. Частицы, подчиняющиеся этой статистике – фермионы. К их числу относят все частицы с полуцелым спином. Статистика Бозе-Эйнштейна, ктр. подчиняются частицы с целым спином. Частицы подчиняющиеся этой статистике – бозоны. Не выполняется принцип Паули; вероятность Р возникновения бозона в состоянии, в ктр. уже имеется n частиц, пропорциональна n. Обе статистики подчиняются принципу тождественности одинаковых микрочастиц.
Бозо́н (от фамилии физика Бозе) — частица с целым значением спина. Термин был предложен физиком Полем Дираком[1]. Бозоны, в отличие от фермионов, подчиняются статистике Бозе — Эйнштейна, которая допускает, чтобы в одном квантовом состоянии могло находиться неограниченное количество одинаковых частиц. Системы из многих бозонов описываются симметричными относительно перестановок частиц волновыми функциями. Различают элементарные бозоны и составные.
Фермио́н — частица (или квазичастица) с полуцелым значением спина. Своё название получили в честь физика Энрико Ферми.
Примеры фермионов: кварки (они образуют протоны и нейтроны, которые также являются фермионами), лептоны (электроны, мюоны, тау-лептоны, нейтрино), дырки (квазичастицы в полупроводнике)[1].
Фермионы подчиняются статистике Ферми — Дирака: в одном квантовом состоянии может находиться не более одной частицы (принцип Паули). Принцип запрета Паули ответственен за устойчивость электронных оболочек атомов, делая возможным существование сложных химических элементов. Он также позволяет существовать вырожденной материи под действием высоких давлений (нейтронные звёзды). Волновая функция системы одинаковых фермионов антисимметрична относительно перестановки двух любых фермионов. Квантовая система, состоящая из нечётного числа фермионов, сама является фермионом (например, ядро с нечётным массовым числом A; атом или ион с нечётной суммой A и числа электронов).
Порядок заполнения электронных состояний определяется двумя принципами:
принцип Паули: в атоме может быть только один электрон с данным набором квантовых чисел;
принцип минимума энергии: в основном состоянии атома электрон занимает квантовое состояние с наинизшей возможной энергией. Следует учесть, что вследствие взаимодействия электронов друг с другом значения энергии зависят не только от главного квантового числа n, но и от орбитального l.
При заполнении электронных слоёв атома в стационарном (невозбуждённом) состоянии выдерживается принцип наименьшей энергии электрона, в соответствии с которым
наиболее устойчивому состоянию электрона в атоме отвечает минимальная из возможных энергия этого электрона.
Поэтому заполнение электронных слоёв начинается с уровней, характеризующихся самой низкой энергией.
Русский учёный В. М. Клечковский установил, что энергия электрона возрастает по мере увеличения суммы главного и орбитального квантовых чисел (n + l). В соответствии с правилом Клечковского
заполнение электронных слоёв происходит в порядке увеличения сумм главного и орбитального квантовых чисел (n + l).
Рентгеновские спектры, возникающие при бомбардировке электронами антикатода рентгеновской трубки, бывают двух видов: сплошные и линейчатые. Сплошные спектры возникают при торможении быстрых электронов в веществе антикатода и являются обычным тормозным излучением электронов. Вид этих спектров не зависит от материала антикатода.
При повышении напряжения на трубке наряду со сплошным спектром появляется линейчатый. Он состоит из
Рис.13.5.
отдельных линий и зависит от материала антикатода. Каждый элемент обладает своим, характерным для него линейчатым спектром. Поэтому такие спектры называют характеристическими (рис. 13.5).
С увеличением напряжения на рентгеновской трубке коротковолновая граница сплошного спектра смещается, линии же характеристического спектра становятся лишь более интенсивными, не меняя своего расположения.
Особенности характеристических спектров.
1. В отличие от оптических линейчатых спектров с их сложностью и разнообразием, рентгеновские характеристические спектры различных элементов отличаются простотой и однообразием. С ростом атомного номера Z элемента они монотонно смещаются в коротковолновую сторону. Законы Стефана — Больцмана и смещения Вина Из закона Кирхгофа следует, что спектральная плотность энергетическое светимости черного тела является универсальное функцией, поэтому нахождение ее явной зависимости от частоты и температуры является важной задачей теории теплового излучения.
2. Характеристические спектры разных элементов имеют сходный характер (однотипны) и не меняются, если интересующий нас элемент находится в соединении с другими. Это можно объяснить лишь тем, что характеристические спектры возникают при переходах электронов во внутренних частях атома, частях, имеющих сходное строение.
3. Характеристические спектры состоят из нескольких серий: К, L, М,... Каждая серия — из небольшого числа линий: Ка, Кβ, Кγ,... La, Lβ, Ly,... и т. д. в порядке убывания длины волны λ.
7 
лектронная конфигурация в несколько атомов электронов определяется тремя факторами. а) привлечение из ядра б) отталкивание между электронами и в) выталкивающей силы оказываемого пространство материи (см. структуру атома). Когда атом находится в сильном электрическом поле, или магнитное поле, его электронная конфигурация смещается от своего первоначального состояния. То есть, из-за влияния внешнего поля, некоторые электроны в атоме (в основном, внешние электроны) смещаются от своего первоначального оболочек. Когда такой атом возбуждается, атом может излучать различных линий спектра по сравнению с оригинальной линии спектра. Этот эффект является прямым показанием для напряженности поля. То есть, при слабом поле влияет на внешние электроны только сильное поле может влиять как на внутренние и внешние электроны одинаково. Легких элементов может продемонстрировать этот эффект в слабом поле, чем сравнительно более тяжелые элементы, так как обязательную силу на электроны в легких элементов значительно меньше, чем у более тяжелых элементов.
Пашена — Бака эффект, эффект, состоящий в том, что в сильных магнитных полях сложное зеемановское расщепление спектральных линий переходит в простое (см. Зеемана эффект). Сильными следует считать магнитные поля, вызывающие зеемановское расщепление, сравнимое с мультиплетным расщеплением уровней энергии (см. Мультиплетность) и превосходящее его. В таких полях и происходит упрощение картины расщепления — вместо сложной картины наблюдается расщепление на 3 составляющие. П. — Б. э. впервые обнаружили немецкие физики Ф. Пашен и Э. Бак (Е. Back) в 1912.
Зеемана эффект, расщепление спектральных линий под действием магнитного поля. Открыто в 1896 П. Зееманом при исследовании свечения паров натрия в магнитном поле. Для наблюдения З. э. источник света, испускающий линейчатый спектр, располагается между полюсами мощного электромагнита (рис. 1). При этом каждая спектральная линия расщепляется на несколько составляющих. Расщепление весьма незначительно (для магнитных полей ~ 20 кэ составляет несколько десятых), поэтому для наблюдения З. э. применяют спектральные приборы с высокой разрешающей способностью.
Эффе́кт Зе́емана — расщепление линий атомных спектров в магнитном поле.
Обнаружен в 1896 г. Зееманом для эмиссионных линий натрия.
Эффект обусловлен тем, что в присутствии магнитного поля квантовая частица, обладающая спиновым магнитным моментом, приобретает дополнительную энергию  пропорциональную его магнитному моменту Приобретённая энергия приводит к снятию вырождения атомных состояний по магнитному квантовому числу и расщеплению атомных линий.
пропорциональную его магнитному моменту Приобретённая энергия приводит к снятию вырождения атомных состояний по магнитному квантовому числу и расщеплению атомных линий.
8
Химическая связь — явление взаимодействия атомов, обусловленное перекрыванием электронных облаков связывающихся частиц, которое сопровождается уменьшением полной энергии системы.
Энергетический уровень — собственные значения энергии квантовых систем, то есть систем, состоящих из микрочастиц (электронов, протонов и других элементарных частиц) и подчиняющихся законам квантовой механики. Каждый уровень характеризуется определённым состоянием системы, или подмножеством таковых в случае вырождения. Понятие применимо к атомам (электронные уровни), молекулам (различные уровни, соответствующие колебаниям и вращениям), атомным ядрам (внутриядерные энергетические уровни) и т.д.
Молекула — наименьшая частица вещества, состоящая из одинаковых или различных атомов, соединенных между собой химическими связями, и являющаяся носителем его основных химических и физических свойств. Химические связи обусловлены взаимодействием внешних, валентных электронов атомов. Наиболее часто в молекулах встречается два типа связи: ионная и ковалентная.
Ионная связь (например, в молекулах NaCl, KBr) осуществляется электростатическим взаимодействием атомов при переходе электрона одного атома к другому, т. е. при образовании положительного и отрицательного ионов. Ковалентная связь (например, в молекулах H2, С2, СО) осуществляется при обобществлении валентных электронов двумя соседними атомами (спины валентных электронов должны быть антипараллельны). Ковалентная связь объясняется на основе принципа неразличимости тождественных частиц, например электронов в молекуле водорода. Неразличимость частиц приводит к специфическому взаимодействию между ними, называемому обменным взаимодействием. Это чисто квантовый эффект, не имеющий классического объяснения, но его можно себе представить так, что электрон каждого из атомов молекулы водорода проводит некоторое время у ядра другого атома и, следовательно, осуществляется связь обоих атомов, образующих молекулу. При сближении двух водородных атомов до расстояний порядка боровского радиуса возникает их взаимное притяжение и образуется устойчивая молекула водорода.
Молекула является квантовой системой; она описывается уравнением Шредингера, учитывающим движение электронов в молекуле, колебания атомов молекулы, вращение молекулы. Решение этого уравнения — очень сложная задача, которая обычно разбивается на две: для электронов и ядер.
Энергия изолированной молекулы
(230.1)
где Еэл — энергия движения электронов относительно ядер, Екол — энергия колебаний ядер (в результате которых периодически изменяется относительное положение ядер), Евращ — энергия вращения ядер (в результате которых периодически изменяется ориентация молекулы в пространстве). В формуле (230.1) не учтены энергия поступательного движения центра масс молекулы и энергия ядер атомов в молекуле. Первая из них не квантуется, поэтому ее изменения не могут привести к возникновению молекулярного спектра, а вторую можно не учитывать, если не рассматривать сверхтонкую структуру спектральных линий. Отношения Еэл: Екол: Евращ = 1:: т/М, где т — масса электрона, М — величина, имеющая порядок массы ядер атомов в молекуле, т/М»10–5¸10–3. Поэтому Еэл >> Екол >> Евращ. Доказано, что Еэл»1¸10 эВ, Екол»10–2¸10–1 эВ, Евращ»10–5¸10–3 эВ.
Каждая из входящих в выражение (230.1) энергий квантуется (ей соответствует набор дискретных уровней энергии) и определяется квантовыми числами. При переходе из одного энергетического состояния в другое поглощается или испускается энергия DE=hn. При таких переходах одновременно изменяются энергия движения электронов, энергии колебаний н вращения. Из теории и эксперимента следует, что расстояние между вращательными уровнями энергии DEвращ гораздо меньше расстояния между колебательными уровнями DEкол которое, в свою очередь, меньше расстояния между электронными уровнями DEэл. На рис. 308 схематически представлены уровни энергии двухатомной молекулы (для примера рассмотрены только два электронных уровня — показаны жирными линиями).
9
Комбинационное рассеяние света (эффект Рамана) — неупругое рассеяние оптического излучения на молекулах вещества (твёрдого, жидкого или газообразного), сопровождающееся заметным изменением частоты излучения. В отличие от рэлеевского рассеяния, в случае комбинационного рассеяния света в спектре рассеянного излучения появляются спектральные линии, которых нет в спектре первичного (возбуждающего) света. Число и расположение появившихся линий определяется молекулярным строением вещества.
Спектроскопия комбинационного рассеяния света (или рамановская спектроскопия) — эффективный метод химического анализа, изучения состава и строения веществ.
комбинационное рассеяние света сокр., КР; КРС иначе эффект комбинационного рассеяния; рамановское рассеяние; эффект Рамана (англ. Raman effect или Raman scattering) — неупругое рассеяние света (с изменением частоты/длины волны), сопровождающееся переходами вещества между колебательными уровнями энергии.
Описание
Рассеяние света, при котором происходит обмен энергией между фотонами и веществом, называется неупругим рассеянием или комбинационным рассеянием (эффектом Рамана). Следствием изменения энергии фотонов является изменение длины волны (частоты) рассеянного света. Наблюдается также упругое рассеяние света веществом, без изменения энергии фотонов и, следовательно, длины световой волны. Пример упругого рассеяния — релеевское рассеяние света (эффект Релея).
Механизм комбинационного рассеяния (КР) поясняет рис. 1. Стоксово КР характеризуется тем, что в процессе взаимодействия с молекулой фотон отдает ей часть энергии. В результате такого процесса молекула переходит с уровня с меньшим значением энергии на уровень с более высоким значением энергии, а энергия рассеянного фотона уменьшается (длина волны увеличивается (рис. 1, слева)). Антистоксово КР характеризуется тем, что в процессе взаимодействия с молекулой, находящейся в возбужденном состоянии, энергия фотона увеличивается, а молекула переходит в состояние с меньшим значением энергии (рис. 1, справа). Для сравнения на рис. 1 в центре приведена диаграмма, соответствующая релеевскому рассеянию, когда обмена энергией между фотоном и молекулой не происходит. На рис. 1 б также показан виртуальный уровень энергии молекулы в поле световой волны (верхняя пунктирная линия).
Так как при термодинамическом равновесии заселенность уровней уменьшается с увеличением энергии, то при спонтанном КР частота антистосковых переходов меньше частоты стоксовых — поэтому интенсивность стоксовых линий КР в спектре выше. Стоксовы линии КР расположены в спектре с «красной» стороны (со стороны больших длин волн/меньших частот) от релеевской линии. Не все переходы между различными колебательными энергетическими уровнями возможны.
Интенсивность комбинационного рассеяния (КР) на 3–6 порядков ниже релеевского, поэтому для наблюдения КР спектров требуется интенсивный источник монохроматического излучения и высокочувствительный детектор. В настоящее время в качестве источников излучения, главным образом, используют лазеры. КР-спектроскопия может быть использована для изучения структуры и состава вещества, его взаимодействия с окружающей средой. Полосы комбинационного рассеяния можно характеризовать частотой, интенсивностью и степенью деполяризации излучения. При облучении оптически анизотропных молекул поляризованным светом рассеянный свет окажется частично деполяризованным.
Когда частота возбуждающего света приближается и совпадает с частотой оптического перехода системы, реализуется ситуация резонансного КР (РКР). Спектральные особенности КР света дают информацию о типе структуры и взаимодействии электронной и фононной подсистем в полупроводниках.
КР света в конденсированных средах обладает рядом особенностей, так как в твердых телах колебания молекул (атомов, ионов) сильно коррелированны и, в случае кристаллов, их следует рассматривать как колебания кристаллической решетки в целом.
Спектры КР света аморфных твердых тел более «размыты», чем кристаллических — из-за разупорядочения структуры и уменьшения областей пространственных корреляций между колебаниями частиц (рис. 2). Наблюдается заметное уширение линий и в КР спектрах твердых растворов и высокодефектных кристаллов.
К уширению линий спектров может приводить ориентационное разупорядочение твердых тел, связанное с вариациями ориентации молекул в молекулярных кристаллах, диполей в сильно полярных кристаллах, свободных электронных пар в ионах типа Pb2+. Смещение линий КР спектров силикатных стекол служит мерой степени полимеризации силикатных сеток.
Спектроскопия КР является очень информативным методом для исследования наноматериалов, в частности, углеродных нанотрубок: можно определить их геометрические параметры, тип проводимости и т. д.
При нагревании веществ интенсивность антистоксовых линий КР заметно возрастает (в отличие от стоксовых), что позволяет использовать этот эффект для измерения температуры (разработаны соответствующие волоконно-оптические датчики).
При возбуждении КР источниками большой мощности вероятность стоксова рассе<





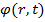 , то есть функцией координат и времени, заданной в каждой точке пространства, это комплексная функция. Значит, что вы должны уловить: в классической механике мы задаём координаты и импульс частицы, в квантовой механике этого сделать нельзя, а вот когда мы хотим охарактеризовать состояние частицы, мы должны задать вот такую функцию.
, то есть функцией координат и времени, заданной в каждой точке пространства, это комплексная функция. Значит, что вы должны уловить: в классической механике мы задаём координаты и импульс частицы, в квантовой механике этого сделать нельзя, а вот когда мы хотим охарактеризовать состояние частицы, мы должны задать вот такую функцию. - это есть вероятность того, что частица будет обнаружена в окрестности точки, в элементе объёма
- это есть вероятность того, что частица будет обнаружена в окрестности точки, в элементе объёма  . Первое важное обстоятельство: предсказания в квантовой механике носят принципиально вероятностный характер, это означает, что законы природы на фундаментальном уровне носят вероятностный характер.
. Первое важное обстоятельство: предсказания в квантовой механике носят принципиально вероятностный характер, это означает, что законы природы на фундаментальном уровне носят вероятностный характер.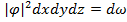 . Ещё раз повторю, что вот эта вещь (короче можно записать в таком виде|
. Ещё раз повторю, что вот эта вещь (короче можно записать в таком виде|  ) это вероятность того, что частица будет обнаружена в элементе объёма dV в окрестности точки. Волновая функция задана на всём пространстве, и вероятность обнаружения частицы в разных точках различна. Я уже говорил, ещё раз повторю, что в квантовой теории предсказания носят принципиально вероятностный характер, это связано не с тем, что частица по теории вероятности обнаружится, а с тем, что частица где-то есть, а мы не знаем где. Ситуация более драматичная: частица потенциально есть всюду, где
) это вероятность того, что частица будет обнаружена в элементе объёма dV в окрестности точки. Волновая функция задана на всём пространстве, и вероятность обнаружения частицы в разных точках различна. Я уже говорил, ещё раз повторю, что в квантовой теории предсказания носят принципиально вероятностный характер, это связано не с тем, что частица по теории вероятности обнаружится, а с тем, что частица где-то есть, а мы не знаем где. Ситуация более драматичная: частица потенциально есть всюду, где 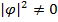 , и потом где-то она обнаруживается (что-то такое происходит, где-то там частица провзаимодействовала с чем-то).1)
, и потом где-то она обнаруживается (что-то такое происходит, где-то там частица провзаимодействовала с чем-то).1)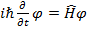 где
где 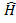 - оператор Гамильтона - аналог классической функции Гамильтона, в которой p и r заменены на операторы импульса p и координаты x.
- оператор Гамильтона - аналог классической функции Гамильтона, в которой p и r заменены на операторы импульса p и координаты x.
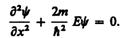 (219.1)
(219.1) (219.2)
(219.2)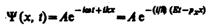 (219.3)
(219.3)
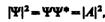 т. е. все положения свободной частицы в пространстве являются равновероятными.
т. е. все положения свободной частицы в пространстве являются равновероятными.
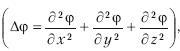 , m – масса частицы, h – постоянная Планка, E – полная энергия, U – потенциальная энергия.
, m – масса частицы, h – постоянная Планка, E – полная энергия, U – потенциальная энергия.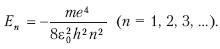
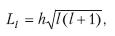 где Ll – момент импульса электрона на орбите, l – орбитальное квантовое число, которое при заданном п принимает значение i = 0, 1, 2… (n – 1) и определяет момент импульса электрона в атоме.
где Ll – момент импульса электрона на орбите, l – орбитальное квантовое число, которое при заданном п принимает значение i = 0, 1, 2… (n – 1) и определяет момент импульса электрона в атоме.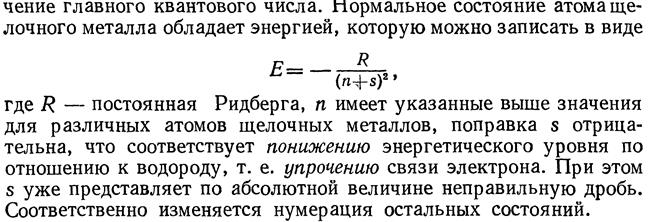



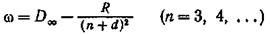
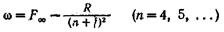
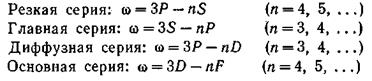

 , где s - С. к. ч. (называемое часто просто спином). Проекция вектора s на произвольное направление z также квантуется: для частиц с ненулевой массой
, где s - С. к. ч. (называемое часто просто спином). Проекция вектора s на произвольное направление z также квантуется: для частиц с ненулевой массой  (где ms - магнитное спиновое число), т. е. принимает 2s + 1 значений. Число s может принимать целые, нулевые или полуцелые значения.
(где ms - магнитное спиновое число), т. е. принимает 2s + 1 значений. Число s может принимать целые, нулевые или полуцелые значения.
 пропорциональную его магнитному моменту Приобретённая энергия приводит к снятию вырождения атомных состояний по магнитному квантовому числу и расщеплению атомных линий.
пропорциональную его магнитному моменту Приобретённая энергия приводит к снятию вырождения атомных состояний по магнитному квантовому числу и расщеплению атомных линий.


