ОСНОВНЫЕ ФОРМУЛЫ
Количество вещества
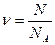 ,
,
где  – число частиц (атомов, молекул, ионов);
– число частиц (атомов, молекул, ионов); 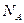 – постоянная Авогадро.
– постоянная Авогадро.
Молярная масса вещества
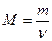 ,
,
где  – масса однородного тела;
– масса однородного тела;  – количество вещества этого тела.
– количество вещества этого тела.
Уравнение Менделеева-Клапейрона (уравнение состояния идеального газа)
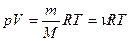 ,
,
где m – масса газа, M – молярная масса газа, R – молярная газовая постоянная,  – количество вещества, T – термодинамическая температура.
– количество вещества, T – термодинамическая температура.
Опытные газовые законы:
а) изотермический процесс (закон Бойля-Мариотта, T=const, m =const):
pV = const
б) изобарный процесс (закон Гей-Люссака, p =const, m =const):

в) изохорный процесс (закон Шарля, V=const, m =const):
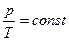
г) объединенный газовый закон (m =const):
 .
.
Основное уравнение кинетической теории газов
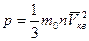 ,
,
где m 0 – масса одной молекулы, n – концентрация молекул,  – средняя квадратичная скорость.
– средняя квадратичная скорость.
Средняя кинетическая энергия поступательного движения молекулы
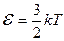 ,
,
где k – постоянная Больцмана.
Средняя полная кинетическая энергия молекулы
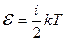 ,
,
где i – число степеней свободы молекулы.
Зависимость давления газа от концентрации молекул и температуры:
p = nkT.
Скорости молекул:
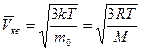 – средняя квадратичная;
– средняя квадратичная;
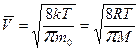 – средняя арифметическая;
– средняя арифметическая;
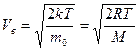 – наиболее вероятная,
– наиболее вероятная,
где m 0 – масса одной молекулы.
Удельные теплоемкости газа при постоянном объеме (с v) и постоянном давлении (с p)
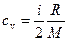 ,
, 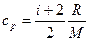 .
.
Связь между удельной c и молярной C теплоемкостями
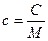 ,
,  .
.
Уравнение Майера:
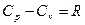 .
.
Внутренняя энергия идеального газа
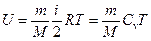 .
.
Первое начало термодинамики
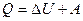 ,
,
где Q – теплота, сообщенная системе (газу); D U – изменение внутренней энергии системы; A – работа, совершенная системой против внешних сил.
Работа расширения газа:
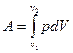 в общем случае;
в общем случае;
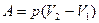 при изобарном процессе;
при изобарном процессе;
 при изотермическом процессе;
при изотермическом процессе;
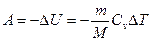 или
или 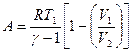 при адиабатном процессе, где
при адиабатном процессе, где  – показатель адиабаты.
– показатель адиабаты.
Уравнение Пуассона, связывающие параметры идеального газа при адиабатном процессе:
 ,
,  ,
, 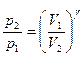 ,
, 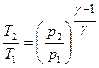
Коэффициент полезного действия (к.п.д.) тепловой машины: 
Термический к.п.д. цикла
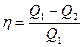 ,
,
где 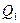 – теплота, полученная рабочим телом от теплоотдатчика;
– теплота, полученная рабочим телом от теплоотдатчика;
 –теплота, переданная рабочим телом теплоприемнику.
–теплота, переданная рабочим телом теплоприемнику.
Термический к.п.д. цикла Карно
 ,
,
где 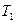 и
и 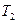 – термодинамические температуры теплоотдатчика и теплоприемника.
– термодинамические температуры теплоотдатчика и теплоприемника.
Примеры решения задач.
Пример 1. Азот массой m =0,1 кг был изобарически нагрет от температуры  = 200 К до температуры
= 200 К до температуры  = 400 К. Определить работу А, совершенную газом, полученную им теплоту и изменение внутренней энергии азота.
= 400 К. Определить работу А, совершенную газом, полученную им теплоту и изменение внутренней энергии азота.
| Дано:
m = 0,1 кг
 = 200 К = 200 К
 = 400 К = 400 К
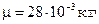
A =?, Q =?,
 =? =?
|
 Решение:
Решение:
Изобразим процесс на PV – диаграмме (рис.5).
Работа газа при изобарическом расширении

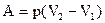 .
.
Из уравнения Менделеева - Клапейрона:
 ,
,  ,
,
поэтому: 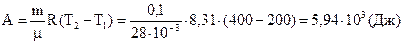 .
.
Размерность:
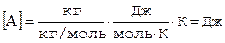 .
.
Изменение внутренней энергии газа определяется изменением его температуры:
 ,
,
где: 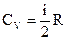 – молярная теплоемкость газа при постоянном объеме, i – число степеней свободы молекулы (азот –двухатомный газ, поэтому i = 5). Тогда:
– молярная теплоемкость газа при постоянном объеме, i – число степеней свободы молекулы (азот –двухатомный газ, поэтому i = 5). Тогда:
11
 .
.
Размерность:  .
.
На основании первого начала термодинамики определим теплоту, полученную газом:
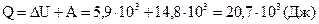 .
.
Размерность: 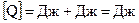 .
.
Ответ: A = 5,9· 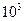 Дж,
Дж,  = 14,8·
= 14,8· 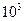 Дж, Q = 20,7·
Дж, Q = 20,7· 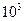 Дж.
Дж.
Пример 2. В сосуде находится водород массой m = 10 г. При изотермическом расширении объем водорода увеличивается в два раза. Считая водород идеальным газом, найти приращение его энтропии.
Решение:
Согласно второму началу термодинамики изменение энтропии определяется начальным и конечным состоянием системы. Если процесс перехода системы из начального состояния в конечное обратимый, то:
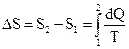 .
.
По первому началу термодинамики:
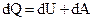 .
.
При изотермическом процессе (T = const) изменение внутренней энергии равно нулю (dU = 0), поэтому:
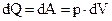 ,
,
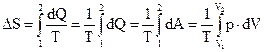 ,
,
Из уравнения Менделеева - Клапейрона: 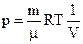 ,
,
12
 ,
,
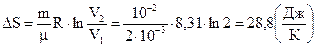 .
.
Размерность:  .
.
Ответ:  .
.
Пример 3. Один моль идеального газа с показателем адиабаты γ совершает политропический процесс, в результате которого абсолютная температура газа Т возрастает в η раз. Показатель политропы равен n. Найти приращение энтропии газа ΔS.
| Дано:
γ, n
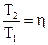
ΔS =?
|
Решение.
Приращение энтропии при обратимом процессе:
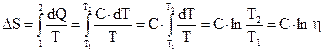 ,
,
где: С – молярная теплоемкость идеального газа в этом процессе.
Политропический процесс описывается уравнением:
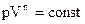 ,
,
где: n – показатель политропы, p – давление газа, V – объем, занимаемый газом.
Определим С из выражения для показателя политропы:
 ,
,
где:  ,
, 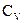 – молярные теплоемкости при постоянном давлении и постоянном объеме соответственно. Тогда:
– молярные теплоемкости при постоянном давлении и постоянном объеме соответственно. Тогда:
 ,
,
отсюда:
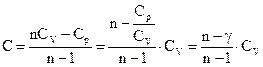 .
.
Так как  и
и 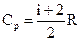 , то
, то
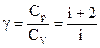 ,
,
где: i – число степеней свободы,
R — универсальная газовая постоянная.
Определим i:
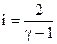 .
.
Тогда:
 .
.
Следовательно, молярная теплоемкость С идеального газа в этом процессе:
 .
.
Приращение энтропии:
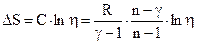 .
.
Размерность: 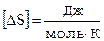 .
.
Ответ: 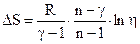 .
.
ЭЛЕКТРОСТАТИКА.
3.1. ОСНОВЕЫК ФОРМУЛЫ
Закон Кулона
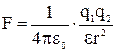 ,
,
где F – сила взаимодействия точечных зарядов q 1 и q 2; r – расстояние между зарядами; e – диэлектрическая проницаемость; e 0 – электрическая постоянная.



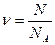 ,
, – число частиц (атомов, молекул, ионов);
– число частиц (атомов, молекул, ионов); 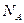 – постоянная Авогадро.
– постоянная Авогадро.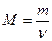 ,
, – масса однородного тела;
– масса однородного тела;  – количество вещества этого тела.
– количество вещества этого тела.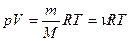 ,
, – количество вещества, T – термодинамическая температура.
– количество вещества, T – термодинамическая температура.
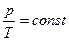
 .
.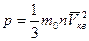 ,
, – средняя квадратичная скорость.
– средняя квадратичная скорость.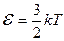 ,
,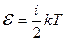 ,
,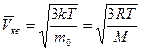 – средняя квадратичная;
– средняя квадратичная;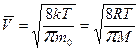 – средняя арифметическая;
– средняя арифметическая;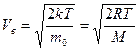 – наиболее вероятная,
– наиболее вероятная,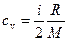 ,
, 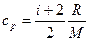 .
.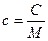 ,
,  .
.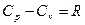 .
.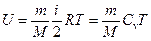 .
.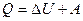 ,
,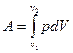 в общем случае;
в общем случае;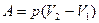 при изобарном процессе;
при изобарном процессе; при изотермическом процессе;
при изотермическом процессе;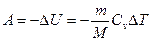 или
или 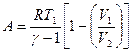 при адиабатном процессе, где
при адиабатном процессе, где  – показатель адиабаты.
– показатель адиабаты. ,
,  ,
, 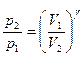 ,
, 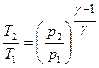

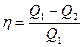 ,
,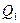 – теплота, полученная рабочим телом от теплоотдатчика;
– теплота, полученная рабочим телом от теплоотдатчика; –теплота, переданная рабочим телом теплоприемнику.
–теплота, переданная рабочим телом теплоприемнику. ,
,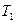 и
и 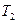 – термодинамические температуры теплоотдатчика и теплоприемника.
– термодинамические температуры теплоотдатчика и теплоприемника. = 200 К до температуры
= 200 К до температуры  = 400 К. Определить работу А, совершенную газом, полученную им теплоту и изменение внутренней энергии азота.
= 400 К. Определить работу А, совершенную газом, полученную им теплоту и изменение внутренней энергии азота.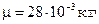
 =?
=? Решение:
Решение:
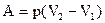 .
. ,
,  ,
,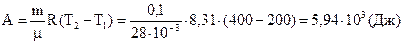 .
.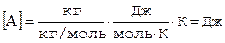 .
. ,
,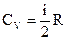 – молярная теплоемкость газа при постоянном объеме, i – число степеней свободы молекулы (азот –двухатомный газ, поэтому i = 5). Тогда:
– молярная теплоемкость газа при постоянном объеме, i – число степеней свободы молекулы (азот –двухатомный газ, поэтому i = 5). Тогда: .
. .
.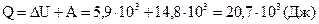 .
.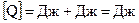 .
.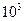 Дж,
Дж, 
 кг
кг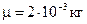

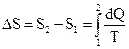 .
.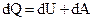 .
.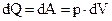 ,
,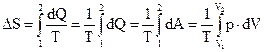 ,
,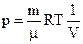 ,
, ,
,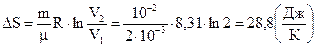 .
. .
. .
.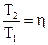
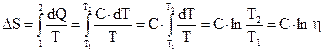 ,
,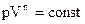 ,
, ,
, ,
, 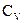 – молярные теплоемкости при постоянном давлении и постоянном объеме соответственно. Тогда:
– молярные теплоемкости при постоянном давлении и постоянном объеме соответственно. Тогда: ,
,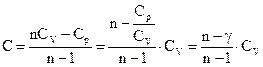 .
. и
и 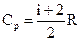 , то
, то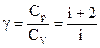 ,
,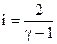 .
. .
. .
.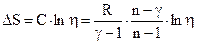 .
. .
.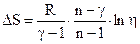 .
.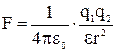 ,
,


