4.Электронное семейство (s-, p-, d-, f-) и характер элемента (неметалл или металл, переходный элемент). Окислительно-восстановительные свойства.
5. Формулы соединений:
- высшего оксида,
- гидроксида (основания ли кислоты),
- летучего водородного соединения (только для неметаллов).
6. Химический характер соединений, его доказательство: кислотный: кислотный оксид + щелочь→ соль + вода; кислота + основание → соль + вода,
основный: основныйоксид + кислота → соль + вода; основание + кислота → соль + вода,
амфотерный: см. кислотный и основный.
7. Сравнение с соседями:
- по периоду;
- по подгруппе;
(металлы с неметаллами не сравнивать)
| План характеристики химического элемента по положению в ПС Д.И.Менделеева
| Химический элемент сера
|
| 1. Положение элемента в ПС: порядковый номер, период, ряд, группа, подгруппа
| Химический знак – S («Эс»)
Порядковый номер – 16, VI группа, А подгруппа, 3 период
|
| 2. Строение атома: формула состава (количество протонов, нейтронов, электронов),
заряд ядра атома,
количество энергетических уровней и размещение электронов на них, электронная формула, электронно-графическая формула, число е на последнем слое
| Формула состава: количество протонов 16, нейтронов 16, электронов 16.
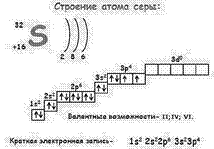 6 электронов внешних, 2 неспаренных
6 электронов внешних, 2 неспаренных
|
| 3. Валентные возможности атома химического элемента, степени окисления.
| Высшая и низшая валентность: VI и II
Степень окисления высшая и низшая: +6 и -2
|
| 4.Электронное семейство (s-, p-, d-, f-) и характер элемента (неметалл или металл, переходный элемент).
| р – элемент.
Свойства простого вещества: S – неметалл
|
| 5. Формулы соединений:
- высшего оксида,
- гидроксида (основания ли кислоты),
- летучего водородного соединения (только для неметаллов).
| Высший оксид: SO3 (кислотный)
Высший гидроксид: H2SO4 (кислота)
Формула летучего водородного соединения: H2S
|
| 6. Химический характер соединений, его доказательство: кислотный: кислотный оксид + щелочь→ соль + вода; кислота + основание → соль + вода,
основный: основныйоксид + кислота → соль + вода; основание + кислота → соль + вода,
амфотерный: см. кислотный и основный
|
SO3 + NaOH = Na2SO4 + H2O
H2SO4 + 2NaOH = Na2SO4 + 2H2O
|
| 7. Сравнение с соседями:
- по периоду;
- по подгруппе;(металлы с неметаллами не сравнивать)
| Сера – неметалл. Её неметаллические свойства, выражены сильнее, чем у фосфора и селена и слабее, чем у хлора и кислорода.
|
VI. Задание.
1. Составьте электронные формулы атомов элементов с порядковыми номерами
а) 12 и 23; б) 15 и 30; в) 17 и 25 с помощью символов и квантовых ячеек. Определите высшую и низшую степень окисления этих элементов.
2. Дайте характеристику химических элементов по положению в ПС Д.И.Менделеева с порядковыми номерами а) 11; б) 16; в) 35.
3. Какой элемент более активен (т.е. имеет большие металлические или неметаллические свойства) и почему
а) Mg или AL; P или As б) K или Ca; Br или I; в) Na или K; C или N?
3. Какое соединение более активно (т.е. имеет большие основные или кислотные свойства) и почему
а) KOH или Ca (OH)2; H 2 SiO 3 или H 2 CO 3 б) Mg (OH)2 или Ca (OH)2; H 3 PO 4 или H 2 SO 4; в) Ba (OH)2 или Ca (OH)2; HCLO 4 или H 2 SO 4?
Тест 1.
Задание1.1: Из указанных в ряду химических элементов выберите три элемента, которые образуют оксиды. Расположите выбранные элементы в порядке уменьшения кислотных свойств их высших оксидов.
1) Si 2) S 3) F 4) Zn 5) Ar
Задание 1.2: Из указанных в ряду химических элементов выберите три р-элемента. Расположите выбранные элементы в порядке уменьшения их валентности в летучих водородных соединениях. 1) Cl 2) Sr 3) Se 4) P 5) K
Задание 1.3: Из указанных в ряду химических элементов выберите три элемента неметалла. Расположите выбранные элементы в порядке усиления окислительных свойств образованных ими простых веществ.
1) P 2) Al 3) Cl 4) Zn 5) H
Задание 2.5: 1) Mg 2) Cl 3) Al 4) Br 5) Ca
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И.Менделеева находятся в одном периоде. Расположите эти элементы в порядке уменьшения кислотных свойств их гидроксидов.
Задание 1.6: 1) Li 2) N 3) F 4) Rb 5) Cl
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И.Менделеева находятся в одном периоде. Расположите эти элементы в порядке возрастания кислотных свойств их водородных соединений.
Тренировочные задания 1:
1. Одинаковое число электронных слоев, содержащих электроны, имеют атомы элементов:
1) Al и S 2) N и Si 3) Li и Na 4) He и Ne
2. Пять электронов находятся во внешнем электронном слое атома
1) бора 2) стронция 3) фосфора 4) неона
3. На приведённом рисунке изображена модель атома химического элемента
1) 2-го периода VA группы 2) 3-го периода VIIA группы
3) 3-го периода VA группы
4) 2-го периода VIIA группы
4. Сколько электронов находится во внешнем электронном слое атома, в ядре которого 14 протонов?
1) 2 2) 4 3) 8 4) 14
5. Схема строения электронных оболочек соответствует атому химического элемента
1) 2-го периода VIIA группы 2) 5-го периода VIIA группы
3) 2-го периода VA группы 4) 5-го периода IIА группы
6. Распределению электронов в атоме химического элемента соответствует ряд чисел: 2, 8, 3. В Периодической системе Д. И. Менделеева этот элемент расположен
1) в 3-м периоде, IIIА группе 2) в 3-м периоде, IIA группе
3) во 2-м периоде, IIA группе 4) во 2-м периоде, IIIA группе
7. Заряд ядра атома химического элемента, расположенного во 2-м периоде, IVA группе равен: 1) +4 2) +12 3) +8 4) +6
8. Четыре электрона находятся во внешнем электронном слое атомов каждого из химических элементов в ряду
1) C, Si, Sn 2) O, Cl, I 3) N, C, S 4) Mg, Be, Ca
9. Химический элемент, в атомах которого распределение электронов по слоям: 2, 8, 6, образует высший оксид
1) SeO3 2) SO3 3) N2O3 4) P2O3
10. Химический элемент, в атомах которого распределение электронов по слоям: 2, 8, 4, образует водородное соединение:
1) CH4 2) NH3 3) SiH4 4) H2
Тренировочные задания 2:
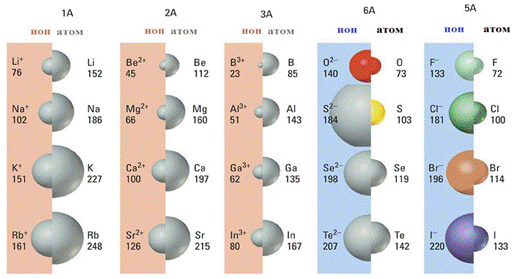
1. В каком ряду химические элементы расположены в порядке усиления металлических свойств соответствующих им простых веществ?
1) кальций → калий → натрий 2) калий → натрий → литий
3) натрий → магний → алюминий 4) магний → кальций → барий
2. Неметаллические свойства у кремния выражены сильнее, чем у
1) углерода 2) азота 3) алюминия 4) фосфора
3. В каком ряду химические элементы расположены в порядке увеличения радиуса атома?
1) K → Na → Li 2) F → O → N 3) P → S → Cl 4) Ca → Mg → Be
4. От кислотных к основным меняются свойства оксидов в ряду
1) CaO → SiO2 → SO3 2) Na2O → MgO → Al2O3
3) CO2 → Al2O3 → MgO 4) SO3 → P2O5 → SiO2
5. Наиболее сильными основными свойствами обладает оксид
1) магния 2) бериллия 3) алюминия 4) натрия
6. Атомный радиус химических элементов уменьшается в ряду
1) Si → Al → Mg 2) Be → Al → C
3) As → P → N 4) F → Cl → Br
7. От основных к кислотным меняются свойства оксидов в ряду
1) N2O5 → P2O5 → As2O5 2) Li2O → Na2O → K2O
3) MgO → SiO2 → SO3 4) CO2 → B2O3 → Li2O
8. Металлические свойства магния выражены сильнее, чем металлические свойства 1) кальция 2) бериллия 3) калия 4) бария
9. Неметаллические свойства серы выражены сильнее, чем неметаллические свойства 1) селена 2) фтора 3) кислорода 4) хлора
10. Амфотерным является высший оксид каждого из химических элементов, имеющих в Периодической системе Д. И. Менделеева порядковые номера
1) 4, 13, 30 2) 6, 11, 16 3) 19, 12, 3 4) 6, 14, 17



 6 электронов внешних, 2 неспаренных
6 электронов внешних, 2 неспаренных



