▼ В отсутствии тока (разомкнутая цепь) Þ
равновесие на границе Ме-раствор, Е р Ме n + /Ме:
M е1(р-р) n + + n 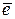
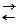 M е1(к), Е р Ме1 n + /Ме
M е1(к), Е р Ме1 n + /Ме
M е2(р-р) n + + n 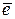
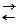 M е2(к), Е р Ме2 n + /Ме
M е2(к), Е р Ме2 n + /Ме
Если:
► Е р Ме1 n + /Ме более отрицательный Þ Ме1 - анод
Е р Ме2 n + /Ме более положительный Þ Ме2 - катод:


► gghb
► стандартная ЭДС ГЭ: 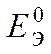
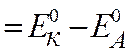 (I = 0)
(I = 0)
▼ При замыкании цепи Þ равновесие нарушается:

 А: M е1(к) ® M е1(р-р) n + + n
А: M е1(к) ® M е1(р-р) n + + n  , Е i А
, Е i А
К: M е2(р-р) n + + n 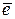 ® M е2(к), Е i К
® M е2(к), Е i К


 M е1(к) + M е2(р-р) n + + n
M е1(к) + M е2(р-р) n + + n 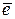 ® M е1(р-р) n + + n
® M е1(р-р) n + + n 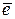 + M е2(к) Þ
+ M е2(к) Þ
Уравнение токообразующей реакции:
ТОР: M е1(к) + M е2(р-р) n + ® M е1(р-р) n + + M е2(к)
При разомкнутой цепи Þ равновесие:
Zn 2+ + 2 e 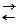 Zn, Е 0 Zn 2+ / Zn = - 0,763 B
Zn, Е 0 Zn 2+ / Zn = - 0,763 B
Cu2+ + 2e  Cu, Е 0 Cu 2+ /Cu = + 0,337 B
Cu, Е 0 Cu 2+ /Cu = + 0,337 B
Е Э = (Е К – Е А) > 0 Þ Е К > Е А Þ Cu2+/Cu –
Zn 2+ / Zn –
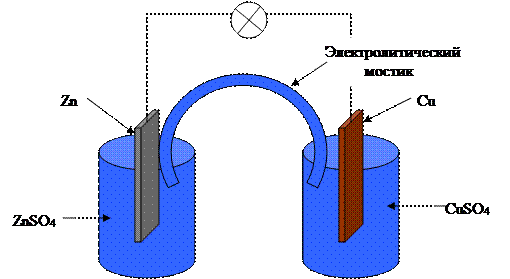
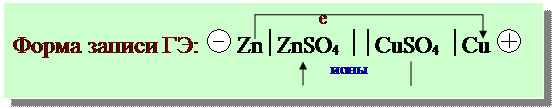
Цепь замкнута:
А: Zn → Zn 2+ + 2 e -окисление
К: Cu 2+ + 2 e → Cu -восстановление
ТОР: Zn + С u 2+ → Zn 2+ + Cu

Стандартная ЭДС ГЭ:
Е 0Э = Е 0 Cu 2+ / Cu – Е 0Zn2+/ Zn = 0,337 – (-0,763) = 1,1 B
(при с.с., а Cu 2+ = а Zn2+ = 1 моль/л)


 Источник электрического тока Þ энергия Гиббса ТОР:
Источник электрического тока Þ энергия Гиббса ТОР:
Работа ГЭ отнесенная к 1молю Ме:
nF - количество электричества, прошедшее через цепь, Кл;
ЕЭ – ЭДС, В;
n - число моль электронов.
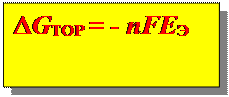
При обратимом процессе
(р,Т = c о nst): Þ ►

Пусть ТОР в ГЭ: 2А + В  3D + K
3D + K
Если данный ГЭ работает при
Стандартном состоянии, а ионов =1 моль/л:
D G 0 ТОР = - n . F . E 0 Э
Если данный ГЭ работает при
не стандартном состоянии, а ионов ≠ 1 моль/л:
D G ТОР = D G 0 ТОР + RT . ln 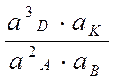 = - n . F . E Э
= - n . F . E Э
Е Э = ƒ (а ионов, р газов) ►

 ЕЭ = -
ЕЭ = - 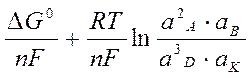
Е0Э
►►►►
D G 0 ТОР = - RT ln K р Þ 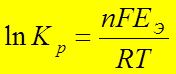
где K р - константа равновесия ТОР

Уравнение Гиббса-Гемгольца:
В энергетических единицах:
D G ТОР = D Н + Т ( )
)
В электрических единицах:
nFE Э = - D Н + nF Т 
В результате:
ЕЭ = 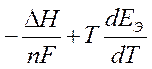 Þ
Þ 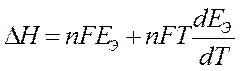
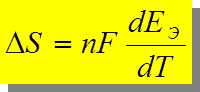

или 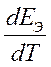

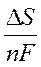
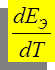 - температурный коэффициент, [ В/К ].
- температурный коэффициент, [ В/К ].
Выводы
если: ► D S ТОР > 0: ↑ Т Þ ↑ Е Э
► D S ТОР < 0: ↑ Т Þ ↓ Е Э
► 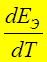 < 0 Þ А ЭЛ < энергии ТОР Þ
< 0 Þ А ЭЛ < энергии ТОР Þ
Эл/хим. система отдает теплоту в окружающую среду или нагревается в условиях тепловой изоляции.
↑ Т Þ ↓ Е Э
Цепь: Pb, PbCl 2 ½ Cl - ½ AgCl, Ag; 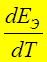 = - 1,86 × 10-4 В/К
= - 1,86 × 10-4 В/К
► 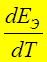 > 0 Þ А ЭЛ > энергии ТОР Þ
> 0 Þ А ЭЛ > энергии ТОР Þ
эл/хим. система заимствует теплоту из окружающей среды или охлаждается в условиях тепловой изоляции. ↑ Т Þ ↑ Е Э
Цепь: Pb ½ Pb (CH 3 COO)2 ½½ Cu (CH 3 COO)2 ½ Cu; 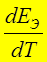 =3,85 × 10-4 В/К
=3,85 × 10-4 В/К
► Электрод -эталон – элемент Вестона:
(Hg)Cd ½ CdSO4 ½ Hg2SO4,Hg;  » 0
» 0
↑ ↓ Т Þ не изменяет Е Э
► Задача.
Рассчитать А max и D Н для ГЭ Вестона в котором:
Т К Е Э, В
293 1,01830
298 1,01807
Решение:


 Hg 2 SO 4 + Cd + 8/3Н2О Û CdSO 4 × 8/3Н2О + 2 Hg ж
Hg 2 SO 4 + Cd + 8/3Н2О Û CdSO 4 × 8/3Н2О + 2 Hg ж

 -2е
-2е
+2е
А max = nFE Э = 2 × 96500 × 1,0183 = 1,963 × 105 Дж/моль
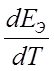 =
= 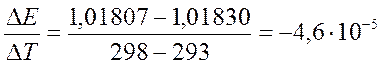 В/К
В/К
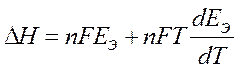 =
=
= 2 × 96500(- 4,6 × 10-5 × 293 - 1,0183)
Þ D Н = - 1,991×105Дж/моль
► Задача.
Напишите катодные и анодные процессы Zn / Ag ГЭ, рассчитайте Е 0Э при Т = 298 К и Е Э при a ктивностях ионов Zn 2+ и Ag + равных:
а Zn 2+ = а Ag + = 0,01 моль/л.
Решение.
Из таблицы: 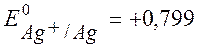 В,
В, 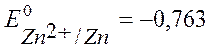 В.
В.
Т.к. 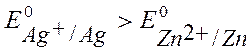 Þ Ag – катод, Zn – анод.
Þ Ag – катод, Zn – анод.

 А: Zn ® Zn+2 + 2e
А: Zn ® Zn+2 + 2e
K: Ag+ + e ® Ag 2
ТОР: Zn + 2 Ag + ® Zn +2 + 2 Ag
●  =0,799 – (– 0,763)= 1,562 В
=0,799 – (– 0,763)= 1,562 В
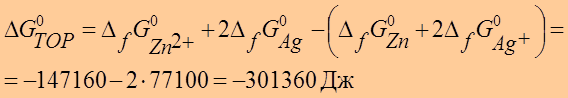
● 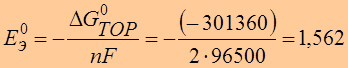 B.
B.
Уравнение Нернста:
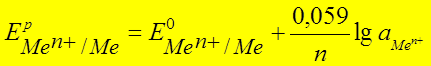
● 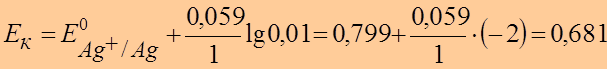 В
В
● 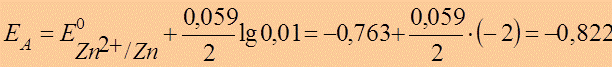 B
B
● 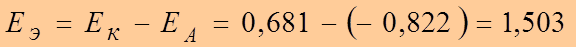 В.
В.
Е Э= 1,503 В Þ ЕЭ0 > ЕЭ
Или так: ● 
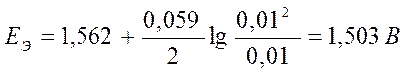 ю
ю
Пример. Гальванический элемент Н2 / О2
При стандартном состоянии (с.с.):
Е 0 Н+/Н2 = 0,0 В - анод
Е 0 О2/ОН– = 0,401 В - катод

 А: Н2 ® 2Н+ + 2 e 2
А: Н2 ® 2Н+ + 2 e 2
K: О2 + 2Н2О + 4 e ® 4ОН –
ТОР: 2Н2 + О2 + 2Н2О ® 4Н+ + 4ОН –
Е 0 Э = Е 0 О2/ОН– - Е 0 Н+/Н2 = 0,401 - 0,0 В = 0,401 В
Уравнение Нернста:
● 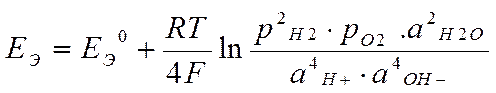
Пример. Гальванический элемент O 2 / Cl 2
При стандартном состоянии (с.с.):
Е 0 О2/ОН– = 0,401 В - анод
Е 0 Cl 2/ Cl – = 1,359 В - катод

 А: 4ОН – ® О2 + 2Н2О + 4 e
А: 4ОН – ® О2 + 2Н2О + 4 e
K: Cl 2 + 2 e ® 2 Cl – 2
ТОР: 4ОН – + 2 Cl 2 ® О2 + 2Н2О + 4 Cl –
Е 0 Э = Е 0 Cl 2/ Cl – - Е 0 О2/ОН– = 1,359 - 0,401 В = 0,958 В
Уравнение Нернста:
● 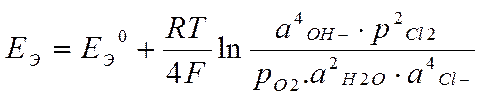
КОНЦЕНТРАЦИОННЫЕ ГЭ
Элементы, составленные из одинаковых электродов, помещенных в растворы электролитов различной концентрации
Пример Zn / Zn ГЭ
/ \ Т = 298 К, Е 0 Zn 2+/ Zn = – 0,763 В
ß ß
(1) в растворе (2) в растворе
ZnSO 4 ZnSO 4
а Zn 2+ =0,05 моль/л а Zn 2+ =0,001 моль/л
ß ß
Е р Zn 2+/ Zn = – 0,766 В Е р Zn 2+/ Zn = – 0,851 В
ß ß
более (+) катод более (–) анод
расчеты - по Уравнению Нернста:
● Е р Zn 2+/ Zn = Е 0 Zn 2+/ Zn + (0,059/2) . lg а Zn 2 +
А: Zn ® Zn+2 + 2e
K: Zn+2 + 2e ® Zn
Е Э = – 0,766 В- (-0,851) = 0,085 В
Пример Н2 / Н2 ГЭ
/ \ Т = 298 К, Е 0Н+/Н2= 0,0 В
ß ß
(1) в растворе (2) в растворе
Н2 SO 4 Н2 SO 4
рН = 2 рН = 5
р Н2 = 10 кПа р Н2 = 100 кПа
ß ß
Е р Н+/Н2 = – 0,1475 В Е рН+/Н2= – 0,354 В
ß ß
более (+) катод более (–) анод
расчеты - по Уравнению Нернста:
● Е р Н+/Н2 = - 0,0259 . lg р Н2 – 0,059 . рН
А: Н2 ® 2Н+ + 2 e
K: 2Н+ + 2 e ® Н2
Е Э = – 0,1475 - (-0,354) = 0,2065 В


При работе ГЭ Þ вырабатывается электрический ток Þ под действием электрического тока Þ возникают потери:
► Δ Е А, Δ Е К – поляризационные потери на аноде и катоде за счет скопления продуктов реакции на электроде и за счет недостатка исходных веществ для реакции на электроде и за счет замедленности самой электрохимической реакции Þ
Þ { Е анода Þ более положительным
{ Е катода Þ более отрицательным
► Δ Е ОМ – омические потери в электролите (!) и на электродах Þ Δ Е ОМ = R . I
В результате в ГЭ напряжение U - уменьшается.
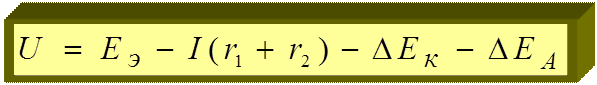
U – напряжение ГЭ; U = Е К – Е А (при I ≠ 0)
I (r 1 + r 2) - омическое падение напряжения;
r 1 - сопротивление в проводниках с электронной;
проводимостью (проводники первого рода);
r 2 - сопротивление в электролите (проводник второго
рода);
Δ Е А, Δ Е К – поляризация анода и катода.
график зависимости Е = f (i) –
поляризационные кривые ГЭ

Для увеличения ↑ U ГЭ необходимо:
► ↑ Δ Е Э ● ↑ а ионов, исх. , ↑ р газов, исх. ТОР
● ↓ а ионов, прод. , ↓ р газов, прод. ТОР
► ↓ Δ Е А ● ↑ температуру Т
↓ Δ Е К ● ↑ S электродов
● использовать электроды –
катализаторы
► ↓ Δ Е ОМ ● ↑ температуру Т
● ↓ расстояния между электродами
● перемешивать электролит
● использовать добавки,
подвижные ионы,
увеличивающие
электропроводность
электролита.
Материальные расчеты для электрохимических процессов - по закону Фарадея Þ ток (I) пропорционален количеству вещества, прореагировавшему на электродах в единицу времени, т.е. скорости электрохимической реакции:
►  Þ значение I для оценки скорости электрохимической реакции
Þ значение I для оценки скорости электрохимической реакции



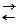 M е1(к), Е р Ме1 n + /Ме
M е1(к), Е р Ме1 n + /Ме


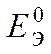
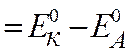 (I = 0)
(I = 0) 
 А: M е1(к) ® M е1(р-р) n + + n
А: M е1(к) ® M е1(р-р) n + + n 

 M е1(к) + M е2(р-р) n + + n
M е1(к) + M е2(р-р) n + + n 



 Источник электрического тока Þ энергия Гиббса ТОР:
Источник электрического тока Þ энергия Гиббса ТОР: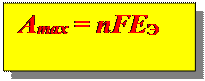
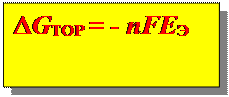

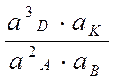 = - n . F . E Э
= - n . F . E Э
 ЕЭ = -
ЕЭ = - 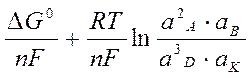
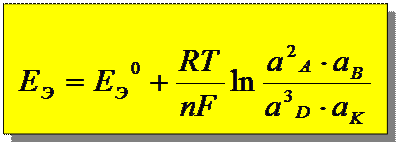
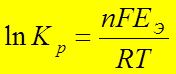

 )
)
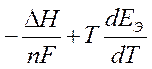 Þ
Þ 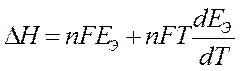

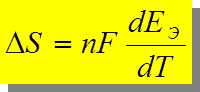

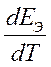

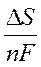
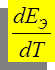 - температурный коэффициент, [ В/К ].
- температурный коэффициент, [ В/К ]. 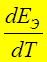 < 0 Þ А ЭЛ < энергии ТОР Þ
< 0 Þ А ЭЛ < энергии ТОР Þ 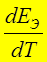 =3,85 × 10-4 В/К
=3,85 × 10-4 В/К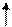


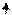 Hg 2 SO 4 + Cd + 8/3Н2О Û CdSO 4 × 8/3Н2О + 2 Hg ж
Hg 2 SO 4 + Cd + 8/3Н2О Û CdSO 4 × 8/3Н2О + 2 Hg ж
 -2е
-2е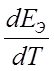 =
= 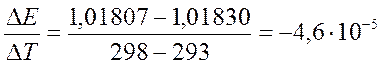 В/К
В/К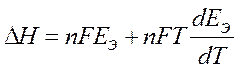 =
=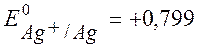 В,
В, 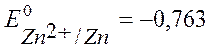 В.
В.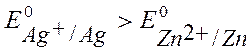 Þ Ag – катод, Zn – анод.
Þ Ag – катод, Zn – анод.

 =0,799 – (– 0,763)= 1,562 В
=0,799 – (– 0,763)= 1,562 В 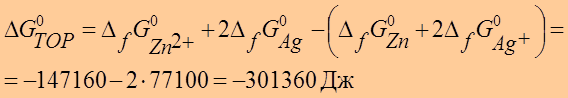
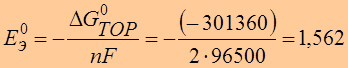 B.
B.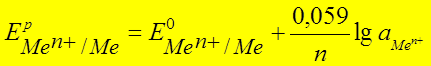
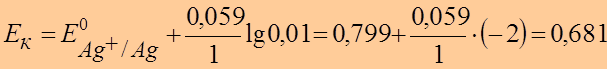 В
В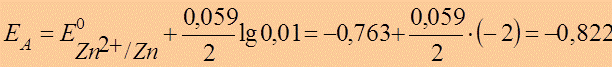 B
B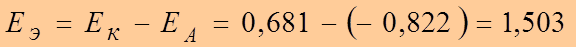 В.
В.
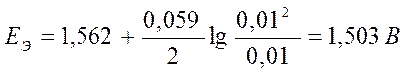 ю
ю
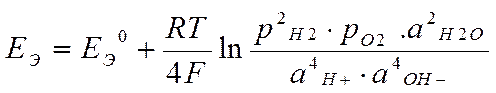
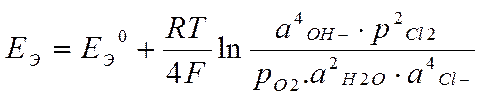


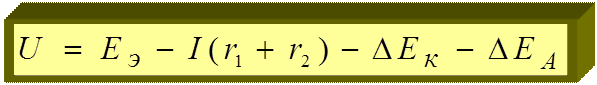

 Þ значение I для оценки скорости электрохимической реакции
Þ значение I для оценки скорости электрохимической реакции


