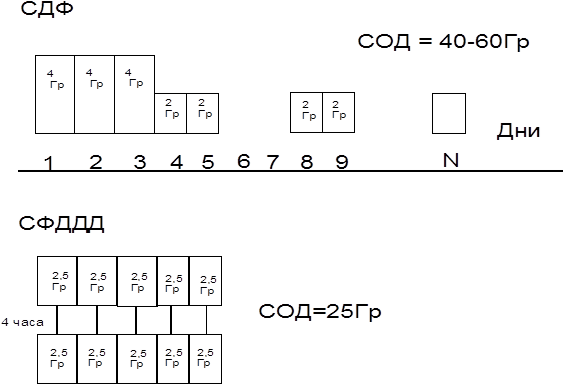Рак желудка следует диффренцировать:
· хронический гастрит
· полипоз,
· хроническая язва желудка
· неэпителиальные и лимфоидные опухоли желудка
· воспалительные и другие изменения симулирующие рак желудка (туберкулез, сифилис, актиномикоз, амилоидоз)
· при кардиоэзофагеальном раке с дисфагией – с заболеваниями пищевода (ахалазия, рубцовое сужение и др.)
Глава V.
ЛЕЧЕНИЕ
Лечебная тактика решается индивидуально в каждом конкретном случае на консилиуме врачей с обязательным участием хирурга, анестезиолога и химиотерапевта.
Наиболее распространенным методом лечения рака желудка остается хирургическим. В последние годы разрабатывают принципы и методики комбинированного и комплексного лечения. Лучевую и лекарственную терапию в качестве самостоятельных методов применяют только при противопоказаниях к операции у больных с запущенным раком или тяжёлыми сопутствующими заболеваниями.
Хирургическое лечение. При раке желудка применяют 3 основных типа радикальных операций:
1. Гастрэктомия.
2. Дистальная субтотальная резекция – удаления 4/5и более частей желудка.
3. Проксимальная субтотальная резекция – удаление 4/5 и более частей желудка.
При прорастании опухоли в соседние структуры или в случае подозрения на метастатическое их поражение по онкологическим соображениям необходимо выполнять комбинированные операции с частичным или полным удалением окружающих желудок органов. Комбинированные операции в ряде случаев производят по принципиальным соображениям, когда имеется подозрения на метастатическое поражение соседних органов, в частности удаление селезёнки, резекция хвоста поджелудочной железы и т.п.
Показание к дистальной субтотальной резекции желудка является экзофитный рак нижней трети желудка. По строгим показаниям эта операция допускается при небольших эндофитных или смешанной формы роста опухолях пилороантрального отдела, или когда маленькая экзофитная опухоль локализуется в средней трети желудка. Операции меньшего объёма (резекция 2/3 желудка, клиновидная, трубчатая.) можно выполнять по строгим показаниям у больных экзофитным раком 1 и 2 стадий.
Проксимальную субтотальную резекцию желудка чрезбрюшинным доступом выполняют только при экзофитной опухоли верхней трети желудка, не распространяющейся на розетку кардии.
Гастрэктомию выполняют при раке любой макроскопической формы роста, местно – распространённой опухоли, а также в случаях субтотального поражения желудка. При этом до формирования анастомоза необходимо проведение срочного морфологического исследования удалённого желудка, позволяющего убедиться в отсутствии опухолевой клеток по линии резекции желудка и пищевода во избежание продолжённого роста опухоли.
При распространении опухоли на розетку кардии, абдоминальный или диафрагмальный сегмент пищевода следует одномоментно выполнять резекцию пищевода из комбинированного левостороннего торакоабдоминального доступа. Распространение опухоли на наддиафрагмальный сегмент пищевода и выше является показанием к выполнению операции из комбинированного доступа – срединной лапаротомии и правосторонней торакотомии. Независимо от вида хирургического вмешательства во всех случаях обязательно соблюдение онкологических принципов радикализма: удаление большого и малого сальника, пересечение левой желудочной артерии у места её отхождение от чревного ствола.
Сегодня продолжен поиск новых хирургических подходов, позволяющих надеяться на улучшение отдалённых результатов лечения. Одним из путей решения данной проблемы является повышение онкологического радикализма и резектабельности за счёт выполнения комбинированных и расширённых оперативных вмешательств. Вместе с тем подобные операции по сей день имеют немало противников, аргументирующих своё негативное отношение резким увеличением числа послеоперационных осложнений и летальности по сравнению со стандартными оперативными вмешательствами без улучшения отдалённых результатов лечения.
Определяя показания к выполнению расширенных операций при раке желудка, следует отметить основную ошибку, допускаемую не только хирургами, но и онкологами – расширенные лимфаденэктомии выполняют, как правило, только по онкологическим показаниям, т.е. при выявлении макроскопически изменённых регионарных лимфатических узлов. Плановое морфологическое изучение лимфатических узлов, удалённых в ходе расширенных операций, показала, что «интактные» узлы поражаются метастазами, не прорастающим капсулу лимфатического узла, в 57,1% наблюдений, причём метастазы в узлах N2-группы выявляют почти у каждого 4-го пациента.
Учитывая большое число лимфатических узлов, потенциально способных подвергаться метастазированию, невозможно установить истинное лимфогенное распространение (символ N), а следовательно и стадию опухолевого процесса без максимально полного удаления и изучения всех регионарных лимфатических коллекторов, т.е. без выполнения расширенной лимфаденэктомии. В настоящее время используют классификацию лимфаденэктомии, основанную на категории D (dissection).
D0 – резекция с неполным удалением узлов группы N1.
D1 – резекция с полным удалением узлов группы N1.
D2 -резекция с полным удалением узлов группы N1и N2
D3 – резекция с полным удалением узлов группы N1, N2 и N3.
Лимфаденэктомии D0 и D1 считают стандартными, а D2 и D3 – расширенными.
Противопоказаниями к хирургическому лечению рака желудка является 4-я стадия заболевания, сопровождающаяся асцитом, желтухой на фоне множественным метастазов в обеих долях печени. В ряде случаев при осложненном течении резектабельных опухолей оправданы паллиативные операции, позволяющие улучшить качество жизни пациентов. При выявлении на операции отдалённых, но хирургически удалимых метастазов (в печени, в теле или хвосте паллиативных комбинированных вмешательств. При осложнениях нерезектабельного рака желудка (стеноз входного или выходного отделов) показаны паллиативные операции типа обходного гастроэнтеро- или эзофагоэнтероанастомозов, гастростомия, еюностомия
Комбинированное и комплексное лечение. Неудовлетворительные результаты хирургического лечения рака желудка привели ученых к поиску других методов, которые смогли бы повысить эффективность лечения. Одним из них является лучевая терапия.
Исследования последних лет, направленные на развитие и совершенствование предоперационной лучевой терапии неоспоримо доказали целесообразность и преимущества комбинированного метода лечения, включающего данный компонент Современная радиология располагает богатым арсеналом средств, повышающим эффективность лучевого воздействия, наиболее простым и доступным из которых является совершенствование схем облучения.
Рисунок 1.
ИКК
В частности в МНИОИ им. П.А. Герцена была апробирована схема динамического фракционирования дозы излучения (СДФ). При этом в первые три дня к опухоли подводятся три фракции по 4 Грея с интервалом 24 часа с целью подавления хорошо оксигенированной массы опухоли. Дальнейшее ежедневное облучение в дозе 2 Грея направлено на ингибицию постлучевой репарации сублетальных повреждений в опухоли на фоне реоксигенации в течение растянутого во времени облучения. Предоперационное облучение больных раком желудка в режиме СДФ в дозе 36-38 Грей позволило преодолеть радиорезистентность аденогенных опухолей желудка и получить в 40% случаев III-IV степень лучевого патоморфоза по методике Г.А. Лавниковой. Облучение в эквивалентной дозе в режиме классического фракционирования обеспечило только I-II степень лучевого патоморфоза. Основным недостатком предоперационного облучения по схеме СДФ следует считать ее продолжительность, что неоправдано отодвигает хирургический этап лечения.
Использование концентрированного облучения при лечении рака желудка, для которого характерна небольшая суммарная доза, подводимая к патологическому очагу в сжатые сроки укрупненными фракциями, позволило существенно сократить предоперационный интервал и добиться увеличения радиопоражаемости опухоли в целом.
Наибольшее распространение получило предоперационное облучение с интенсивным концентрированным курсом (ИКК). Методические аспекты этого режима разработаны в ОНЦ РАМН им. Н.Н. Блохина. Исследования эффективности ИКК показали, что предоперационное облучение в течение пяти дней с суммарной очаговой дозой 20 Грей дает благоприятный эффект, увеличивая трехлетнюю выживаемость больных. Метод является экономически выгодным, поскольку длительность курса облучения и предоперационный интервал вместе составляют неделю.
Негативным моментом этой схемы фракционирования является выраженность лучевых реакций общего характера, встречающихся у 50-60% больных. Кроме того, отдаленные результаты комбинированного лечения с ИКК оказались хуже в сравнении с СДФ.
На основании детального изучения литературы, посвященной вопросам радиобиологии и результатам имеющихся работ по комбинированному лечению рака желудка с использованием предоперационной лучевой терапии, на базе Челябинского областного онкологического диспансера разработана физико-технические обоснования режима среднего фракционирования с дневным дроблением дозы (СФДДД).
Лучевая терапия в режиме СФДДД предусматривает облучение 2 раза в день по 2,5 Грея через 4 часа 5 раз в неделю до суммарной очаговой дозы 25 Грей с предоперационным интервалом 48 часов.
Исследования показали, что разовые дозы в 5 Грей обеспечивают гибель части опухолевых клеток и трансформацию сублетальных повреждений в летальные. Вместе с тем, крупнопольное облучение верхней половины брюшиной полости укрупненными разовыми дозами сопровождается большим числом тяжелых и средних лучевых реакций.
Дневное дробление дозы на две фракции по 2,5 Грея с интервалом 4 часа позволило значительно снизить число и выраженность лучевых реакций. Обоснованием этого послужили представления о различиях в репаративных способностях нормальных и опухолевых клеток.
Радиопоражаемость при дневном дроблении дозы увеличивается за счет реализации сублетальных повреждений опухолевых клеток при повторном, через 4-6 часов облучении. Кроме того, за этот промежуток времени происходит максимальная реоксигенация опухоли, что усиливает воздействие облучения на опухолевые клетки.
В нормальных тканях за это время происходит практически полное восстановление повреждений, вызванных действием ионизирующего излучения, поэтому снижается количество лучевых реакций.
При этом эквивалентная классическому режиму доза составила 42 Грея. Нами был выбран оптимальный предоперационный интервал продолжительностью 48-72 часа. Это решение исходило из экспериментальных и клинических наблюдений опубликованных Р.А. Мельниковым в 1983 году.
При планировании предоперационного облучения рака желудка учитываются задачи данного метода лечения:
1. Ликвидация внутристеночных опухолевых диссеминатов.
2. Уничтожение микрометастазов в регионарных лимфатических узлах.
3. Снижение биопотенциала опухоли.
4. Профилактика имплантационных метастазов.
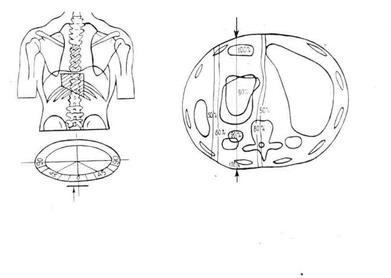
Дистанционная лучевая терапия проводится на гамма-терапевтических установках “Рокус-М”, “Агат-Р”, и “Луч-С” с двух встречных фигурных полей 10-14 х 12-16 см. На рисунке 2 изображены схемы полей облучения и распределение процентных глубинных доз.
В соответствии с поставленными задачами в объем облучения включается первичная опухоль с окружающими тканями на расстоянии не менее 5,0 см и зоны регионарного метастазирования (малый сальник, ворота селезенки, желудочно-поджелудочная связка и прилежащие отделы параортальной зоны).
Границы полей облучения соответствуют границам зон регионарного метастазирования. Верхняя граница проходит в паракардиальной области, нижняя - на уровне поджелудочной железы, правая в области ворот печени, левая – в области ворот селезенки.
Рисунок 2
Схема полей облучения и распределения процентных глубинных доз при лучевой терапии рака желудка.
При локализации опухоли в кардиальном отделе желудка и переходе на пищевод в зону облучения включается вышележащие отделы пищевода на расстоянии не менее 5-6 см от видимых границ опухоли, паракардиальная зона и бифуркационная зона средостения.
В объем облучения, таким образом, входит зона клинического и субклинического опухолевого распространения с целью получения максимального локального эффекта..
При предоперационной лучевой терапии безопасной и эффективной дозой наружного фракционного облучения признана величина дозы эквивалентная 40-45 Гр. Эта доза недостаточна для полного разрушения железистых структур опухоли. Дальнейшее наращивание дозы сопряжено с повышенным риском лучевых реакций и осложнений и, в тоже время, не приводит к улучшению результатов лечения. Тем не менее, в ряде публикаций сообщается о положительных результатах лучевой терапии при паллиативном лечении больных с распространенными стадиями рака желудка.
Паллиативная лучевая терапия направлена на улучшение качества и увеличения продолжительности жизни больных. Для достижение этих целей необходимо решить ряд задач:
1) уменьшение размеров первичной опухоли.
2) уменьшение размеров регионарных метастазов.
3) уменьшение воспалительных изменений, сопутствующих опухоли.
4) снижение биологического потенциала опухолевых клеток для предупреждения их диссеминации.
Лучевая терапия с нетрадиционным фракционированием и суммарной дозой, эквивалентной 42-44 Греям, позволяет наиболее оптимально реализовать цели предоперационного облучения, а при невозможности выполнения радикального вмешательства, эффективно решить задачи паллиативного лечения.
ХИМИОТЕРАПИЯ РАКА ЖЕЛУДКА
Эффективность моно химиотерапии такими препаратами как 5- фторурацил, фторафур, доксорубицин, эпирубицин, митомицин- С, кармустин не превышает 15-20%, полные регрессии опухоли практически не наблюдается, а длительность частичных ремиссий не превышает 4-5 месяцев.
В последние 10 лет достигнуты определенные успехи в лечении диссеминированного рака желудка, что связано с применением комбинированной химиотерапии.
Эффективность наиболее активных лекарственных комбинаций достигает 40-50%, включая 10-15% полных ремиссий. Медиана выживаемости при этом увеличилась до 9-11 месяцев.
Интенсивно развивается неоадъювантная химиотерапия, роль адъювантной химиотерапии после радикальных операций остается на сегодняшний день неясной.
Монохимиотерапия:
1. Фторурацил 500-600 мг\м2 внутривенно ежедневно или через день. На курс лечения до 5г.
Повторный курс через 4-6 недель
2. Фторафур 800-1000 мг\м2 внутрь ежедневно. Рекомендуется прием суточной дозы в 2 приема. На курс лечения –25-30г
Повторный курс через 4 недели
3. Кампто –350 мг\м2 1 часовая внутривенная инфузия
Повторный курс каждые 3 недели.
Полихимиотерапия
1. ЕАР:
Доксорубицин 20 мг\м2 внутривенно 1 и 7 дни
Цисплатин 40 мг\м2 внутривенно капельно во 2 и 8 дни
Этопозид 120 мг\м2 внутривенно капельно 4,5,6 дни
Повторные курсы через 4 недели
2. FAP:
Цисплатин 20 мг\м2 внутривенно капельно с1 по 5 дни
Фторурацил 300 мг\м2 внутривенно с1 по 5 дни
Доксорубицин 50 мг\м2 внутривенно в1 день
Повторные курсы каждые 4 недели
3.МЕР
Митомицин С 10 мг\м2 внутривенно 1 день
Этопозид 60 мг\м2 внутривенно капельно 3,4,5 дни
Цисплатин 60 мг\м2 внутривенно капельно в 1 день
Повторные курсы через 4 недели
4.
5 -Фторурацил 425 мг\м2 внутривенно с1 по 5 дни
Лейковорин 200 мг\м2 внутривенно с1 по 5 дни
Повторные курсы каждые 4 недели
5.
Таксол 175 мг\м2 3 часовая внутривенная инфузия, в 1 день
5 -Фторурацил 1,5г\м2 24 часовая внутривенная инфузия, во 2 день
Повторные курсы каждые 3 недели
Глава VI.
ПРОГНОЗ
Отдаленные результаты лечения больных раком желудка зависят от целого ряда факторов, которые можно разделить на клинико-морфологические и хирургические. В первую очередь 5-летнюю выживаемость определяет стадия опухолевого поражения.
Результаты лечения больных раком желудка значительно отличаются в различных странах мира, что объясняет особенностями разных хирургических школ и преимущественной приверженностью чисто хирургическому или комплексному методу лечения.
Так, если 5-летняя выживаемость, по данным большинства японских авторов, составляет 98% при I стадии заболевания, 85% - при II, и 52% - при III стадии, то в Англии эти показатели соответственно составляют 70, 30 и 7%.
Факторы прогноза: локализация, диаметр опухоли, ТNМ, вовлечение серозной оболочки, гистологический тип опухоли и количество метастазов в лимфатических узлах.
Проведение мультивариантного анализа степени влияния прогностических факторов на отдалённые результаты лечения установило, что из всех вышеперечисленных факторов только локализация опухоли и степень поражения лимфатических узлов метастазами в наибольшей степени определяют 5- летнюю выживаемость пациентов. Если при отсутствии метастазов в лимфатических узлах общая 5- летняя выживаемость в целом составляет 75%, то метастатическое поражение юкстаопухолевых лимфатических узлов снижает 5-летнюю выживаемость до 28%, а отдаленных – до 7%.
Их хирургических факторов на отдаленные результаты лечения достоверно влияют наличие опухолевых клеток по краю резекции органа и неадекватный объем лимфаденэктомии. При наличии клеток рака в проксимальном или дистальном краях резекции медиана выживаемости больных снижается до 9,5 месяцев по сравнению с 36 месяцами в случае отсутствия таковых.
Рекомендуемая литература
1. Избранные лекции по клинической онкологии. Под редакцией академика РАМН В.И. Чиссова, профессора С.Л. Дарьяловой. М. 2000. С 389-3420.
2. Рецидивы злокачественных опухолей и прогноз для больных. А.Е. Колосов, А.Г. Захарьян. Киров. 1995. С 154-181.
3. Справочник по онкологии. Под редакцией академика РАМН Н.Н. Трапезникова и профессора И.В. Поддубной. М. 1996.С 275-294.
4. Химиотерапия опухолевых заболеваний. Краткое руководство под редакцией Н.И. Переводчиковой. М.2000. С. 116-119.
5. Рак проксимального отдела желудка. Б.Е. Петерсон. М.1972. 215 с.
6. Лучевая диагностика и лучевая терапия. Учебное пособие для студентов ВУЗ, врачей интернов и клинических ординаторов. А.В. Важенин с соавт. Челябинск 2000. С.276-286.
7. Классификация злокачественных опухолей. Пятое издание. Под редакцией профессора Н.Н. Блинова 1998 г. С. 49-53.
8. Очерки радиационной онкологии. А.В. Важенин. 1998г. г.Челябинск. С. 29-36.
9. Лучевая терапия в комбинированном и паллиативном лечении рака желудка. А.В. Важенин. 2000 г.Челябинск. 132 с.
10. Клиническая онкология. В.Г. Черенков. 1999г. г. Москва. С. 134-139
ОГЛАВЛЕНИЯ
Стр.
Введение ………………… …………………………………………………….
Глава I. Этиологические факторы и предопухолевые заболевания ……………………………………………………….
Глава II. Классификация рака желудка ……………………………………….
Глава III. Клиника ………………………………………………………………
Глава IV. Диагностика …………………………………………………………
Глава V. Лечение ………………………………………………………………
Глава VI. Прогноз ……………………………………………………………..
Список рекомендуемой литературы …………………………………………