ЗАГРЯЗНЕНИЕ ОКРУЖАЮЩЕЙ СРЕДЫ,
КИСЛОТНЫЕ ОСАДКИ
Кислотными называют любые атмосферные осадки - дожди, туманы, снег, - кислотность которых выше нормальной. Кислотные свойства среды определяются ионами водорода (Н+). Чем больше концентрация водородных ионов в растворе, тем выше его кислотность. Для выражения концентрации ионов водорода используют единицы водородного показателя, или рН. Шкала рН: от 0 (крайне высокая кислотность) через 7 (нейтральная среда) до 14 (крайне сильная щелочность).
Химический анализ кислотных осадков показывает присутствие серной (Н2SO4) и азотной (НNО3) кислот. Наличие серы и азота означает, что проблема связана с выбросами в воздух именно этих элементов. Сжигание топлива при работе угольных ТЭЦ, промышленных предприятий, автомобильного транспорта сопровождается образованием диоксида серы и оксидов азота; реагируя с парами воды, они образуют серную и азотную кислоты. В результате в отдельных регионах выпадают осадки, кислотность которых в 10 - 1000 раз превышает нормальную. Источниками кислотных дождей являются газы, содержащие серу и азот. Наиболее важными из них являются; SО2, NO2 и H2S. Основными реакциями в атмосфере:
1) SO2+ОН ® HSO3, HSO3 + ОН ® H2SO4,
2) SO2 + hn ® SО2*, SO2* + O2® SO 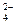 ,
,
SO 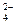 + O2 ® SO3 + O3, SO3 + H2O ® H2SO4.
+ O2 ® SO3 + O3, SO3 + H2O ® H2SO4.
Обе реакции в атмосфере идут одновременно. Из соединений азота основную долю кислотных дождей дают NO и NO2.
Различают прямое и косвенное воздействие кислотных осадков на человека. Прямое воздействие не представляет особой опасности, так как концентрации кислот в атмосфере не превышает 0,1 мг/м3. т.е. находятся на уровне ПДК³ 0,1 и ПДКр – 0,3 мг/м3 для H2SO4).
Прямое воздействие представляет опасность для металлоконструкций: зданий, памятников и т.п. Наибольшую опасность кислотные осадки представляют при попадании в водоемы и почву, так как уменьшают рН воды (рН = 7 - нейтральная среда). От значения рН воды зависит растворимость алюминия и тяжелых металлов в ней и их накопление в корнеплодах, а затем и в организме человека. При изменении рН воды меняется структура почвы и снижается ее плодородие. Снижение рН питьевой воды способствует прямому поступлению в организм человека указанных выше металлов и их соединений.
Значение рН среды чрезвычайно важно с экологической точки зрения, так как от него зависит деятельность практически всех ферментов, гормонов в организме, регулирующих обмен веществ, рост и развитие. Особенно чувствительны к повышению кислотности обитатели водоемов. В пресноводных озерах, ручьях и прудах рН воды обычно составляет 6 - 7, и организмы адаптированы именно к этому уровню. Когда среда подкислена, яйцеклетки, сперма и молодь водных обитателей погибают. Ущерб не ограничивается гибелью водных организмов. Многие пищевые цепи, охватывающие почти всех диких животных, начинаются в водоемах. Прежде всего сокращается популяция птиц, питающихся рыбой или насекомыми, личинки которых развиваются в воде.
Кислотные осадки вызывают деградацию лесов. Попадая на листья и хвою деревьев, кислоты нарушают защитный восковой покров, делая растения более уязвимыми для насекомых, грибов и других патогенных организмов. Леса поражаются насекомыми-вредителями и болезнями. Во время засух через поврежденные листья испаряется больше влаги.
Воздействуя на почву, кислотные осадки значительно увеличивают выщелачивание биогенов. При низких рН уменьшается активность редуцентов и азотфиксаторов, что еще сильнее обостряет дефицит питательных веществ: почвы теряют плодородие. Дополнительный ущерб возникает в связи с тем, что кислотные осадки, просачиваясь сквозь почву, способны выщелачивать алюминий и тяжелые металлы. Обычно присутствие этих элементов в почве не создает проблем, так как они связаны в нерастворимые соединения и, следовательно, не поглощаются организмами. Однако в кислой среде их соединения растворяются, становятся доступными и оказывают сильное токсическое воздействие как на растения, так и на животных.
В разных районах последствия выпадения одинакового количества кислотных осадков могут быть различными. Одни ландшафты остаются практически без изменений, тогда как другие подкисляются настолько, что становятся необитаемыми.
Ключ к ответу связан с понятием буферной емкости, почвы. Защитить экосистему от изменений рН может буфер. Так называется вещество, способное поглощать ионы водорода при данном значении рН. Когда в систему, содержащую буфер, добавляют кислоту, дополнительные ионы водорода им поглощаются и рН остается практически неизменным. В качестве буфера многие природные системы содержат карбонат кальция (СаСО3). Реакция ионов водорода с карбонат-ионами дает воду и углекислый газ. При одинаковом количестве кислотных осадков в первую очередь подкисляются и гибнут экосистемы с низкой буферной емкостью. Почвы, сформированные на известняках, обладают большой буферной емкостью и меньше страдают от кислотных осадков. В сельском хозяйстве издавна используется известкование почв как агротехнический прием, направленный на нейтрализацию кислых почв.
ПАРНИКОВЫЙ ЭФФЕКТ
Под образным выражением "парниковый эффект" подразумевается следующее геофизическое явление. Солнечная радиация, падающая на Землю, трансформируется. 30 % ее отражается в космическое пространство, остальные 70 % поглощаются поверхностью суши и океана. Поглощенная энергия солнечной радиации преобразуется в теплоту и излучается обратно в космос в виде инфракрасных лучей. При этом чистая атмосфера прозрачна для инфракрасных лучей, а атмосфера, содержащая пары воды, углекислый газ и некоторые другие газы, поглощает инфракрасные лучи, благодаря чему воздух нагревается. Парниковые газы выполняют функцию стеклянного покрытия поверхности земли в парнике. Аналогичное явление возникает в автомобиле, оставленном на солнце.
Состояние и состав атмосферы во многом определяют лучистый теплообмен между Солнцем и Землей. В тепловом балансе Земли теплота солнечной радиации является определяющей, поскольку на ее долю приходится основная часть поглощаемой биосферой теплоты, что следует из теплового баланса биосферы. Дж/год; %:
| Теплота солнечной радиации
| 25 × 1023
| 99,8
|
| Теплота от естественных источников (из недр Земли, от животных и др.)
| 37,5 × 1020
| 0,18
|
| Теплота от антропогенных источников (энергоустановок, пожаров и др.)
| 4,2 × 1020
| 0,02
|
Основная доля солнечной радиации передастся к поверхности Земли в оптическом диапазоне излучений, а отраженная от земной поверхности - в инфракрасном. Поэтому доля отраженной лучистой энергии, поглощаемой атмосферой, зависит от количества многоатомных минигазов (СО2, Н2О, СН4, О3 и др.) и пыли в ее составе. Чем больше концентрация минигазов и пыли в атмосфере, тем меньше доля отраженной солнечной радиации уходит в космическое пространство, тем больше теплоты задерживается в биосфере за счет " парникового эффекта ".
Техногенный "парниковые" газы способствуют увеличению теплоты биосферы на - 7×1021 Дж/год, при этом вклад отдельных газов распределяется следующим образом; %: СО2 – 50, СН4 – 20, фреоны – 15, N2O – 10, О3 – 5.
Рост концентраций минигазов в атмосфере и, как следствие, повышение доли теплоты ИК-излучения, задерживаемого атмосферой, неизбежно сопровождается ростом температуры поверхности Земли. В 1880–1940 гг. средняя температура в Северном полушарии возросла на 0,4°С, а в период до 2030 года она может повыситься еще на l,5-4,5°C.
Естественный парниковый эффект создает прирост средней температуры Земли на 30 °С. Это значит, что если бы парникового эффекта не было, то средняя температура Земли, составляющая сейчас 15 °С, понизилась бы до -15 °С. Всю Землю сковало бы льдом. И, наоборот, если содержание газов, вызывающих парниковый эффект, увеличится - на Земле станет еще теплее.
В природной биосфере содержание углекислого газа в воздухе регулируется так, что его поступление равняется удалению. В настоящее время люди нарушают это равновесие. За миллионы лет в недрах Земли накопилось огромное количество ископаемого органического вещества - угля, нефти, газа и т.п., - которое служит основным энергетическим сырьем. В результате сжигания топлива в атмосферу поступают дополнительные порции углекислого газа. Именно этот процесс рассматривается как тенденция, которая может привести к глобальному потеплению климата. Ожидается, что в середине XXI в. количество углекислого газа в атмосфере удвоится. Температура повысится в умеренных широтах на 2-3 °С, на полюсах - более чем на 10 °С. Потепление вызовет таяние полярных льдов. В океан дополнительно поступит такое количество воды, что его уровень поднимется почти на 100 м; будут затоплены обширные приморские низменности и расположенные на берегах морей города, в которых проживает подавляющее большинство населения планеты и сосредоточен основной промышленный потенциал.
Различия температуры на полюсах и экваторе - основная движущая сила циркуляции атмосферы. Более сильное потепление на полюсах приведет к ее ослаблению. Это изменит всю картину циркуляции и связанный с ней перенос теплоты и влаги, что повлечет за собой глобальное изменение климата. В большинстве районов, характеризующихся сейчас жарким и сухим климатом, количество атмосферных осадков увеличится; в умеренном поясе станет суше.
НАРУШЕНИЕ ОЗОНОВОГО ЭКРАНА
Наряду с видимым светом Солнце излучает также ультрафиолетовые волны. Особую опасность представляет коротковолновая часть - жесткое ультрафиолетовое излучение. Все живое на Земле защищено от агрессивного воздействия ультрафиолетового излучения, так как свыше 99 % его поглощается слоем озона в стратосфере на высоте около 25 км.
Основными загрязнителями, разрушающими озоновый экран, являются синтезируемые людьми соединения - фторхлоруглеводороды (фреоны), используемые в холодильниках, а также в аэрозольных товарах. Фреоны летучи и поднимаются в стратосферу. Там они могут разлагаться, высвобождая атомарный хлор, который разрушает озон. В 1985 г. спутниковые наблюдения обнаружили "дыру" в озоновом экране над Южным полюсом.
Исследования стратосферы над Арктикой показали, что и тут содержание озона может резко сократиться. Таким образом, если выбросы фреонов будут продолжаться, можно ожидать расширения озоновых дыр над полюсами. Международное сообщество, озабоченное этой тенденцией, уже ввело ограничения на выбросы фреонов Венской конвенцией об охране озонового слоя (1985).
ЗАГРЯЗНЕНИЕ ГИДРОСФЕРЫ
Ароматические соединения
Ароматические соединения поступают в биосферу различными путями и их источниками служат промышленные предприятия, транспорт, бытовые стоки. Особое внимание, уделяемое ароматическим соединениям, в значительной степени вызвано их канцерогенными свойствами. Собственно ароматические соединения или полициклические ароматические углеводороды – ПАУ поступают в атмосферу в результате выбросов и отходов коксохимических заводов, некоторых химических заводов, выхлопов двигателей внутреннего сгорания, продуктов сжигания различных видов топлива. В стоках коксохимических заводов содержится и большое количество фенольных соединений. Грунтовые воды нередко загрязняются ПАУ за счет различных осадков сточных вод. Фенольными соединениями вообще представлена большая группа ксенобиотиков антропогенного происхождения.
К настоящему времени накоплено довольно много материалов о содержании ПАУ в почвах, их устойчивости, темпах накопления в результате техногенных процессов. Изучены многие соединения, в том числе нафталин, антрацен, пирен, хризен, фенантрен, флуорантен, бензантрацен, бензпирен, коронен и др. 1,2-Бензпирен – один из наиболее сильных канцерогенов, обладает значительной эстрагенной активностью; в опытах на мышах попадание спиртового раствора на кожу вызывал развитие опухоли в течении 90–100 суток, внутримышечная инъекция – быстрое развитие саркомы. 4,5-Бензпирен канцерогенными свойствами не обладает.
Развитие промышленности и транспорта за последнее столетие резко увеличило содержание ПАУ в верхних горизонтах почв. Например, в верхнем слое почвы Ротамстедской опытной станции (Великобритания), где единственным источником ПАУ могли быть только атмосферные выпадения, содержание ПАУ увеличилось с 1850 г. от 250 – 300 нг/г до 1700 – 1800 нг/г к 1985 г. – примерно в 6 – 7 раз. С наибольшей скоростью нарастало содержание бензфлуорантенов, флуорантена, пирена и бензпиренов.
Исследования верхних горизонтов ряда почв ФРГ и Швейцарии в 1970 – 1975 гг. выявили высокое содержание ПАУ. Были найдены и количественно определены углеводороды: флуорантен, бензфлуорантен, бензпирен, бензперилен и индопирен. В большинстве проб содержание бензпирена составляло от 2 до 50 мкг/кг, но в отдельных пробах оно превышало 1000 мкг/кг. Сумма ПАУ составляла от 50 до 500 мкг/кг, но в 13 пробах она превышала 500 мкг/кг, а в четырех была больше 3000 мкг/кг. Такие высокие концентрации, несомненно, вызваны промышленным загрязнением. Диапазон содержаний бензпирена (в мкг/кг) составляет:
для США — 90 – 1300,
ФРГ — 8 – 82,
Франции — 2 – 170,
России — 0,1 – 350,
Исландии — 0 – 785.
Наибольшие концентрации были связаны с близко расположенными городами, наименьшие – свойственны удаленным лесным массивам.
Попадающие в почву и природные воды ПАУ могут мигрировать, связываться твердыми фазами и взвесями, трансформироваться в другие соединения. Из ароматических углеводородов только бензол может диффундировать в пористой почвенной среде в газообразной форме, но коэффициенты диффузии невелики и при 20°С близки к 9 ∙ 10-6 м2/с.
Закономерности адсорбции ПАУ как неполярных гидрофобных соединений различными минеральными и органическими частицами полностью не изучены. Сорбционная способность в значительной мере зависит от уровня растворимости ароматического соединения.
Особое, значение для оценки уровня опасности загрязнения природных сред ароматическими углеводородами имеет скорость их трансформации, разложения или потерь из водных и почвенных сред.
Наблюдения говорят об исчезновении ПАУ из почвы; возможна их частичная трансформация, частично — адсорбция твердыми фазами. В последнем случае токсичность ПАУ снижается, но может происходить их постепенное накопление со временем и проявление токсичных эффектов при достижении определенного уровня содержания.
В числе механизмов разрушения ПАУ особенно важны два: транс-формация конкретными видами микроорганизмов и фотохимическая деструкция. В почвах, загрязненных нафталином, присутствуют бактерии рода Pseudomonas, которые могут использовать нафталин как единственный источник углерода (Старовойтов 1975г.).
Из-за высокой устойчивости ПАУ длительно сохраняются в почвах. Ускорить трансформацию ПАУ, в частности бензпирена, удается при их облучении ультрафиолетовым светом (300 нм) или природным солнечным светом. ПАУ легко поглощают энергию электромагнитных колебаний, и через 1,5 ч облучения количество бензпирена снижается на 50–60%. Трансформация ускоряется в несколько раз в присутствии окислителей, например пероксида водорода. Такой процесс может иметь существенное значение для поверхностных слоев почвы, которые обычно наиболее сильно загрязнены ПАУ.
Среди ароматических соединений ПАУ наиболее устойчивы в почвах. Менее устойчивы, но способны образовывать в почвах устойчивые продукты трансформации – анилин, индолы; наименее устойчивы – фенолы и их производные, относящиеся к группе веществ, обладающих высокой фитотоксичностью.
Фенолы поступают в биоценозы различными путями, в том числе – с промышленными стоками коксохимического производства, некоторых химических производств. Фенолы содержатся в осадках городских сточных вод и могут выщелачиваться оттуда атмосферными осадками, попадая с жидким стоком в почвы и водоемы. Скорость разложения фенолов в почвах довольно велика. При исходных дозах 500 мг/кг фенол не обнаруживался в почвах уже через 6 суток, крезолы – через 7–11 суток. Скорость трансформации составляет примерно 40–120 мг в сутки. Наиболее вероятные механизмы реакции связаны с деятельностью микроорганизмов; так установлены реакции окисления, катализируемые фенолоксидазой (Медведев).
По другим данным наибольшая скорость трансформации в почве найдена для о -крезола (62 мг/кг∙дн), наименьшая – для пентахлорфенола (1,0 мг/кг∙дн). Характерно, что менее токсичные фенолы разлагаются быстрее высокотоксичных, что указывает на биологический характер процесса разложения. Продукты окисления могут связываться глинистыми минералами или инкорпорироваться гуминовыми веществами. Аналогичные механизмы установлены и для большой группы иных ксенобиотиков, в том числе для пестицидов (особенно производных фенолуксусной кислоты), хлоранилинов; сходным путем трансформируются феноксикислоты – ванилиновая и сиреневая. Для большинства фенольных соединений сорбция (или хемосорбция) наиболее хорошо выражена для глин, насыщенных ионами Fe, меньше сорбируют Al -глины, еще меньше – глины, насыщенные ионами Cu или Ca (через образование комплексных соединений). Могут возникать растворимые комплексы с тяжелыми металлами, которые активно мигрируют в почве. Почва при этом освобождается от тяжелых металлов, хотя природные воды испытывают вторичное загрязнение. В этом также проявляется противоречивость многих почвенно-химических процессов.
5.2. Стойкие органические загрязнители – СОЗ
Двенадцать СОЗ, в отношении которых на международном уровне нужно немедленное принятие мер в глобальном масштабе:
| Пестициды:
- альдрин
- хлордан
- ДДТ
- дильдрин
- эндрин
- гептахлор
- мирекс
- токсафен
| Промышленные химические вещества:
- гексахлорбензол
- ПХБ (полихлорированные бифенилы)
|
| Нецелевые побочные продукты:
- диоксины
- фураны
|
Могут достигать концентраций в 70 тыс. раз превышающие фоновые (предельно допустимые). Пр.: результаты анализа на диоксины (превышение ПДК): в Новокузнецке (снег) – в 30 раз; в Ильинке (молоко) – в 10 раз. Стоимость одного анализа на диоксины 800-2000 $.
Диоксиновые аварии: 1953 – Германия, 1954 – Германия (Гамбург), 1972 – Италия. С 1996 года всемирное запрещение производства диоксинов (программа ООН).
Полихлорированные дибензо- n -диоксины (ПХДД) и дибензофураны:
«Диоксин» - 2,3,7,8-тетрахлордибензо[b,e]-1,4-диоксин; бесцветные кристаллы, без запаха, не разлагается до 750ºС, растворимость в воде – 0,001%. Химически инертен. Период полуразложения в почве 0,5-1 года; по другим источникам – от 1 года до 14 лет. Период полуразложения чистыми бактериальными культурами – 1 год. Разрушение под действием ультрафиолетового излучения (<290 нм) происходит значительно быстрее. Разложению способствуют органические доноры протонов: гексан и оливковое масло.
Образуется как побочный продукт при синтезе 2,4,5-трихлорфенола – полупродукта для получения гербицидов 2,4,5-трихлорфеноксиуксусной кислоты и ее эфиров. Источниками загрязнения окружающей среды диоксинами является также побочные продукты целлюлозно-бумажной промышленности, отходы металлургической промышленности, выхлопные газы двигателей внутреннего сгорания.
«Диоксин» - высокотоксичное вещество, обладающее разносторонней физиологической активностью; раздражает кожу (минимальная доза 0,0003 мг/кг), поражает печень, обладает тератогенными(?), мутагенными, канцерогенными(?) свойствами. Промотор роста опухолей, инициированных первичными канцерогенами.
Способен накапливаться в организме. В организм человека попадет с пищей. Через кишечный эпителий проникает в кровяное русло, где связывается белками крови. Впоследствии депонируется в печени и жировой ткани.
ЛД50=0,6-2 мкг/кг (морские свинки), ЛД50=20-30 мкг/кг (крысы, мыши, куры, собаки, обезьяны). По другим источникам: ЛД50 0,07 мг/кг (обезьяны-самцы, перорально).
Обезвреживание диоксинов основано на его дехлорировании.
Таблица 1. Источники эмиссии и баланс диоксинов (Швеция, 1997)
| Источники
|
Эмиссия диоксинов
|
| г/год
| %
|
| Мусоросжигательные печи (дымовые газы)
| 30-50
| 19
|
| Печи для сжигания производственных отходов (дымовые газы)
|
2-6
|
2
|
| Сжигание отходов от больниц (дымовые газы)
| ~10
| ~3
|
| ТЭЦ на угле (дымовые газы)
| ~1
| <1
|
| Грузовые автомобили (выхлопные газы)
| 5-15
| 6
|
| Металлургическая промышлен-ть (дымовые газы)
| 50-150
| 56
|
| Бумага и целлюлоза:
|
|
|
| - газы
| 4-6
| 2
|
| - сточные воды
| 15-30
| 11
|
«Диоксины» малоподвижны в окружающей среде, т.к. малорастворимы в воде, прочно связываются с осадками в водных системах и проявляют низкую вертикальную подвижность. Горизонтальная подвижность связана с процессами эрозии.
Таблица 2. Летальные дозы (ЛД) некоторых ядов
| ЛД50 яд кобры
| ~0,1 мг/кг (белые мыши, в/м)
|
| ЛД50 тетродотоксин (фугу)
| ~0,008 мг/кг (белые мыши, в/м)
|
| ЛД50 палитоксин (полипы)
| ~0,00015 мг/кг (белые мыши, в/м)
|
| ЛД100 никотин
| ~6 мг/кг (кролики, в/в)
|
| ЛД100 курарин
| 0,25-0,4 мг/кг (человек, в/в)
|
| ЛД50 аконитин
| 0,004 мг/кг (лошадь, в/в)
|
| ЛД50 мускарин
| 0,23 мг/кг (белые мыши, в/в)
|
| ЛД ботулотоксин
| ~0,00005 мг/кг (человек, перорально), ~0,0003 мг на человека
|
| ЛД100 KCN
| 1,7-2 мг/кг (человек, перорально), 120 мг на человека
|
| ЛД зоман
| 2 мг/кг (человек, резорбция через кожу)
|
| Л концентрация зоман
| 0,02 мг/л при экспозиции 1 мин. (человек)
|
| ЛД50 диоксин
| ~0,02-0,03 мг/кг (обезьяны, в/м)
|
ЗАГРЯЗНЕНИЕ ОКРУЖАЮЩЕЙ СРЕДЫ,



 ,
,

