При моделировании тепловых процессов применяют теорию подобия, согласно которой два процесса подобны, если они могут быть выражены одинаковой системой дифференциальных уравнений и имеют подобные условия однозначности (геометрические, физические, временные и краевые условия). Процесс затвердевания изучается на моделях (растворах солей, даже на стеарине), а затем результаты измерений переносятся на процесс затвердевания реальных отливок.
Кроме перечисленных групп, можно использовать графические методы которые позволяют по графикам, номограммам, построенным на основании опытных данных, подтвержденных аналитически, определить время затвердевания для конкретных отливок, установить зависимость времени от температуры и другие зависимости. См. вопрос. 47.

36. Инженерный (критериальный) метод расчета тепловых процессов в литейной форме. Построение температурного поля «отливка-форма» с расчетом временных изотерм теплопередачи от жидкого сплава форме
Обычные для практики технологические условия формирования отливок могут быть учтены по методу Н.Г. Гиршовича, Ю.А. Нехендзи и Б.Б. Гуляева, который состоит в том, что первоначально расчет ведут по строгим формулам классического решения, а затем в него вводят поправки на влияние технологических факторов. При этом классическое решение представляют в критериальном виде. Наибольшее значение имеют следующие критерии теплового подобия:
1) KL = L / (С * Q3) – критерий скрытой теплоты затвердевания (L – скрытая теплота затвердевания; Q3 – теплоемкость твердого тела: Q3 = tЗ – tО.Ф., где tЗ – температура кристаллизации и tО.Ф. – начальная температура формы до закалки). Этот критский характеризует относительную тепловую мощность процесса;
2) Кв = bф / bм – критерий тепловой активности, представляющий отношение коэффициентов теплоаккумуляции формы и металла, т.е.  (l – коэффициент теплопроводности; с – теплоемкость; g – плотность). М и Ф обозначают соответственно металл и форму. Критерий КВ характеризует интенсивность теплообмена между отливкой и формой. По своему физическому смыслу он близок к критерию Био;
(l – коэффициент теплопроводности; с – теплоемкость; g – плотность). М и Ф обозначают соответственно металл и форму. Критерий КВ характеризует интенсивность теплообмена между отливкой и формой. По своему физическому смыслу он близок к критерию Био;
3) 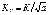 – критерий коэффициента затвердевания (К – коэффициент затвердевания; а – коэффициент температуропроводности металла). Критерий Кк связан с критерием Фурье соотношением
– критерий коэффициента затвердевания (К – коэффициент затвердевания; а – коэффициент температуропроводности металла). Критерий Кк связан с критерием Фурье соотношением 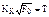 .
.
Основное уравнение классического решения записывают через эти критерии следующим образом: 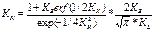 (1), что согласуется с законом квадратного корня затвердевания.
(1), что согласуется с законом квадратного корня затвердевания.
Экспериментальные методы (метод жидкого остатка, прямого измерения температурного поля отливки и формы, аналоговые и др.) основаны на прямом измерении скорости перемещения твердого слоя металла в зависимости от времени (t). По измеренным величинам рассчитывается константа затвердевания (К) и затем по закону квадратного корня высчитывают толщину затвердевшего слоя металла (х): 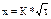 (2).
(2).
Применение закона квадратного корня ограничивают в случае затвердевания металла, кристаллизующегося при определенной постоянной температуре, залитого без перегрева и без термического сопротивления зазора, поэтому его можно применять для плоских отливок, затвердевающих в формах ограниченной протяженности при следующих условиях:
а) длина и ширина плоской отливки должны быть достаточно велики по сравнению с ее толщиной, чтобы торцы отливки не оказывали существенного влияния на ее теплообмен с формой;
б) толщина слоя формы должна быть достаточно большой, чтобы за время эатвердевания отливки наружная поверхность формы не прогрелась заметно.
Принимается, что теплофизические свойства металла и материала не зависят от температуры.
Формула (2), главным образом, применяется для определения величины КК по заданным значениям КL и КВ. По его значению находят коэффициент затвердевания 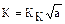 и далее по формуле (2) скорость нарастания затвердевшего сдоя металла, т.е. кинетику затвердевания или полную продолжительности затвердевания отливки t3.
и далее по формуле (2) скорость нарастания затвердевшего сдоя металла, т.е. кинетику затвердевания или полную продолжительности затвердевания отливки t3.
Для этого следует положить: 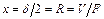 , где d – абсолютная толщина плоской отливки; R – ее приведенная толщина; V – ее объем; F – площадь поверхности охлаждения.
, где d – абсолютная толщина плоской отливки; R – ее приведенная толщина; V – ее объем; F – площадь поверхности охлаждения.
Откуда: 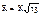 .
.
Трансцендентное уравнении (1) удобнее всего решается с помощью графического построения КК = f(КВ) для значения критерия KL, характеризующих определенные металлы.
Для каждого из этих значений КК (во всех случаях КL = 0,25) с помощью таблицы 11 находим по формуле (1) соответствующее значение КВ: 0,12; 0,25; 0,33; 0,55; 1,0 – и строим график КК = f(КВ) для ряда металлов (рис.1).
Каждая из кривых рис.1 асимптотически приближается к определенному значению КК, отвечающему бесконечно большой интенсивности теплообмена (КВ = ¥), например, когда металл затвердевает в водоохлаждаемом кристаллизаторе. Для расчета температурных полей отливки и формы (для периода затвердевания отливки) воспользуемся классическим решением, представленным следующими формулами:
1 – для стали при КL = 0,25; 2 – для меди при КL = 0,32; 3 – для чугуна при КL = 0,4; 4 – для алюминия при КL = 0,57; 5 – для свинца при КL = 0,68
Рис.1. График для определения критерия КL по значениям критериев КВ и КК
- 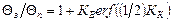 . Эта формула дает возможность определить температуру поверхности затвердевающей отливки, которую нужно знать при расчетах температурных полей отливки и формы.
. Эта формула дает возможность определить температуру поверхности затвердевающей отливки, которую нужно знать при расчетах температурных полей отливки и формы.
 -
- 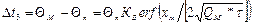
- 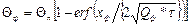 ;
;
где Q – «избыточная» температура над начальной температурой формы, т.е. Q = t – tо.ф. (t – данная температура); индексы «n», «м», «ф» обозначают поверхность отливки, металл и форму соответственно; х – расстояние рассматриваемых точек в металле, отсчитанное от поверхности отливки; t – время от момента заливки (предполагается, что металл заполняет форму мгновенно).
Основы термодинамической теории кристаллизации. Рост кристаллов с изменением свободной энергии в системе «твердый сплав – жидкий сплав». Факторы, влияющие на свободную энергию системы и скорость кристаллизации (графики, рисунки)
Образование кристаллов при переходе металла из жидкого или газообразного состояния в твердое называется первичной кристаллизацией, а изменение формы кристаллов в твердом состоянии - вторичной. От первичной зависит и вторичная, поэтому она определяет свойства готовой отливки.
Для образования кристаллов из расплава необходим зародыш или центр кристаллизации.
Различают два способа образования зародышей: гомогенный и гетерогенный.
С повышением температуры число и размеры кластеров уменьшаются. По мере приближения температуры расплава к точке кристаллизации устойчивость и продолжительность «жизни» их повышается, а при определенной температуре они приобретают полную устойчивость и становятся центрами кристаллизации. Происходит спонтанная кристаллизация, и кристаллы начинают расти на кластерах. Такой тип зарождения кристаллов называется гомогенным.
При гетерогенном образовании зародышей кристаллы растут на инородных зародышах (различных включениях в расплаве).
Для начала кристаллизации необходимо уменьшить свободную энергию, то есть переохладить расплав, отвести некоторое количество теплоты, чтобы на имеющихся зародышах начался рост кристалла.
Зависимость свободной энергии G от температуры, как следует из рис.1 различна для жидкой и твердой фаз. При температуре меньше То, более низкую свободную энергию G имеет жидкая фаза, поэтому она будет более устойчивой.
При Тo кривые пересекаются - это температура термодинамического равновесия фаз и в этом случае Gт = Gж, то есть обе фазы обладают одинаковой энергией, достаточной для внешней работы.
Процесс кристаллизации может устойчиво идти при условии Gт < Gж, для чего требуется, чтобы температура кристаллизации (Ткр) была ниже То.
Рис. 1. Изменения свободной энергии жидкой Gж и твердой Gт фаз в зависимости от температуры
Разность температур То – Ткр = DТ называется переохлаждением, которое обеспечивает достаточную для начала кристаллизации разность свободных энергий Gж – Gт. За счет разности энергий возмещается работа, необходимая для образования и роста зародышей: А = 32 s3 [ М.То / r q(То- Ткр)]2, где s – поверхностное натяжение на грани растущего кристалла; М – молекулярная масса вещества кристалла; r – плотность вещества кристалла; q – теплота плавления 1 моля вещества кристалла; То –Ткр – степень переохлаждения.
Свободная энергия (энергия Гиббса) определяется соотношением: G = E – TS + pV = H – ST, где Е – внутренняя энергия, S – энтропия (мера разупорядоченности фазы, то есть мера рассеянной энергии); Т – абсолютная температура; р – давление; V – объем; Н – энтальпия.
При температуре равновесной кристаллизации То: Gт = Gж, то есть Нж – SжТо = Нт – SтТо.
Разность энтальпий жидкой и твердой фаз равна теплоте кристаллизации: DН = L = Hж – Тт = (Sж – Sт)То = DSto, то есть L = DSto.
При переохлаждении DТ с выделением теплоты кристаллизации происходит уменьшение объемной свободной энергии (химической составляющей энергии Гиббса): DGV = (Gж – Gт) V, где V – объем.
При образовании сферического зародыша: DGV = -LDT/To*4/3pr3 одновременно происходит повышение объемной и поверхностной энергии (GS) в результате образования поверхности раздела фаз DGS = s4pr2.
Следовательно, процесс кристаллизации протекает в результате изменения общей свободной энергии: DGобщ = DGV + DGS = -LDT / To 4/3 pr3 + s4pr2
Кристаллизация металлов осуществляется в результате образования кристаллических зародышей, вырастающих затем в зерна или кристаллы путем присоединения атомов. Зародышеобразование начинается тогда. Когда кинетическая энергия несколько атомов жидкого металла достигает достаточно низкого уровня, позволяющего им занять узлы кристаллической решетки, свойственной данному металлу. Рост зародышей развивается по мере отвода от металла тепла. В результате теплоотвода через стенки формы и излучения с поверхности расплава преимущественное формирование зародышей проходит на самых внешних поверхностях металла, расположенных у стенок литейной формы, а также на неметаллических веществах, таких как оксидные пленки на поверхности расплава.
Поскольку расплав всегда контактирует с материалом литейной формы, а также вследствие наличия теплового потока зона наибольшего переохлаждения должна находиться на наружной поверхности расплава, то есть зародышеобразование проходит наиболее легко в наружной поверхности расплава в форме.
Зародыш может контактировать с посторонним твердым веществом по плоскости, ребру или в точке. Очевидно, что первый случай обеспечивает наименьшую поверхностную энергию системы. Если зародыши, контактирующие со стенками формы, преимущественно вырастают в стабильные кристаллы, то литая структура на наружной поверхности должна состоять только из кристаллов, выросших перпендикулярно к поверхности стенки формы (рис.4,а). Однако в реальных условиях затвердевания металлов наружная область представляет собой резко охлажденную зону случайно ориентированных кристалликов (рис.4,б).
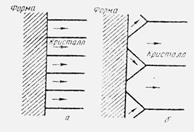
Рис.4. Схема направления (→) преимущественного роста кристаллов на стенке литейной формы
С одной стороны, форма имеет шероховатую поверхность и поглощает воздух и влагу еще до заливки жидкого металла (рис.5,а). С другой стороны, поверхность жидкого металла в большинстве случаев покрыта слоем окислов и часто содержит неметаллические включения (рис.5,б). Следовательно, только те зародыши, которые хорошо контактируют со стенками формы, находятся в условиях преимущественного роста.
Ввиду того, что теплопроводность стенок формы микроскопически неоднородна, локальный преимущественный рост зародышей осуществляется в местах повышенной теплопроводности.
Скорость образования зародышей можно рассчитать на основе того, что дозародыш, содержащий I атомов, обладает вероятностью Р+ захватить атом, превратившись при этом в комплекс из (i + 1) атомов, и вероятностью потерять атом. При равновесии значения ni, ni+1 и т.д. таковы, что число дозародышей, покидающих i-тое состояние, равно в любой данный момент числу переходящих в такое состояние атомов. Критический зародыш – это комплекс, у которого Р+ = Р, так что зародыш этих размеров с равной вероятностью может расти или расплавляться.
Если предположить, что дозародыши всех размеров и всех структур находятся в равновесии, то число критических зародышей в единичном объеме определяется выражением: 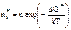 , где ∆G* = (16πσ3)/(∆Gр)2 - избыток свободной энергии критического зародыша.
, где ∆G* = (16πσ3)/(∆Gр)2 - избыток свободной энергии критического зародыша.
Если теперь предположить, что каждый критический зародыш перерастет в кристалл и тем самым в распределении комплексов по размерам более не участвует, то соответствующая скорость образования зародышей определяется скоростью, с которой более мелкие дозародыши достигают критических размеров. Скорость образования зародышей I определяется в виде:  , где Z – результирующая скорость переноса атомов через поверхность раздела между жидкостью и дозародышем; S* – площадь поверхности критического зародыша; ni* – равновесное число критических зародышей.
, где Z – результирующая скорость переноса атомов через поверхность раздела между жидкостью и дозародышем; S* – площадь поверхности критического зародыша; ni* – равновесное число критических зародышей.
Это выражение можно преобразовать к виду: 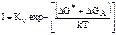 , где ∆GА – свободная энергия активации перехода атомов из жидкости в кристалл; Кν определяется равенством
, где ∆GА – свободная энергия активации перехода атомов из жидкости в кристалл; Кν определяется равенством 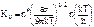 , где а – зависит от формы зародыша (не обязательно сферической); n* – число атомов на поверхности критического зародыша; n – число атомов в единичном объеме жидкости.
, где а – зависит от формы зародыша (не обязательно сферической); n* – число атомов на поверхности критического зародыша; n – число атомов в единичном объеме жидкости.
Такой анализ скорости образования зародышей предполагает, что в любой момент достигается равновесное распределение дозародышей по размерам, хотя часть самых крупных дозародышей может превратиться в зародыши и разрастись до более крупных размеров. Это предположение достаточно верно и для проблемы образования зародышей жидкой капли в паровой фазе, но не годится для зарождения кристаллов в жидкости, поскольку из-за сравнительно низкой подвижности атомов жидкости равновесное распределение в ней устанавливается гораздо медленнее. Действительная, или переходная, скорость образования зародышей It определяется в виде:
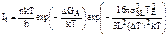 .
.
Рост кристаллов. Теоретически возможны различные механизмы роста кристаллов.
1 – путем присоединения отдельных атомов к гладкой грани кристалла, линейная скорость роста при этом прямо пропорциональна переохлаждению.
2 – путем присоединения атомов к постоянно существующей ступеньке на грани, образованной выходом винтовой дислокации. Скорость роста в этом случае пропорциональна квадрату переохлаждения.
3 – рост связан с появлением двумерных зародышей на гладкой грани кристалла. В этом случае скорость роста определяется экспоненциальной зависимостью от переохлаждения.
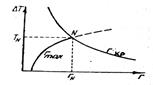
Рис.6. Условие образования зародышей
Скорости роста реальных металлических кристаллов обычно невелики и при переохлаждениях в 1-5 К составляют 1-10 мм/с. В экстремальных условиях, когда переохлаждение достигает десятков кельвинов, скорости роста доходят до 500-1000 мм/с.




 (l – коэффициент теплопроводности; с – теплоемкость; g – плотность). М и Ф обозначают соответственно металл и форму. Критерий КВ характеризует интенсивность теплообмена между отливкой и формой. По своему физическому смыслу он близок к критерию Био;
(l – коэффициент теплопроводности; с – теплоемкость; g – плотность). М и Ф обозначают соответственно металл и форму. Критерий КВ характеризует интенсивность теплообмена между отливкой и формой. По своему физическому смыслу он близок к критерию Био;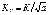 – критерий коэффициента затвердевания (К – коэффициент затвердевания; а – коэффициент температуропроводности металла). Критерий Кк связан с критерием Фурье соотношением
– критерий коэффициента затвердевания (К – коэффициент затвердевания; а – коэффициент температуропроводности металла). Критерий Кк связан с критерием Фурье соотношением 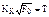 .
.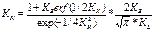 (1), что согласуется с законом квадратного корня затвердевания.
(1), что согласуется с законом квадратного корня затвердевания.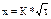 (2).
(2).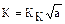 и далее по формуле (2) скорость нарастания затвердевшего сдоя металла, т.е. кинетику затвердевания или полную продолжительности затвердевания отливки t3.
и далее по формуле (2) скорость нарастания затвердевшего сдоя металла, т.е. кинетику затвердевания или полную продолжительности затвердевания отливки t3.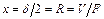 , где d – абсолютная толщина плоской отливки; R – ее приведенная толщина; V – ее объем; F – площадь поверхности охлаждения.
, где d – абсолютная толщина плоской отливки; R – ее приведенная толщина; V – ее объем; F – площадь поверхности охлаждения.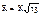 .
.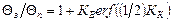 . Эта формула дает возможность определить температуру поверхности затвердевающей отливки, которую нужно знать при расчетах температурных полей отливки и формы.
. Эта формула дает возможность определить температуру поверхности затвердевающей отливки, которую нужно знать при расчетах температурных полей отливки и формы. -
- 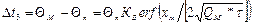
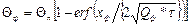 ;
;
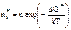 , где ∆G* = (16πσ3)/(∆Gр)2 - избыток свободной энергии критического зародыша.
, где ∆G* = (16πσ3)/(∆Gр)2 - избыток свободной энергии критического зародыша. , где Z – результирующая скорость переноса атомов через поверхность раздела между жидкостью и дозародышем; S* – площадь поверхности критического зародыша; ni* – равновесное число критических зародышей.
, где Z – результирующая скорость переноса атомов через поверхность раздела между жидкостью и дозародышем; S* – площадь поверхности критического зародыша; ni* – равновесное число критических зародышей.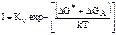 , где ∆GА – свободная энергия активации перехода атомов из жидкости в кристалл; Кν определяется равенством
, где ∆GА – свободная энергия активации перехода атомов из жидкости в кристалл; Кν определяется равенством 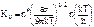 , где а – зависит от формы зародыша (не обязательно сферической); n* – число атомов на поверхности критического зародыша; n – число атомов в единичном объеме жидкости.
, где а – зависит от формы зародыша (не обязательно сферической); n* – число атомов на поверхности критического зародыша; n – число атомов в единичном объеме жидкости.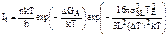 .
.



