Резюме
· Селен выполняет различные биологические функции в основном как часть аминокислоты селеноцистеин, который содержится по меньшей мере в 25 селеноцистеинсодержащих белках (селенопротеинах). (Больше информации)
· Пять глутатионпероксидаз, три тиоредоксинредуктазы, три йодтирониндеодиназы и одна метионинсульфоксидредуктаза B1 являются одними из наиболее хорошо охарактеризованных селенопротеинов с известными функциями. (Больше информации)
· Нарушение антиоксидантной защиты у людей с дефицитом селена может повлиять на физиологические реакции на стресс. Кешанская кардиомиопатия и остеоартропатия Кашина-Бека являются заболеваниями, возникающими именно в районах с дефицитом селена в Азии. (Больше информации)
· Текущий рекомендуемый рацион питания (RDA), установленный Медицинским институтом США, составляет 55 мкг / день для подростков и взрослых всех возрастов. (Больше информации)
· Ранние обсервационные исследования выявили либо нулевую, либо обратную связь между воздействием селена и риском развития злокачественных новообразований на месте. Тем не менее, текущие данные из интервенционных испытаний у участников с высоким содержанием селена не подтверждают защитный эффект добавок селена против рака. (Больше информации)
· Предварительные данные рандомизированных контролируемых исследований показывают, что добавки селена могут предотвратить прогрессирование вирусной нагрузки и увеличить количество иммунных клеток у ВИЧ- позитивных пациентов. (Больше информации)
· Уровни и химические формы селена в растительной пище варьируются в зависимости от состава и содержания селена в почве, в которой выращиваются растения. К источникам пищи, богатым селеном, относятся бразильские орехи, зерновые, морепродукты, мясо органов, птица и молочные продукты. (Больше информации)
· Допустимый верхний уровень потребления (UL) для селена составляет 400 мкг / день для подростков и взрослых и включает как селен, полученный из пищи, который в среднем составляет около 100 мкг / день для взрослых в США, так и селен из добавок. (Больше информации)
· Поскольку некоторые данные свидетельствуют о том, что высокие концентрации селена в сыворотке могут оказывать неблагоприятное влияние на контроль гликемии, лицам с высоким уровнем селена и / или лицам с риском развития сахарного диабета 2 типа следует избегать приема добавок селена. (Больше информации)
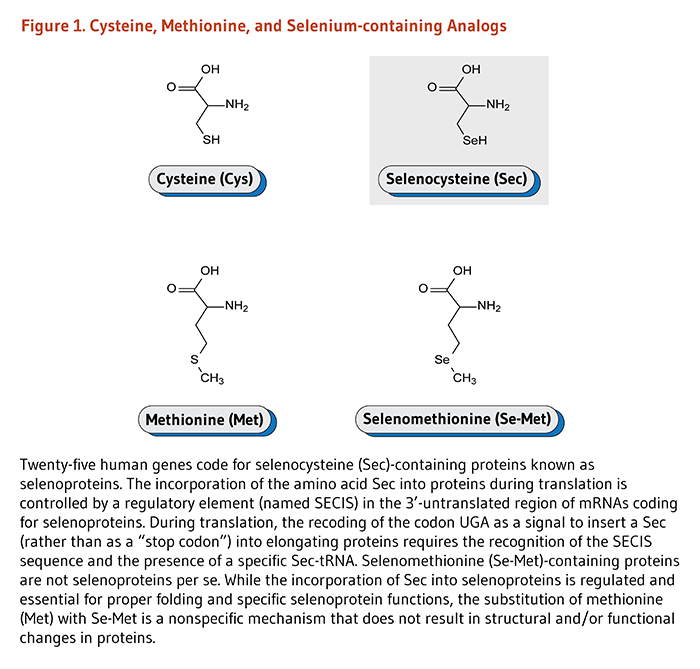
Селен является след элемент, который имеет важное значение в небольших количествах, но, как и все основные элементы, селен может быть токсичным при высоких уровнях. В отличие от растений, большинству животных, включая людей, требуется селен для надлежащего функционирования ряда селен-зависимых ферментов, известных как селенопротеины. Во время синтеза белка (трансляции) аминокислота селеноцистеин включается в удлиненные белки в очень специфических местах аминокислотной последовательности для образования функциональных селенопротеинов. Хотя высшие растения, по-видимому, не требуют селена для выживания, они могут неспецифично включать его в серосодержащие молекулы, когда минерал присутствует в почве.(1). Следует отметить, что у животных аминокислота селенометионин может неспецифически включаться в белки вместо метионина (2). Тем не менее, только селеноцистеин-содержащие белки рассматриваются как селенопротеины (рис. 1).
Функция
Селенопротеинов
Двадцать пять генов, кодирующих селенопротеины, были идентифицированы у людей (3). Вставка селеноцистеина в селенопротеины во время трансляции определяется наличием последовательности вставки селеноцистеина (SECIS) в мРНК селенопротеина. Вкратце, распознавание SECIS трансляционным механизмом приводит к набору специфических трансляционных факторов, которые декодируют встроенные UGA-кодоны, путем вставки селеноцистеина в элонгационные селенопротеины (4).
Исследования постепенно раскрывают метаболические функции всех человеческих селенопротеинов, включая варианты сплайсинга (3). Некоторые из селенопротеинов с идентифицированной функцией включают в себя:
Глутатионпероксидазы
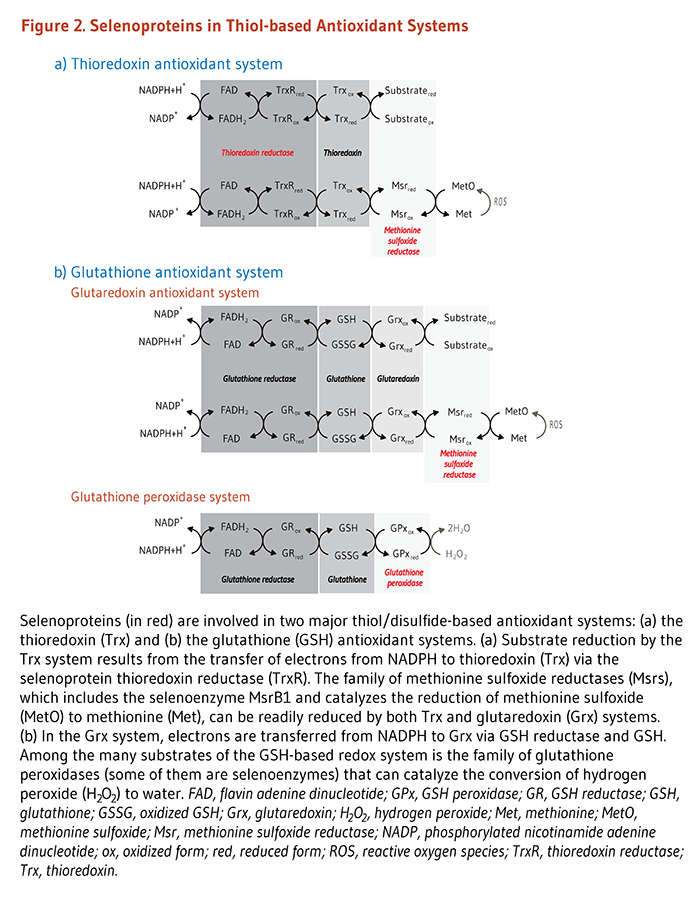
Было идентифицировано пять селенсодержащих глутатионпероксидаз (GPx1-4 и GPx6): GPx1 (цитозольный GPx), GPx2 (специфичные для эпителиальных клеток GPx, экспрессируемые в слизистой оболочке кишечника и легких), GPx3 (высоко экспрессированные в щитовидной железе и почках), GPx4 (фосфолипид-гидропероксид GPx; PHGPx) и GPx6 (экспрессируется в обонятельном эпителии) (4). GPX изоферменты все антиокислительные ферменты, которые уменьшают потенциально опасные активные формы кислорода (ROS), такие как перекись водорода и гидроперекиси липидов, до безвредных продуктов, таких как вода и спирты путем сочетания их снижения с окислением из глутатиона (рис 2). сперматогенези мужская фертильность сильно зависит от GPx4 и селенопротеина P (SEPP1; см. ниже). В яичках GPx4 уменьшает гидропероксиды фосфолипидов, тем самым защищая незрелые клетки сперматозоидов от окислительного стресса. GPx4 также является основным структурным белком капсулы, в которую входит зрелая митохондриальная спираль сперматозоидов, участвующая в подвижности сперматозоидов. SEPP1 необходим для снабжения яичка селеном, и модели на животных, в которых отсутствует ген SEPP1, бесплодны из-за плохой биодоступности тканей селена, дефектного синтеза GPx4 и нарушения созревания сперматозоидов (5).
Тиоредоксинредуктазы
У млекопитающих в тиоредоксиновой системе были идентифицированы три изофермента селеноцистеинсодержащей тиоредоксинредуктазы (TrxR): цитозольный TrxR1, митохондриальный TrxR3 и специфичный для семенников тиоредоксин глутатионредуктаза TGR. TrxR представляют собой гомодимерные ферменты, и каждый мономер содержит FAD- и NADPH-связывающие домены и селеноцистеинсодержащий каталитический сайт. TrxR катализируют восстановление широкого спектра субстратов, в том числе тиоредоксина и дисульфидизомеразы белка (PDI) (см. Рисунок 2 выше). TrxR также служат донорами электронов для регенерации малых антиоксидантов.возможно повторное использование аскорбиновой кислоты (витамин С), α-липоевой кислоты, α-токоферола (витамин Е) и коэнзима Q 10 из их окисленных форм (6). Содержание тиоредоксина в восстановленной форме с помощью TrxRs важно для регуляции роста и выживания клеток. Белок тиоредоксин, вместе с TrxR1 (или TrxR3), NADPH и ФАД, представляют собой тиоредоксин антиоксидантную систему, участвующих в сокращении антиоксидантных ферментов (например, пероксиредоксинов, метионилсульфоксидный редуктаз и рибонуклеотид - редуктазы) и многих окисления / восстановления (окислительно - восстановительного потенциала) -чувствительные сигнальные белки (7), TrxR1 является одним из наиболее исследованных селенопротеинов и рассматривается как один из основных антиоксидантных ферментов и окислительно-восстановительных регуляторов в клетках млекопитающих.
Йодтиронин-дейодиназы (тиодиназы гормонов щитовидной железы)
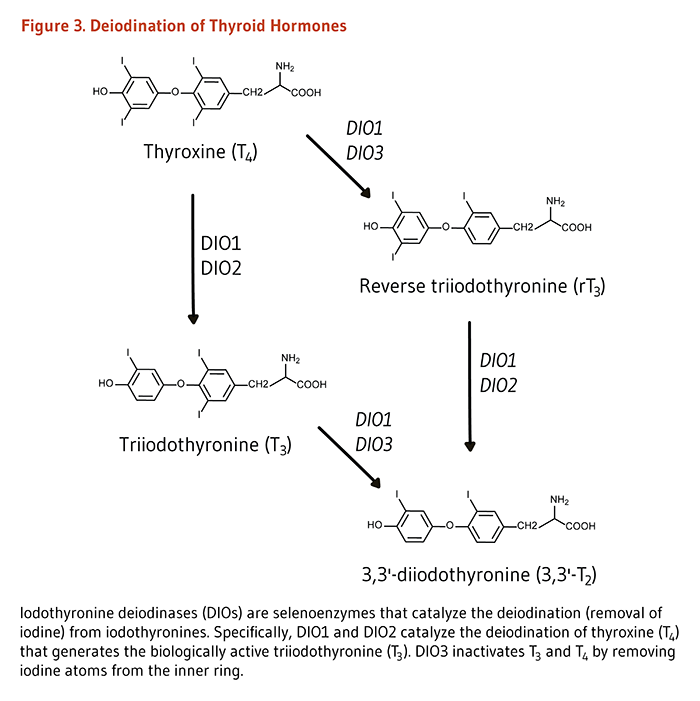
В щитовидной железе высвобождают железы очень небольшое количество биологически активный щитовидную железу гормона (трийодтиронина или Т 3) и большого количества неактивной формы гормона щитовидной железы (T 3 предшественников: тироксин или Т - 4) в обращение. Большая часть биологически активного Т 3 в кровообращении и внутри клеток образуется в результате удаления одного атома йода из Т 4 в реакции, катализируемой селен-зависимыми ферментами йодтирониндейодиназы. Две разные селен-зависимые йодтиронин-дейодиназы (DIOs типа 1 и 2) могут деиодинатировать T 4, таким образом, увеличивая циркулирующий Т 3, в то время как третья йодтирониндейодиназа (DIO тип 3) может превращать как Т 3, так и Т 4 в неактивные метаболиты (рис. 3) (8). Следует отметить, что инактивация генов, кодирующих DIO в моделях грызунов, выявила роль DIO типа 1 в гомеостазе йода и важность DIO типа 2 и 3 в созревании слуховой и зрительной систем во время развития плода (8). Таким образом, значение селена в нормальном развитии, росте и обмене веществ не ограничивается его ролью в регуляции функции щитовидной железы.
Селенопротеин Р
Селенопротеин Р (SEPP1) в основном вырабатывается печенью, основным местом хранения селена, и секретируется в плазме. Гликопротеин полной длины содержит богатый селеном домен с девятью остатками селеноцистеина, а также тиоредоксин-подобный каталитический центр с одним остатком селеноцистеина. SEPP1 представляет собой основную форму транспорта селена в периферические ткани (9). SEPP1 также функционирует в качестве антиоксиданта, который защищает клетки от окислительного повреждения, обеспечивая полную активность тиоредоксинредуктаз и глутатионпероксидаз посредством адекватного снабжения селеном внепеченочных тканей (см. Глутатионпероксидазы). SEPP1, по-видимому, особенно важен для гомеостаза селена в головном мозге и яичках, где рецептор аполипопротеина E 2 (apoER2) облегчает поглощение SEPP1. Мегалин является еще одним специфическим рецептором липопротеинов SEPP1, который помогает ограничить потерю селена в моче за счет повторного поглощения SEPP1 почками (10). Более того, в последнее время SEPP1 участвует в регуляции метаболизма глюкозы и чувствительности к инсулину (11).
Селенопротеин W
Селенопротеин W (SEPW или SelW) существует в разных изоформах (гомологах) и высоко консервативен у разных видов. У людей SEPW экспрессируется во многих тканях, причем самые высокие уровни обнаруживаются в скелетных мышцах и сердце (12). SEPW содержит остаток селеноцистеина и остаток цистеина, который связывается с молекулой глутатиона, что предполагает роль в окислительно-восстановительной регуляции (13). Выражение SEPW коррелирует с состоянием селена и кажется чувствительным к низкому содержанию селена (14, 15). Выражение SEPW в мозге было установлено, для придания защиты от окислительного стресса, индуцированной нейронной гибели клеток (16), SEPW также, по-видимому, является негативным регулятором для 14-3-3 белков. Действительно, было обнаружено, что ингибирование 14-3-3 с помощью SEPW в клетках рака молочной железы увеличивает пролиферацию и выживаемость клеток за счет повышения устойчивости к генотоксическому стрессу (17). Было показано, что в клетках скелетных мышц SEPW уменьшает связывание 14-3-3 с TAZ, позволяя транслокации TAZ в ядро и последующей активации генов дифференцировки мышечных клеток (18), Наконец, было обнаружено, что SEPW предотвращает деградацию рецептора эпидермального фактора роста (EGFR) в эпителиальных клетках молочной железы и предстательной железы в культуре. EGFR конститутивно активируется во многих опухолях, и доказательство роли SEPW в активации и передаче сигналов EGFR может помочь пролить свет на связь между статусом селена и риском развития рака (19).
Селенофосфатсинтетаза 2
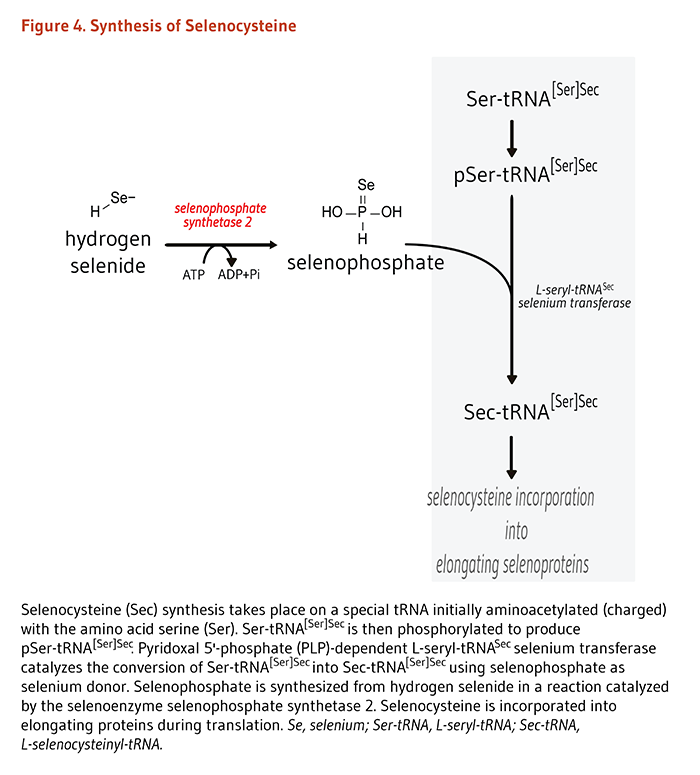
В клетках нет свободного пула аминокислотного селеноцистеина, так что синтез селеноцистеина происходит на специализированной тРНК во время трансляции мРНК селенопротеина. Реакция катализируется пиридоксаль-5'-фосфат (PLP) -зависимой L-серил-тРНК Sec селен-трансферазой и использует селенофосфат (моноселенфосфат) в качестве донора селена (рис. 4) (20). Селенофосфатсинтетаза 2 является селеноферментом, который катализирует АТФ- зависимый синтез селенофосфата из селенида водорода (рис. 4) (3).
Метионин-R-сульфоксидредуктаза B1 (ранее селенопротеин R)
Система восстановления метионинсульфоксида участвует в защите от окислительного стресса и особенно важна для регенерации белков, поврежденных активными формами кислорода (АФК). Действительно, АФК может окислять остатки метионина (метионинсульфоксиды) внутри белков и потенциально ухудшать их активность. У человека, два стереоспецифические семейства метионилсульфоксидных редуктаз (MSRA и MSRB) кодируются с помощью одного MSRA гена и три MSRB генов (MSRB1-3). MsrA катализирует на снижениеS-формы метионинсульфоксида; R-форма метионинсульфоксида уменьшается с помощью MsrB1, 2 или 3. Только MsrB1 был охарактеризован как селенопротеин с одним остатком селеноцистеина в его каталитическом сайте. MsrB1, по-видимому, участвует в окислительно-восстановительной регуляции определенных белков. В макрофагах реорганизация актинового цитоскелета, необходимого для хемотаксиса и фагоцитоза, требует MsrB1-зависимого восстановления остатков метионин-R-сульфоксида в актине (21). Исследования с использованием инактивации гена MSR у мышей также показали, что восстановление метионинсульфоксида участвует в регуляции цикла метионина (см. Обзор в 22). И тиоредоксин (Trx) и GSH-зависимый глутаредоксин (Grx) антиоксидантбыло обнаружено, что системы снижают метионинсульфоксидредуктазы in vitro и / или in vivo (см. рис. 2 выше) (22).
15 кДа селенопротеина
15 кДа селенопротеина (селенопротеин 15; SEP15) высоко экспрессируется в нескольких тканях, включая простату, почку, яички, печень и мозг (23). Хотя его функция неизвестна, было обнаружено, что SEP15 взаимодействует с эндоплазматическим ретикулумом UDP-глюкоза: гликопротеин глюкозилтрансфераза (UGGT), фермент, участвующий в контроле качества свертывания гликопротеина (24, 25). Поскольку SEP15 имеет тиоредоксин-подобный каталитический сайт, считается, что SEP15 регулирует активность UGGT или окислительно-восстановительное состояние субстратов UGGT (26). Было обнаружено, что у мышей, у которых отсутствует функциональный SEP15, развивается ядерная катаракта(помутнение линзы) в очень раннем возрасте, что позволяет предположить, что SEP15 может иметь решающее значение для системы контроля качества сворачивания белка в линзе (27). SEP15 также может быть вовлечен в противоопухолевые механизмы (рассмотрено в 28).
Селенопротеин S
Селенопротеин S млекопитающих (известный как SEPS1, SelS или VCP-взаимодействующий мембранный селенопротеин [VIMP]) представляет собой мембранный белок эндоплазматического ретикулума (ER). SEPS1 участвует в клеточном ответе на стресс ER (ER-ассоциированная деградация; ERAD), активируемая обнаружением неправильно свернутых белков. SEPS1 способствует удалению и переносу (ретротранслокации) неправильно свернутых белков из просвета ER в цитозоль, где белки помечаются убиквитином перед деградацией. Было обнаружено, что полиморфизм или вариация в последовательности внутри элемента ER-ответа, расположенного в промоторе SEPS1, приводит к снижению активности промотора SEPS1 и экспрессии генов (29), Полиморфизм, соответствующий замене гуанина (G) аденином (A) на нуклеотид -105 (-105G> A), связан с повышенным уровнем провоспалительных цитокинов в плазме. Кроме того, исследование «случай-контроль» недавно сообщило, что аллель A был более распространен у лиц, пораженных тиреоидитом Hashimoto (HT) - аутоиммунным заболеванием, опосредованным Т-клетками, приводящим к разрушению клеток щитовидной железы, - чем у здоровых контролей (30), Другие ассоциации между SEPS1 полиморфизмом (включая -105G> A) и восприимчивостью к различным условиям, таким как преэклампсия,ИБС или рак желудочно-кишечного тракта настоятельно указывают на роль этого селенопротеина в регуляции воспалительных и иммунных реакций (31-34).
Другие менее хорошо охарактеризованные селенопротеины, которые также локализуются в просвете и / или мембране ER, включают селенопротеины K, M, N и T (35).
Питательные взаимодействия
Антиоксидантные питательные вещества
Важность селена для биологических систем и, в частности, для клеточного окислительно-восстановительного (прооксидантного / антиоксидантного) баланса обусловлена его присутствием в качестве селеноцистеина в каталитическом сайте селенопротеинов (см. Раздел «Функции»). Другие минералы, которые являются критическими компонентами антиоксидантных ферментов, включают медь (как супероксиддисмутаза), цинк (как супероксиддисмутаза) и железо (как каталаза). Селен действует совместно с витаминами-антиоксидантами, витамином С (аскорбиновая кислота) и витамином Е(α-токоферол), регенерируя их из окисленных форм и способствуя максимальной антиоксидантной защите (36-38).
йод
В то время как йод является важным компонентом гормонов щитовидной железы, селенсодержащие йодтиронин-дейодиназы (DIO) являются ферментами, необходимыми для превращения тироксина (T 4) в биологически активный гормон щитовидной железы, трийодтиронин (T 3) (см. Функцию). Активность DIO1 также может участвовать в регуляции гомеостаза йода (39). Селеноферменты, глутатионпероксидазы, также играют критическую роль в функции щитовидной железы, поскольку они катализируют деградацию пероксидов, образующихся при синтезе гормонов щитовидной железы (8)., Эпидемиология сосуществующего дефицита йода и селена в Центральной Африке, но не в Китае, была связана с распространением микседематозного кретинизма, тяжелой формы врожденного гипотиреоза, сопровождающейся умственной и физической отсталостью. Дефицит селена может быть лишь одним из нескольких неопределенных факторов, которые могут усугубить пагубные последствия дефицита йода (40). Интересно отметить, что дефицит селена у грызунов, как было установлено, оказывает незначительное влияние на деятельность DIO, так как выясняется, что селен поставляется в приоритете для адекватного синтеза DIO за счет других селеноферментов (8).
Дефицит
Недостаточное потребление селена может негативно повлиять на активность нескольких чувствительных к селену ферментов, включая глутатионпероксидазы (GPx1 и GPx3), йодтирониндейодиназы, селенопротеин W и метионин-R-сульфоксидредуктазу B1 (MsrB1). Даже при тяжелом изолированном дефиците селена обычно не возникает явного клинического заболевания. Тем не менее, по сравнению с субъектами с адекватным статусом селена, люди с дефицитом селена могут быть более восприимчивы к дополнительным физиологическим стрессам (41). Длительный дефицит селена может способствовать развитию болезней Кешана и Кашин-Бека (см. Ниже).
Болезнь Кешана
Болезнь Кешана является фатальной формой дилатационной кардиомиопатии, которая впервые была описана у молодых женщин и детей в регионе с дефицитом селена в Китае. Острая форма заболевания характеризуются внезапным началом сердечной недостаточности, в то время как хроническая форма приводит к умеренному до тяжелого расширения сердца с разной степенью сердечной недостаточности (43). Заболеваемость болезнью Кешана тесно связана с очень низким потреблением селена в рационе и плохим питательным статусом селена. Было обнаружено, что добавки селена (в форме селенита натрия; Na 2 SeO 3) защищают людей от развития болезни Кешана, но не могут обратить вспять повреждение сердечной мышцы после его возникновения (43), Недавнее исследование «случай-контроль» показало, что активность чувствительной к селену глутатионпероксидазы 1 (GPx1) была значительно ниже у пациентов с кешаном по сравнению со здоровыми людьми. Интересно, что специфический полиморфизм GPX1, приводящий к переходу пролина к лейцину в положении 198 (Pro198Leu), связан со снижением активности GPx1 и, как оказалось, более распространен у пациентов с кешаном. Этот полиморфизм GPX1 может придавать большую восприимчивость к болезни Кешана у носителей с низким питательным статусом селена (44).
В то время как дефицит селена является основным этиологическим фактором болезни Кешана, сезонные и годовые различия в распространенности заболевания позволяют предположить, что помимо дефицита селена могут быть задействованы и другие факторы, особенно инфекционный агент (45). Вирус Коксаки B3 - это один тип вируса, выделенный у пациентов с кешаном, и исследования на животных показали, что этот вирус способен вызывать воспаление сердца (миокардит) у мышей с дефицитом селена. Исследования на мышах также показали, что окислительный стресс, вызванный дефицитом селена, может привести к изменениям в вирусном геноме.например, для превращения относительно безвредного штамма вируса Коксаки В3 в штамм, вызывающий миокардит (43). Хотя это и не доказано при болезни Кешана, возможно, что дефицит селена может увеличить вирулентность вирусов с возможностью проникновения и повреждения сердечной мышцы (46).
Болезнь Кашин-Бека
Болезнь Кашин-Бека (KBD) является еще одним эндемическим заболеванием, которое поражает примерно 2,5 миллиона человек в Тибете, Северном и Центральном Китае, Северной Корее и Юго-Восточной Сибири (47). КБД характеризуется дегенерацией суставного хряща между суставами (остеоартроз), что может привести к деформации суставов и карликовости при наиболее тяжелых формах заболевания. Болезнь поражает детей в возрасте от двух лет. Как и при болезни Кешана, КБД распространен в провинциях с дефицитом селена и, таким образом, обычно поражает людей с очень низким потреблением селена (47). Недавние исследования показали, что повышенная восприимчивость к KBD в популяциях с дефицитом селена может быть результатом сниженияантиоксидантная защита, связанная с полиморфизмами в генах GPX (48, 49). Тем не менее, этиология представляется многофакторной, так как для KBD был предложен ряд других причинных факторов, включая грибковые токсины в зерне, дефицит йода и загрязненную питьевую воду (43).
Недавние метаанализы нескольких небольших исследований и проспективных когортных исследований показали, что улучшение нутритивного статуса селена у детей, живущих в эндемичных районах, может помочь снизить заболеваемость KBD (50). Кроме того, имеется ограниченное количество доказательств того, что добавки селена могут быть полезны при лечении пациентов с КБД. Метаанализ 10 рандомизированных контролируемых исследований показал значительное увеличение скорости восстановления повреждений костей у детей с КБД с добавлением селенита натрия в течение как минимум одного года (51). Большие исследования более высокого качества необходимы для оценки того, может ли добавка селена привести к ремиссии заболевания.
Рекомендуемая диета (RDA)
Референтные рационы питания (DRI) для селена были в последний раз пересмотрены Советом по продовольствию и питанию (FNB) Института медицины США. Самая последняя RDA основана на оценочной средней потребности (EAR), необходимой для максимизации активности антиоксидантного фермента глутатионпероксидазы (GPx) в плазме (52).
| Таблица 1. Рекомендуемая диета для селена
|
| Этап жизни
| Возраст
| Мужчины (мкг / день)
| Женщины (мкг / день)
|
| дети
| 0-6 месяцев
| 15 (AI)
| 15 (AI)
|
| дети
| 7-12 месяцев
| 20 (AI)
| 20 (AI)
|
| Дети
| 1-3 года
| 20
| 20
|
| Дети
| 4-8 лет
| 30
| 30
|
| Дети
| 9-13 лет
| 40
| 40
|
| Подростки
| 14-18 лет
| 55
| 55
|
| Взрослые
| 19 лет и старше
| 55
| 55
|
| беременность
| всех возрастов
| -
| 60
|
| Грудное вскармливание
| всех возрастов
| -
| 70
|
Следует отметить, что третье национальное обследование состояния здоровья и питания (NHANES III) сообщило, что более 99% участников в США имели сывороточную концентрацию селена, соответствующую требованиям селена (52), предполагая, что добавка селена не нужна американцам.
Профилактика болезни
Рак
Исследования на животных
Было проведено значительное исследование влияния добавок селена на заболеваемость раком у животных. Более двух третей из более чем 100 опубликованных исследований на 20 различных животных моделях спонтанного, вирусного и химически индуцированного рака обнаружили, что добавка селена (по крайней мере до адекватного уровня потребления) значительно снижает заболеваемость опухолью, особенно по сравнению с диетами с дефицитом селена (53). Доказательства ингибирующего действия селена на рак дают веские основания для изучения потенциальных связей между потреблением селена и риском развития рака у людей.
Наблюдательные исследования
Большинство ранних эпидемиологических данных из прецедентного контроля и исследований случай-контроль вложенными предложил либо нулевые или обратные связи между воздействием селена и риска на конкретных участках рака (54). Маркеры воздействия селена включают в себя ногти на ногах и содержание селена в крови, а также активность глутатионпероксидазы (GPx) в плазме. Однако неясно, адекватно ли они отражают воздействие селена из пищевых и дополнительных источников (см. Источники).) или распределение селена в тканях и органах, которые могут поражаться раком. В датском проспективном исследовании «Диета, рак и здоровье», в котором приняли участие более 57 000 мужчин и женщин в течение 14 лет, было установлено, что риск развития рака прямой кишки у современных курильщиков на 42% выше, чем у некурящих. Не было выявлено различий между курильщиками и некурящими в отношении дополнительного и диетического потребления антиоксидантных микроэлементов, включая селен, которые вносят вклад в курение и рак прямой кишки (55). Тем не менее, поскольку исследования последовательно сообщают о более низких концентрациях селена в крови и активности GPx у курильщиков по сравнению с некурящими (пересмотрено в 56), оценка потребления селена не может быть надежным маркером воздействия селена в этой популяции. Кроме того, химические формы селена, обнаруженные в пищевых продуктах, различны (см. Источники) и могут оказывать очень разные биологические и токсикологические эффекты (57, 58).
Недавний Кокрановский обзор включал 55 завершенных обсервационных исследований - в основном с вложенным дизайном случай-контроль - опубликованных за три десятилетия (54). Мета-анализ 16 из этих наблюдательных исследований, в том числе более 144 000 лиц, сообщил, что выше по сравнению с более низким статусом селена был связан с 31% более низким риском развития рака в любом месте и 40% более низким риском рака смертности, связанные с. Значительно меньший риск был зарегистрирован для рака мочевого пузыря (5 исследований) и рака простаты (17 исследований); однако более высокий статус селена не был обратно связан с риском развития рака молочной железы (8 исследований), рака легких (12 исследований), колоректального рака (5 исследований) и желудкарак (5 исследований) (54). Другой мета-анализ 16 обсервационных исследований выявил обратную зависимость между раком молочной железы и концентрацией селена в сыворотке (59). В некоторых исследованиях сообщалось о гендерных различиях в восприимчивости к раку, хотя, по-видимому, отсутствуют последовательные данные о различных эффектах у мужчин и женщин.
Одиночные нуклеотидные вариации (полиморфизм) в последовательности генов могут изменять экспрессии генов уровня и стабильность и активность синтезированных белков. Так, например, переход пролин-к-лейцину, вызванный определенным полиморфизмом в GPX1 гене (rs1050450 C> T) связан с пониженной GPx1 ферментативной активностью. Описание нескольких полиморфизмов в генах, кодирующих селенопротеины, привело к оценке возможных ассоциаций с состоянием селена и заболеваемостью раком. Примечательно, что определенные полиморфизмы в генах, кодирующих селенопротеины, были связаны с повышенным риском рака желудка и колоректального рака(рассмотрено в 60). Кроме того, в ряде исследований изучалось влияние полиморфизмов селенопротеинов на взаимосвязь между статусом селена и риском развития рака предстательной железы. Вложенное исследование «случай-контроль» в когорте EPIC-Гейдельберг объединяет генотипирование нескольких вариантов селенопротеина с маркерами статуса селена (61). Вкратце, исследование показало, что полиморфизм гена GPX1 (rs1050450 C> T) влияет на связь между концентрациями селена и риском рака простаты. В частности, было обнаружено, что концентрации селена обратно пропорционально связаны с риском рака простаты только среди носителей GPX1 T аллель. Дополнительные варианты генов селенопротеина могут смягчать влияние статуса селена на риск рака простаты (62, 63). В другом вложенном исследовании «случай-контроль» в рамках исследования «Physicians 'Health Study» (PHS) было выявлено, что у лиц с наивысшей и самой низкой квартилями концентраций селена снижается риск смертности, связанной с раком простаты, за исключением случаев, когда имеется специфический вариант гена селенопротеина 15 кДа. (SEP15 Rs561104 G> A) (64). Необходимы дополнительные исследования для дальнейшего раскрытия механизмов, лежащих в основе влияния взаимодействий генов с диетой на риск развития рака.
Интервенционные испытания
Исследования на уровне сообществ: в Китае было проведено очень раннее исследование с добавками селена среди населения в целом, включающего 130 471 человека, живущих в зоне высокого риска по вирусной инфекции гепатита В и раку печени. Испытание предоставило столовую соль, обогащенную селенитом натрия, населению одного населенного пункта (20 847 человек) с использованием четырех других поселков в качестве контроля. В течение восьмилетнего периода наблюдения средняя заболеваемость раком печени была снижена на 35% в популяции с добавлением селена, в то время как в контрольной популяции не было обнаружено никакого снижения. В клинических испытанияхв том же регионе 226 человек с признаками хронического гепатита В ежедневно дополняли либо 200 мкг селена в форме обогащенной селеном дрожжевой таблетки, либо плацебо- дрожжевой таблетки. В течение 4-летнего периода наблюдения у 7 из 113 человек, принимавших плацебо, развился первичный рак печени, в то время как ни у одного из 113 пациентов, получавших селен, не развился рак печени (65).
Рандомизированные контролируемые исследования: двойное слепое, плацебо- контролируемое исследование по профилактике рака (NPC) у 1312 пожилых людей с раком кожи с немеланомой в анамнезе показало, что добавление 200 мкг / день обогащенных селеном дрожжей (селенизированных дрожжей) для в среднем 7,4 года привели к снижению заболеваемости раком простаты у мужчин на 52% (обзор в 66). Защитный эффект добавок селена был наибольшим у мужчин с более низким базовым уровнем селена в плазме крови и уровнями простат-специфического антигена (ПСА). Снижение заболеваемости раком легких, колоректальным и общим раком также было связано с добавкой 200 мкг / день (67).но не с 400 мкг / день обогащенных селеном дрожжей (68). Кроме того, добавки селена увеличили риск одного типа рака кожи (плоскоклеточный рак) на 25%. Более крупное рандомизированное плацебо-контролируемое вмешательство (исследование SELECT) более чем 35 000 мужчин среднего возраста и селеновых, рандомизированных для получения селена (в виде селенометионина, 200 мкг / день) и / или витамина Е, был остановлен из-за опасений относительно повышенного риска диабета 2 типа с селеном и повышенного риска рака простаты с витамином Е (69, 70), Кроме того, добавление селена, отдельно или вместе с витамином Е, не показало каких-либо преимуществ в отношении риска рака простаты, легких или колоректального рака после 5,5 лет наблюдения (71, 72). Результаты других небольших исследований (обзор 66) также указывают на отсутствие эффекта или возможность повышенного риска развития рака. Отсутствие положительного эффекта селена была поддержана в недавнем мета-анализе из рандомизированных контролируемых исследований (54).
Лечение болезней
Иммунная дисфункция
Дефицит селена был связан с нарушением иммунитета и хроническим воспалением (81). Значительный объем исследований, проведенных на клеточных культурах и на животных моделях, показывает, что селен играет важную роль в регулировании миграции, пролиферации, дифференцировки, активации и оптимальной функции иммунных клеток, влияя, таким образом, на врожденный иммунитет, выработку В-клеточно-зависимых антител и Т клеточный иммунитет (пересмотрено в 82). Последние данные о роли селена и селенопротеинов в производстве липидных медиаторов (так называемых эйкозаноидов)) участие в воспалительных реакциях позволяет предположить, что добавки селена могут смягчать дисфункциональные воспалительные реакции, которые способствуют патогенезу многих хронических заболеваний (83). В настоящее время необходимы рандомизированные контролируемые исследования для оценки потенциальной пользы добавки селена при воспалительных заболеваниях, таких как астма (84) и воспалительные заболевания кишечника (85).
Инфекционные заболевания
ВИЧ / СПИД
В районах широко распространенного недоедания дефицит питательных микроэлементов (включая селен) часто встречается у людей, инфицированных вирусом иммунодефицита человека (ВИЧ), который вызывает синдром приобретенного иммунодефицита (СПИД). До того, как антиретровирусная терапия (АРТ) стала стандартом для лечения ВИЧ, обсервационные исследования постоянно сообщали о связи между низкими концентрациями селена в сыворотке и ВИЧ-инфекцией у хорошо питающихся людей (86). Плохой статус селена был связан с повышенным риском дилатационной кардиомиопатиии смертность среди ВИЧ-инфицированных детей и взрослых, а также передача ВИЧ от матери ребенку и перинатальная смертность (обзор 87). Ранние лабораторные исследования показали, что ВИЧ может нарушать нормальную антиоксидантную защиту в инфицированных Т-клетках, снижая уровни селенопротеины, т. е. тиоредоксинредуктазы и глутатионпероксидазы (87). Интересно, что недавнее перекрестное исследование показало, что у ВИЧ-серопозитивных людей, получающих АРТ в течение более двух лет, были неопределяемые вирусные нагрузки в плазме, более высокое количество CD4- лимфоцитов и адекватные концентрации селена в сыворотке по сравнению с субъектами, не получающими АРТ (88), Поскольку антиоксидантная активность селенопротеинов может мешать репликации вируса в ВИЧ-инфицированных иммунных клетках (89,90), было высказано предположение, что добавка селена может служить потенциальным дополнением к АРТ для пациентов с ВИЧ.
Было проведено несколько испытаний добавок селена у ВИЧ-инфицированных. Рандомизированное, двойное слепое, плацебо контролируемая проба в 186 ВИЧ-инфицированных взрослых изначально было установлено, что добавки селена при 200 мкг / день в течение двух лет значительно снизилась скорость госпитализации (91). Другое рандомизированное, двойное слепое, плацебо-контролируемое исследование с участием 174 ВИЧ-инфицированных пациентов показало, что прием 200 мг / день селена (в форме обогащенных селеном дрожжей) в течение девяти месяцев увеличивал концентрацию селена в сыворотке, улучшал Т-клетки лимфоцита CD4. рассчитывать и предотвращать любое прогрессирование вирусной нагрузки ВИЧ (92), В третьем двойном слепом исследовании в Танзании 913 беременных женщин в возрасте от 12 до 27 недель были рандомизированы для получения 200 мкг / день селена (в виде селенометионина) или плацебо в течение шести месяцев после рождения. Добавки селена не влияли на количество CD4, CD8 и CD3 Т-клеток у матери и вирусную нагрузку ВИЧ, но значительно снижали риск острой или постоянной диареи (93, 94). Кроме того, риск смерти от шести недель до шести месяцев после родов был значительно снижен у младенцев матерей с добавлением селена по сравнению с плацебо (94).
Недавнее четырехрукое исследование в Ботсване рандомизировало 878 ВИЧ-инфицированных взрослых на ранней стадии инфекции, чтобы получить либо плацебо, поливитамины (витамины В, С и Е), 200 мкг / день селена, либо оба поливитамины и селен за 24 месяца (95), В отличие от одного селена, добавление поливитаминов (с или без селена) снижало риск снижения иммунитета за счет значительного увеличения времени, в течение которого становилась необходимой инициация АРТ (то есть, когда количество CD4 Т-клеток падало ниже 251 клеток / мкл) по сравнени










