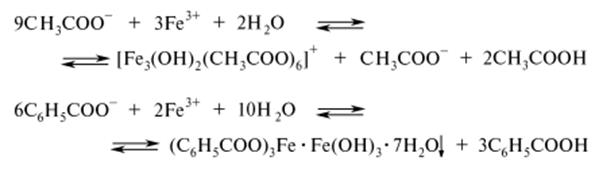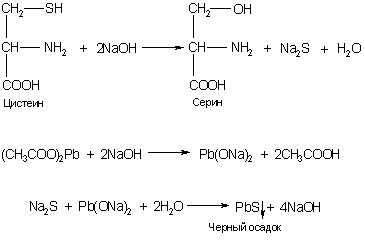Несколько капель или кристалликов кислоты смешать с 1-2 мл воды в пробирке. К каждому из полученных растворов добавить по 1 мл раствора серной кислоты и несколько капель раствора перманганата калия. Отметить происходящие изменения.
Вопросы для самостоятельной работы
- Основные способы получения насыщенных монокарбоновых кислот (названия способов, уравнения реакций, названия продуктов, условия).
- Основные способы получения ненасыщенных монокарбоновых кислот (названия способов, уравнения реакций, названия продуктов, условия).
- Основные способы получения ароматических монокарбоновых кислот (названия способов, уравнения реакций, названия продуктов, условия).
- Основные способы получения насыщенных дикарбоновых кислот (названия способов, уравнения реакций, названия продуктов, условия).
- Идентификация дикарбоновых кислот.
Лабораторная работа №11
Тема: Качественная реакция на ацетат- и бензоат-ионы с феррум (III) хлоридом
Цель: провести качественные реакции на обнаружение карбоновых кислот, составить уравнения реакций, сделать выводы, ознакомиться с основными представителями карбоновых кислот, применяемых в медицине.
Реактивы и оборудование: кристаллические натриевые соли уксусной и бензойной кислот, 1%-ный раствор железа (III) хлорида, вода, пробирки, пипетки.
Ход работы
В двух пробирках отдельно в 5 каплях воды растворяют по несколько кристаллов натриевых солей уксусной и бензойной кислот. При последующем добавлении 2 капель 1%-ного раствора железа (III) хлорида в пробирке с натрия ацетатом наблюдают появление _____________ окрашивания раствора, а в пробирке с натрия бензоатом выделяется _____________ ______________:
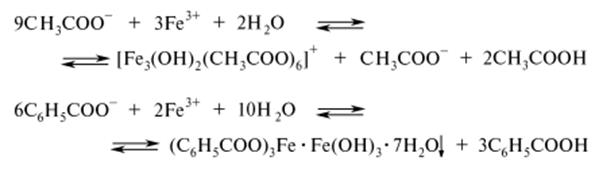
Вопросы для самостоятельной работы
- Что такое плексиглас? Как его получают в лаборатории?
- Опишите, какие из карбоновых кислот входят в состав препарата «Линетол», применяемый для лечения гипертонии и атеросклерозов.
- Как лабораторный индикатор фенолфталеин используется в медицине?
- Отдельные представители насыщенных монокарбоновых кислот и их применение.
- Отдельные представители ненасыщенных монокарбоновых кислот и их применение.
- Отдельные представители ароматических монокарбоновых кислот и их применение. Методы идентификации.
- Отдельные представители насыщенных дикарбоновых кислот и их применение.
Лабораторная работа №12
Тема: Доказательство строения винной кислоты
Цель: изучить реакции получения калиевых солей винной кислоты (гидротартрат, тартрат), провести качественные реакции, доказывающие строение винной кислоты, сделать выводы
Реактивы и оборудование: винная кислота (15%-ный раствор), гидроксид калия (3%-ный раствор), гидроксид натрия (10%-ный раствор), сульфат меди (2%-ный раствор),.
Ход работы
А. В пробирку помещают 2 капли 15 %-наго раствора винной кислоты и 4 капли 3%-ного раствора калия гидроксида. Наблюдают постепенное выделение белого кристаллического осадка кислой калиевой соли винной кислоты. Данную реакцию используют в аналитической практике для обнаружения ионов калия:
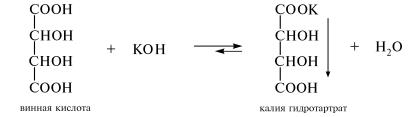
При последующем добавлении в пробирку 5-10 капель 3 %-ного раствора калия гидроксида осадок растворяется, образуя водорастворимую среднюю калиевую соль винной кислоты.
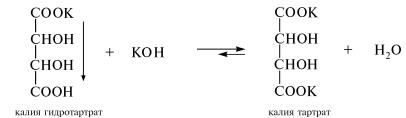
Раствор соли сохраняют для проведения опыта Б.
Б. В пробирку помещают по 4 капли 2 %-ного раствора меди сульфата и 10 %-ного раствора натрия гидроксида. Наблюдают образование синего осадка меди (II) гидроксида, который при последующем добавлении раствора калия тартрата растворяется, образуя хелатный медно-виннокислый комплекс:
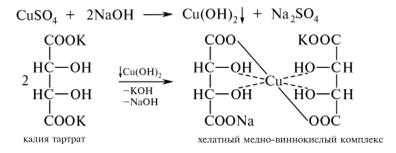
Лабораторная работа №13
Тема: Качественные реакции на кетозы (реакция Селиванова)
Цель: провести качественные реакции на кетозы, научиться распознавать глюкозу и фруктозу.
Реактивы и оборудование: реактив Селиванова (свежеприготовленный), глюкоза, фруктоза (растворы), пробирки, пипетки, водяная баня, сухое горючее.
Ход работы
В две отдельные пробирки помещают по 2 мл свежеприготовленного реактива Селиванова (0,01 г резорцина в смеси 10 мл воды и 10 мл концентрированной хлороводородной кислоты). В одну из пробирок вносят 0,5 мл раствора глюкозы, в другую - 0,5 мл раствора фруктозы. Пробирки погружают на 2 мин в кипящую водяную баню.
В пробирке с фруктозой в отличие от глюкозы наблюдают быстрое появление красного окрашивания раствора. При последующем нагревании пробирок в пламени горелки до кипения окрашенный раствор мутнеет и выделяется осадок.
В ходе реакции при нагревании гексоз с хлороводородной кислотой образуется 5-гидроксиметилфурфурол, который конденсируется с резорцином с образованием окрашенного продукта состава С12Н1004:
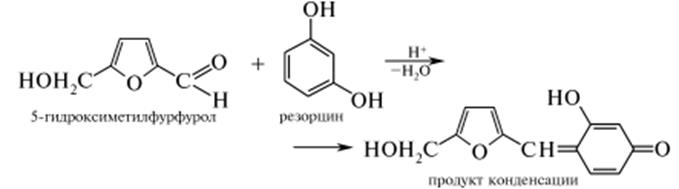
Кетозы в условиях опыта превращаются в 5-гидроксиметилфурфурол в 15-20 раз быстрее, чем альдозы, что и обусловливает быстроту появления окраски и ее интенсивность в растворах фруктозы и сахарозы. Альдогексозы в этих условиях лишь при длительном кипячении приобретают слабо-розовую окраску.
Реакция Селиванова позволяет обнаружить в смеси сахаров кетогексозы как в свободном, так и в связанном состоянии (дисахариды).
Лабораторная работа №14
Тема: Качественная реакция на крахмал и его гидролиз
Цель: провести качественную реакцию на крахмал, изучиь реакцию гидролиза крахмала.
Реактивы и оборудование: 0,5%-ный раствор крахмального клейстера, раствор йода в калия йодиде, 10 %-ный раствор серной кислоты пробирки, 10 %-ный раствор натрия гидроксида, 2 %-ный раствор меди (II) сульфата, пипетки, водяная баня.
Ход работы
Опыт №1 Качественная реакция на крахмал
В пробирку помещают 5 капель 0,5%-ного раствора крахмального клейстера и 1 каплю раствора йода в калия йодиде. Наблюдают появление интенсивно-синей окраски раствора.
Предполагается, что крахмал с йодом образует соединения включения (клатраты), окрашенные в характерные цвета - синий для амилозы и красный для амилопектина. Молекулы амилозы в этих комплексах образуют вокруг молекулы йода спираль, каждый виток которой содержит 6 остатков глюкозы. При нагревании окрашенного раствора крахмала с йодом окраска исчезает, а при охлаждении появляется вновь, что связано, по-видимому, с раскручиванием спирали амилозы.
Опыт №2 Кислотный гидролиз крахмала
В пробирку помещают 1 мл 0,5 %-наго раствора крахмального клейстера, 10 капель 10 %-ного раствора серной кислоты и нагревают на водяной бане в течение 20 мин. Раствор становится прозрачным.
Каплю раствора наносят на предметное стекло и смешивают с 1 каплей раствора йода в калия йодиде. Отсутствие интенсивносинего окрашивания свидетельствует о полном гидролизе крахмала:
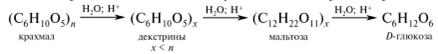
Наличие глюкозы, образовавшейся в результате гидролиза крахмала, доказывают реакцией восстановления Cu2+. Для этого в пробирку добавляют 8 капель 10 %-ного раствора натрия гидроксида и 1 каплю 2 %-ного раствора меди (II) сульфата.
Наблюдают образование прозрачного раствора комплексной соли меди (II) с глюкозой синего цвета.
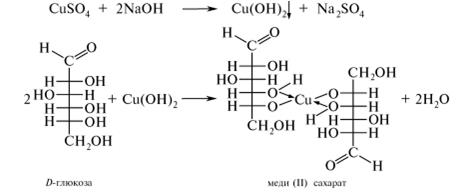
Если содержимое пробирки осторожно нагреть, образуется красно-коричневый осадок меди (I) оксида.

Лабораторная работа №15
Тема: Цветные реакции на белки
Цель: определить с помощью цветных реакций, протекание которых обусловлено наличием в
белке специфических групп и пептидных связей. присутствие белков в биологических объектах или растворах.
Реактивы: водный раствор яичного белка (белок одного куриного яйца отделяют от желтка, растворяют в 15–20-кратном объеме дистиллированной воды, затем раствор фильтруют через марлю, сложенную в 3–4 слоя, и хранят в холодильнике;10 %-й раствор гидроксида натрия; 30 %-й раствор гидроксида натрия; 1 %-ный раствор сульфата меди; 1 %-й раствор ацетата свинца; концентрированная азотная кислота; 0,5 %-й раствор нингидрина.
Оборудование: пробирки; водяная баня или спиртовка.
Задание 1. Биуретовая реакция.
В щелочной среде белки, а также продукты их гидролиза – пептиды дают фиолетовое или красно- фиолетовое окрашивание с солями меди. Реакция обязана наличию пептидных связей в белках:
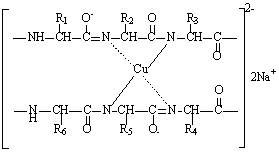
Интенсивность окраски зависит от длины полипептида.
Ход работы
1. В пробирку налейте 5 капель раствора яичного белка, затем 10 капель 10 %-го раствора щелочи.
2. Добавьте 1–2 капли раствора сульфата меди, смесь перемешайте. Появляется красно-фиолетовое окрашивание.
Задание 2. Ксантопротеиновая реакция.
Реакция характерна для некоторых ароматических аминокислот (фенилаланина, тирозина, триптофана), а также для пептидов, их содержащих. При действии азотной кислоты образуется нитросоединение желтого цвета. Далее нитропроизводные могут реагировать со щелочью с образованием натриевой соли, имеющей желто-оранжевое окрашивание:
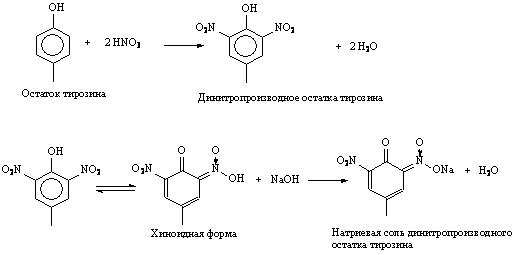
Ход работы
Данную работу необходимо выполнять в вытяжном шкафу, соблюдая особую осторожность!
1. В пробирку налейте 5 капель раствора яичного белка и ОСТОРОЖНО по стенке прибавьте 3–4 капли концентрированной азотной кислоты.
2. Смесь осторожно нагрейте. Выпадает осадок, который окрашивается в желтый цвет.
3. После охлаждения в пробирку ОСТОРОЖНО по стенке прилейте 10 капель 30 %-го раствора NaOH, желтая окраска переходит в оранжевую.
Задание 3. Реакция на серосодержащие аминокислоты (реакция Фоля).
В остатках серосодержащих аминокислот цистеина и цистина сера при щелочном гидролизе отщепляется, образуя сульфиды. Сульфиды, взаимодействуя с ацетатом свинца, образуют осадок сульфида свинца черного или буро-черного цвета.
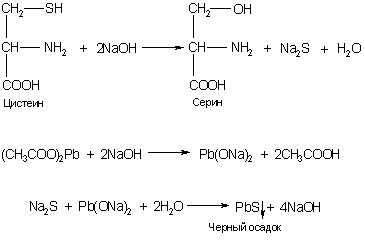
Ход работы
1. В пробирке смешайте 5 капель раствора яичного белка, 5 капель 30 %-го раствора щелочи и 2 капли раствора ацетата свинца.
2. Смесь осторожно нагрейте на спиртовке до кипения и кипятите. Через некоторое время появляется буровато-черное или черное окрашивание.
Задание 4. Нингидриновая реакция.
Реакция характерна для аминогрупп в α-положении и обусловлена наличием α-аминокислот в молекуле белка. При нагревании белка с водным раствором нингидрина аминокислоты окисляются и распадаются, образуя двуокись углерода, аммиак и соответствующий альдегид. Восстановленный нингидрин конденсируется с аммиаком и окисленной молекулой нингидрина, образуя соединение фиолетово-синего цвета:
Ход работы
В пробирку вносят 5 капель 1 %–го раствора яичного белка, добавляют по 3 капли 0,5 %-го раствора нингидрина и нагревают до кипения. Через 2–3 минуты появляется розовое, красное, а затем сине-фиолетовое окрашивание.
Контрольные вопросы
1. Назовите универсальные реакции на белки.
2. Укажите специфические реакции на аминокислоты.
3. Какие аминокислоты называются незаменимыми? Каково их строение?
4. Что такое аминокислотный скор?
5. По каким принципам классифицируются аминокислоты?
Лабораторная работа №16
Тема: Качественные реакции на анальгин
Цель: провести качественные реакции на анальгин, научиться распознавать анальгин среди других препаратов группы пиразолона-5.
Реактивы и оборудование: анальгин (сухой препарат), 1 %- ный раствора железа (III) хлорида, 10 %-ный раствор хлороводородной кислоты, пробирки, пипетки, водяная баня.
Ход работы
А. В пробирке в 4 каплях воды растворяют несколько кристаллов анальгина и добавляют 1 каплю 1 %- ного раствора железа (III) хлорида. Наблюдают появление темно-синего окрашивания, переходящего в темно-зеленое, а затем в желтое.
Б. В пробирку помещают несколько кристаллов анальгина, 5 капель воды и 4 капли 10 %-ного раствора хлороводородной кислоты. Содержимое пробирки нагревают в течение 2 мин на водяной бане. Ощущают резкий запах серы (IV) оксида и формальдегида:
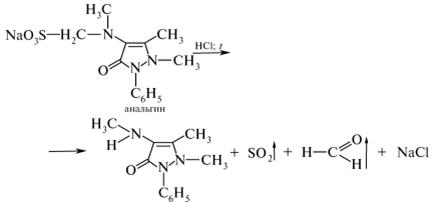
Затем в пробирку к охлажденному раствору добавляют 2 капли 1 %-ного раствора железа (III) хлорида. Наблюдают постепенное появление желто- красного окрашивания. Данная реакция позволяет отличить анальгин от других препаратов группы пиразолона-5.
СПИСОК ЛИТЕРАТУРЫ
Основные источники:
1.Зурабян, С.Э.,Лузин,А.П. Органическая химия: учебник/Под редакцией Н.А.
Тюкавкиной. - М.:ГЭОТАР – Медиа, 2011.-384 с.: ил.
2.Габриелян О.С., Остроумова И.Г. Химия: учебник для студентов СПО. – 9-е
изд.,стер.-М.:ИЦ.Академия, 2011.-336 с.; [16 л.] цв. ил.
Дополнительные источники:
1.Габриелян О.С.,Лысова, Г.Г. Химия: учебник.11 класс.-М.:Дрофа, 2011.-398 с.: ил.
2.Ерохин,Ю.М. Химия.- М.: Издательство центр Академия, 2009.-318 с.: ил.
3.Ф.Л. Вайзман. Основы органической химии.- СПб: Химия, 2009.- 159 с.: ил.
4. Захарова, Т.Н., Головлева,Н.А. Органическая химия: учебник для ССУзов,
«Академия», 2012.-375 с.: ил.
Интернет-сайты:
- www.prepodu.net
- www.for-stydents.ru
- www.chem-astu.ru
- dic.academic.ru
- Chemistry.do.am.