

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
Топ:
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Оценка эффективности инструментов коммуникационной политики: Внешние коммуникации - обмен информацией между организацией и её внешней средой...
Комплексной системы оценки состояния охраны труда на производственном объекте (КСОТ-П): Цели и задачи Комплексной системы оценки состояния охраны труда и определению факторов рисков по охране труда...
Интересное:
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Задание 1:
Рассчитать объем окислительной среды, м3, необходимый для горения i-того горючего вещества (таблица 1.2.).
Таблица 1.2.
| №№ Ва- ри-анта | Горючее вещество | Химичес- кая формула | Количес- тво горючего вещества | Состав окислительной среды | Условия горения |
| 1 | Метиловый спирт | СН4О | 2кг | воздух | Т=1013ГПа
Р=300К
 =3 =3
|
| 2 | Анилин | С6Н7N | 1 кг | Кислород70% Азот30% | Т=290
Р=900
 =2,5 =2,5
|
| 3 | Смесь газов | СО-45% N2-15% C4H8-10% O2-30% | 1м3 | Воздух | Нормальные
 =2,5 =2,5
|
| 4 | Нитробензол | С6Н5NO2 | 30кг | Воздух | Т=280
Р=950
 =2,5 =2,5
|
| 5 | Сложное вещество | С=65% О=20% Н=5% S=10% | 1 кг | Воздух |  =1,4
Нормальные =1,4
Нормальные
|
| 6 | Этилен | С 2Н4 | 5 м3 | Кислород % Азот% | Нормальные
 =2,5 =2,5
|
| 7 | Сера | S | 2 кг | Кислород % Азот% | Т=300
Р=1200
 =1,8 =1,8
|
| 8 | Сложное вещество | С -90% Н-3% N-5% O-2% | 1 кг | Воздух | Т=300
Р=950
 =1,5 =1,5
|
| 9 | Смесь газов | СН4-15% С3Н8-70% О2-10% Н2-5% | 5 м3 | Воздух | Нормальные
 =1,9 =1,9
|
| 10 | Алюминий | Аl | 15 кг | Кислород42 % Азот58% | Нормальные
 =2,8 =2,8
|
| 11 | Сплав | Мg-20% Al-80% | 1 кг | Воздух | Т=265
Р=920
 =1,5 =1,5
|
| 12 | Муравьиная кислота | СН2О2 | 1 кг | Воздух | Нормальные
 =1,2 =1,2
|
| 13 | Диметиловый эфир | (СН3)2О | 10 кг | Воздух | Т=283
Р=1016
 =4,2 =4,2
|
| 14 | Смесь газов | Н2S-25% SO2-15% CO2-15% H2-30% O2-15% | 15 м3 | Воздух | Нормальные
 =1,4 =1,4
|
| 15 | Сложное вещество | С-82% Н-8% W-10% | 1 кг | Воздух | Т=260
Р=1100
 =1,4 =1,4
|
| 16 | Глицерин | С3Н8О3 | 1 кг | Воздух | Т=305
Р=1013
 =1,9 =1,9
|
| 17 | Ацетилен | С2Н2 | 1 м3 | Хлор 18 % Азот82% | Нормальные
 =1,9 =1,9
|
| 18 | Смесь газов | СН4-30% O2-8% N2-15% Н2-47% | 1 м3 | Воздух | Нормальные
 =3,2 =3,2
|
| 19 | Этиловый эфир уксусной к-ты | С4Н8О2 | 1 кг | Воздух | Т=270
Р=850
 =1,5 =1,5
|
| 20 | Метилэтил- кетон | С4Н8О | 5 кг | Воздух | Нормальные
 =2,5 =2,5
|
| 21 | Хлорбензол | С6Н5Cl | 1 кг | Воздух | Т=305
Р=1000
 =2,8 =2,8
|
| 22 | Нитротолуол | С7Н7NO2 | 1 кг | Кислород25 % Азот75% | Т=280
Р=980
 =1,4 =1,4
|
| 23 | Метиловый спирт | СН4О | 2кг | воздух | Т=1013ГПа
Р=300К
 =3 =3
|
| 24 | Анилин | С6Н7N | 1 кг | Кислород70% Азот30% | Т=290
Р=900
 =2,5 =2,5
|
| 25 | Смесь газов | СО-45% N2-15% C4H8-10% O2-30% | 1м3 | Воздух | Нормальные
 =2,5 =2,5
|
| 26 | Нитробензол | С6Н5NO2 | 30кг | Воздух | Т=280
Р=950
 =2,5 =2,5
|
| 27 | Сложное вещество | С=65% О=20% Н=5% S=10% | 1 кг | Воздух |  =1,4
Нормальные =1,4
Нормальные
|
| 28 | Этилен | С 2Н4 | 5 м3 | Кислород % Азот% | Нормальные
 =2,5 =2,5
|
| 29 | Сера | S | 2 кг | Кислород % Азот% | Т=300
Р=1200
 =1,8 =1,8
|
| 30 | Сложное вещество | С -90% Н-3% N-5% O-2% | 1 кг | Воздух | Т=300
Р=950
 =1,5 =1,5
|
| 31 | Смесь газов | СН4-15% С3Н8-70% О2-10% Н2-5% | 5 м3 | Воздух | Нормальные
 =1,9 =1,9
|
| 32 | Алюминий | Аl | 15 кг | Кислород42 % Азот58% | Нормальные
 =2,8 =2,8
|
| 33 | Сплав | Мg-20% Al-80% | 1 кг | Воздух | Т=265
Р=920
 =1,5 =1,5
|
| 34 | Муравьиная кислота | СН2О2 | 1 кг | Воздух | Нормальные
 =1,2 =1,2
|
| 35 | Диметиловый эфир | (СН3)2О | 10 кг | Воздух | Т=283
Р=1016
 =4,2 =4,2
|
| 36 | Смесь газов | Н2S-25% SO2-15% CO2-15% H2-30% O2-15% | 15 м3 | Воздух | Нормальные
 =1,4 =1,4
|
| 37 | Сложное вещество | С-82% Н-8% W-10% | 1 кг | Воздух | Т=260
Р=1100
 =1,4 =1,4
|
| 38 | Глицерин | С3Н8О3 | 1 кг | Воздух | Т=305
Р=1013
 =1,9 =1,9
|
| 39 | Ацетилен | С2Н2 | 1 м3 | Хлор 18 % Азот82% | Нормальные
 =1,9 =1,9
|
| 40 | Смесь газов | СН4-30% O2-8% N2-15% Н2-47% | 1 м3 | Воздух | Нормальные
 =3,2 =3,2
|
| 41 | Этиловый эфир уксусной к-ты | С4Н8О2 | 1 кг | Воздух | Т=270
Р=850
 =1,5 =1,5
|
| 42 | Метилэтил- кетон | С4Н8О | 5 кг | Воздух | Нормальные
 =2,5 =2,5
|
| 43 | Хлорбензол | С6Н5Cl | 1 кг | Воздух | Т=305
Р=1000
 =2,8 =2,8
|
| 44 | Нитротолуол | С7Н7NO2 | 1 кг | Кислород25 % Азот75% | Т=280
Р=980
 =1,4 =1,4
|
Задание 2:
|
|
Сколько воздуха требуется подать на сжигание n -го объема (м3) генераторного газа при нормальных условиях.
Таблица 1.3
| № Вар- та | n-й объем генераторного газа | Коэффи- циент избытка воздуха | СО% | Н2-% | N% | O2% | CH4% | СО2% |
| 1 | 200 | 2,5 | 29 | 14 | 45 | 2,5 | 3 | 6.5 |
| 2 | 500 | 3,2 | 14 | 29 | 45 | 3 | 2,5 | 6,5 |
| 3 | 450 | 1,8 | 10 | 30 | 50 | 2 | 2 | 6 |
| 4 | 368 | 1,7 | 25 | 35 | 20 | 5 | 5 | 10 |
| 5 | 400 | 1,9 | 20 | 45 | 25 | 5 | 2 | 3 |
| 6 | 800 | 1,5 | 12,5 | 35 | 12,5 | 12 | 8 | 10 |
| 7 | 1000 | 2,3 | 10 | 30 | 50 | 2 | 2 | 6 |
| 8 | 900 | 2,5 | 15 | 28 | 45 | 3 | 2,5 | 6,5 |
| 91 | 890 | 2.6 | 27 | 16 | 45 | 2,5 | 3 | 6.5 |
| 10 | 530 | 3.0 | 12,5 | 34,5 | 12,5 | 13 | 8 | 10 |
| 11 | 456 | 3,1 | 29 | 14 | 43 | 2,5 | 5 | 6.5 |
| 12 | 450 | 3,3 | 14 | 29 | 45 | 3 | 2,5 | 6,7 |
| 13 | 470 | 3,5 | 27 | 14 | 47 | 2,5 | 3 | 6.5 |
| 14 | 760 | 2,4 | 29 | 14 | 45 | 2,5 | 3 | 6.5 |
| 15 | 267 | 5,0 | 29 | 14,5 | 44 | 2,5 | 3,5 | 6.5 |
| 16 | 400 | 2,0 | 10,5 | 32,5 | 50 | 2 | 2 | 6 |
| 17 | 580 | 2,1 | 25 | 35 | 20 | 5 | 5 | 10 |
| 18 | 230 | 2.2 | 28 | 47 | 24,5 | 5,5 | 2,5 | 2,5 |
| 19 | 150 | 2.3 | 25 | 16 | 47 | 2,5 | 3 | 6.5 |
| 20 | 180 | 2.4 | 29 | 46 | 24,5 | 5,5 | 2 | 3 |
| 21 | 280 | 2,3 | 20 | 14 | 70 | 4,5 | 3,7 | 6.8 |
| 22 | 270 | 1,9 | 20 | 45 | 25 | 5 | 2 | 3 |
| 23 | 200 | 2,5 | 29 | 14 | 45 | 2,5 | 3 | 6.5 |
| 24 | 500 | 3,2 | 14 | 29 | 45 | 3 | 2,5 | 6,5 |
| 25 | 450 | 1,8 | 10 | 30 | 50 | 2 | 2 | 6 |
| 26 | 368 | 1,7 | 25 | 35 | 20 | 5 | 5 | 10 |
| 27 | 400 | 1,9 | 20 | 45 | 25 | 5 | 2 | 3 |
| 28 | 800 | 1,5 | 12,5 | 35 | 12,5 | 12 | 8 | 10 |
| 29 | 1000 | 2,3 | 10 | 30 | 50 | 2 | 2 | 6 |
| 30 | 900 | 2,5 | 15 | 28 | 45 | 3 | 2,5 | 6,5 |
| 31 | 890 | 2.6 | 27 | 16 | 45 | 2,5 | 3 | 6.5 |
| 32 | 530 | 3.0 | 12,5 | 34,5 | 12,5 | 13 | 8 | 10 |
| 33 | 456 | 3,1 | 29 | 14 | 43 | 2,5 | 5 | 6.5 |
| 34 | 450 | 3,3 | 14 | 29 | 45 | 3 | 2,5 | 6,7 |
| 35 | 470 | 3,5 | 27 | 14 | 47 | 2,5 | 3 | 6.5 |
| 36 | 760 | 2,4 | 29 | 14 | 45 | 2,5 | 3 | 6.5 |
| 37 | 267 | 5,0 | 29 | 14,5 | 44 | 2,5 | 3,5 | 6.5 |
| 38 | 400 | 2,0 | 10,5 | 32,5 | 50 | 2 | 2 | 6 |
| 39 | 580 | 2,1 | 25 | 35 | 20 | 5 | 5 | 10 |
| 40 | 230 | 2.2 | 28 | 47 | 24,5 | 5,5 | 2,5 | 2,5 |
| 41 | 150 | 2.3 | 25 | 16 | 47 | 2,5 | 3 | 6.5 |
| 42 | 180 | 2.4 | 29 | 46 | 24,5 | 5,5 | 2 | 3 |
| 43 | 280 | 2,3 | 20 | 14 | 70 | 4,5 | 3,7 | 6.8 |
| 44 | 270 | 1,9 | 20 | 45 | 25 | 5 | 2 | 3 |
|
|
Практическая работа№2
Тема: «Расчет объема и состава продуктов горения»
Цель работы: изучить состав продуктов горения, методы и приборы для их изучения; научиться делать расчеты ТПВ для ряда химических веществ.
Существует несколько полуэмпирических методов расчета ТПВ, однако они мало отличаются друг от друга по точности.
Температурные пределы воспламенения жидкостей рассчитывают по температуре кипения:
t H ( B ) = Kt кип - 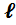 , (4.1.)
, (4.1.)
где tH ( B ) -нижний (верхний) температурный предел воспламенения оС;
t кип – температура кипения оС;
К и  - константы для определения групп (гомологических рядов) жидкостей. Их значения приведены в табл.6 приложения
- константы для определения групп (гомологических рядов) жидкостей. Их значения приведены в табл.6 приложения
Температурные пределы воспламенения могут быть определены по известным значениям концентрационных пределов:
Р (НВ)=  , (4.2.)
, (4.2.)
где Р (НВ) -давление насыщенного пара, соответствующее нижнему(верхнему) концентрационному пределу воспламенения;
 – нижний (верхний) концентрационный предел воспламенения;
– нижний (верхний) концентрационный предел воспламенения;
 Р0- атмосферное давление.
Р0- атмосферное давление.
По таблице 7 приложения определяем температуру вещества, при которой достигается данное давление. Она будет являться соответственно нижним (верхним) пределом воспламенения.
Примеры решения задач
Пример №1
Определить температурные пределы воспламенения (ТПВ)метилового спирта, если температура его кипения равна 65о.
Решение: Расчет производим по формуле (4.1), значение констант определяем по табл.6 для нормальных жирных спиртов:
|
|
tH=0,5746*65-33,7=3,6оС=276,6 К;
tB =0,6928*15,0=30 оС=303К.
Определим относительную ошибку расчета. По табл.5 приложения находим что ТПВ метилового спирта равны 280 +312 К:
∆Н= 
∆в= 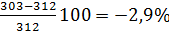
Следовательно, результаты расчета занижены менее чем на 3%
Пример № 2 Определить температурные пределы воспламенения (ТПВ) ацетона, если его концентрационные пределы в воздухе равны 2,2 +13%. Атмосферное давление- нормальное.
Решение: По формуле (4.2) определим давление насыщенного пара ацетона, соответствующее нижнему и верхнему пределам воспламенения:
РH= 
РВ= 
Из таблицы 7 приложения следует, что нижние температурные пределы вещества (НТПВ) находятся между температурами 241,9 и 252.2К. а верхние температурные пределы вещества (ВТПВ)- между 271,0 и 280,7К.
Линейной интерполяцией определим ТПВ:
Тн=241,9+ 
ТВ=  К
К
Зная справочные значения ТПВ ацетона (253+279К.см. приложение5), можно определить относительную ошибку расчета:
∆Н= 
∆В= 
Контрольные задачи
1. Определить температурные пределы воспламенения в гомологическом ряду жирных углеводородов:
| вариант | 1 | 2 | 3 | 4 |
| углеводород | Бутан | Гексан | Октан | Пентан |
| Т кипения (К) | 273.6 | 309.0 | 398.7 | 304.7 |
2. Построить график изменения ТПВ от положения горючего в гомологическом ряду.
3. Сравнить температурные пределы воспламенения Н- бутиловых эфиров муравьиной и уксусной кислот. На основании полученных данных сделать вывод о их сравнительной пожарной опасности. Температура кипения бутилформиата равна 379.8К, а бутилацетата-399К.
4. Определить температурные пределы воспламенения бутилбензола по его концентрационным пределам. Значение последних рассчитать по аппроксимационной формуле.
5. По концентрационным пределам воспламенения, значение которых установить по аппроксимационной формуле, определить температурные пределы воспламенения ацетона и метилэтилкетона. По результатам расчета сделать вывод о сравнительной пожарной опасности этих веществ.
|
|
|

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!