Промышленные блуждающие токи создаются линиями электротранспорта, заземлителями постоянного тока, системами катодной защиты и другими электрическими установками. Они могут быть очень значительными по величине и наносить серьезный ущерб металлическим сооружениям, находящимся в зоне их действия. Типичные случаи электрокоррозии металлических сооружений под действием блуждающих токов показаны на рис. 1, 2.
Интенсивность коррозии объектов в поле блуждающих токов определяется напряженностью поля, удельным сопротивлением среды, состоянием изоляционного покрытия объекта, взаимным расположением объекта и источника тока.
Причины периодичности свойств элементов.
Периодическое изменение свойств элементов в периоде объясняется последовательностью заполнения электронами уровней и подуровней в атомах при увеличении порядкового номера элемента и заряда ядра атома.
Так как электронные конфигурации атомов элементов изменяются периодически, то соответственно периодически изменяются и свойства элементов, которые определяются их электронным строением: размерами атомов, энергетическими характеристиками, окислительно-восстановительнымим свойствами. Главным химическим свойством атомов элементов является их окислительная или восстановительная способность, которая определяется положением элемента в ПСЭ. В периодах от начала к концу ослабляется восстановительная активность атомов и возрастает окислительная, т. е. наблюдается переход от атомов с типичными свойствами металлов к атомам с типичными свойствами неметаллов, электроотрицательность атомов при этом возрастает. В пределах группы элементов (главной подгруппы) с ростом заряда ядра атомов увеличивается количество энергетических уровней атомов. Таким образом, восстановительная активность атомов по группам сверху вниз возрастает, а окислительная – снижается, уменьшается и величина ЭО атомов.
3. Составьте уравнения реакций в молекулярном, полном и сокращенном ионном виде
Ca(HCO3)2 + Ca(OH)2 Þ;
MgOHCl + HNO3 Þ.
---------------------------------------------------------------------------------------------------------------------------
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 42
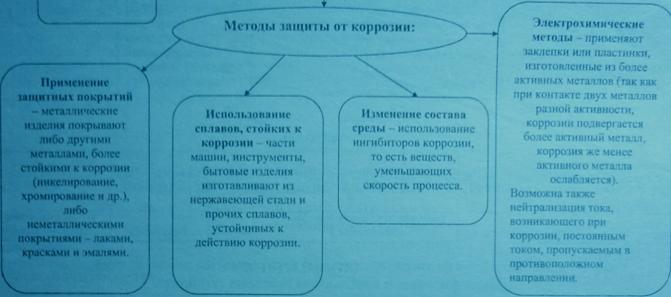
Методы защиты металлов от коррозии.
Гидролиз солей.
Гидролиз – реакция обмена между солью и водой.
Соль образована сильным основанием и слабой кислотой (щелочная среда):
Na2CO3 + H2O = NaHCO3 + NaOH
Соль образована слабым основанием и слабой кислотой (нейтральная, слабокислая, слабощелочная среда). Такие соли чаще всего разлагаются водой полностью:
AL2S3 + 6H2O = 2AL(OH)3 + 3H2S
Соль образована слабым основанием и сильной кислотой (кислая среда):
CuCL2 + H2O = Cu(OH)CL + HCL
Не подвергаются гидролизу соли, образованные сильной кислотой и сильным основанием.
3. Cоставьте полные ионные и молекулярные уравнения, соответствующие приведенным кратким уравнениям реакций:
NiOH+ + H+ Þ Ni2+ + H2O;
NiOH+ + H+ Þ Ni2+ + H2O
NiOH+ + NO3– + H+ + NO3–  Ni2+ + 2 NO3– + H2O
Ni2+ + 2 NO3– + H2O
NiOHNO3 + HNO3  Ni(NO3)2 + H2O
Ni(NO3)2 + H2O
BO33- + 3H+ Þ H3BO3.
--------------------------------------------------------------------------------------------------------------------------------
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 43
Металлические покрытия.
Металлические покрытия наносят гальваническим методом (гальванический электролиз), погружением деталей в расплавленный металл, лужением и методом металлизации (газотермическим напылением).
Гальванические покрытия используют в качестве защитно-декоративных покрытий различных металлических изделий (покрытие хромом, никелем, серебром) и антикоррозионных покрытий крепежных деталей, труб (покрытие цинком, кадмием, медью).
2. Основные положения теории электролитической диссоциации С.Аррениуса.
1. Электролитам в водной среде (и в расплавленном состоянии) свойственно распадаться на положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы). Свойства ионов резко отличаются от свойств нейтральных атомов составляющих их элементов. Ионы в водных растворах гидратированны (аквакомплексы). Так, нейтральный атом натрия +11Na 1 s 22 s 22 p 63s1 при обычных условиях легко отдает наружный (3 s 1) электрон (окисляется). Натрий бурно реагирует с водой, кислотами, химически активен.
Ион (катион) натрия +11Na+ 1 s 22 s 22 p 6 не может отдавать электроны (окисляться), не реагирует с водой.
2. Беспорядочное (хаотичное) движение ионов в растворе под действием электрического поля становится направленным: положительно заряженные ионы (катионы) движутся к электроду с отрицательным зарядом (катоду), а анионы – к аноду. Этим объясняется ионная проводимость водных растворов и расплавов электролитов.
NaOH  Na+ + OH–. Na+ + OH–.
| Гидpaтированныe анионы гидроксильных групп, двигаясь к аноду, окрашивают нейтральный (фиолетового цвета) лакмус в синий цвет.
|
HCl  H+ + Cl–. H+ + Cl–.
| Катионы гидроксония H3O+, двигаясь к катоду, окрашивают лакмус в красный цвет.
|
3. Процесс диссоциации электролитов в водной среде (расплавах) является обратимым:

3Составьте уравнения гидролиза Be(NO3)2, Rb2S, BaCl2 в молекулярном и ионном виде. Укажите рН среды.
--------------------------------------------------------------------------------------------------------------------------
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 44
1. Протекторная и катодная защита металлов от коррозии.
Коррозия является электрохимическим процессом, образующим электрические потенциалы на участках поверхности металла с появлением при этом электрического тока (называемого в данном случае коррозионным током). Поэтому основным принципом активной катодной защиты черных металлов является защита посредством «жертвенных» электронов. Принцип заключается в том, что один металл (в данном случае – цинк) расходуется (жертвуется) для защиты другого металла (железо). Основной довод в пользу применения в качестве защитного покрытия для стали именно цинка — то, что цинк подвергается ржавлению гораздо медленнее, нежели железо.
Существует несколько способов катодной защиты металла от коррозии:
– присоединить к «плюсу» аккумуляторной батареи защищаемый металл (подземный трубопровод), сделав его катодом;
– прикрепить к днищу корабля (или нефтепроводу) цинковую пластину, которая будет ржаветь, защищая сталь (такая пластина называется протектором, а катодная защита — протекторной);
– покрыть цинком (анодом) защищаемую металлическую поверхность.
Последний метод защиты оказался самым эффективным и получил название — цинкование (оцинковка). Эффект в данном случае достигается за счёт очень хорошего электрического контакта между цинком и сталью.
Протекторная защита металла — способ антикоррозионной защиты, при котором защищаемой поверхности необходимо обеспечить контакт с более активным металлом (ссылка). По отношению к железу, более активными металлами являются кадмий, хром, цинк, магний и другие металлы.
Из механизма коррозии металла, следует, что более активный металл начинает испускать электроны и присоединять к образовавшимся ионам гидроксильной группы из раствора электролита, а другой, менее активный, будет принимать электроны, присоединяя их к своим ионам. В результате, более активный металл — анод — будет окисляться, а менее активный металл — катод восстанавливаться. Таким образом, анод будет защищать от коррозии результате, анод будетяться, а
Протекторная защита нашла широкое применение для защиты таких объектов как: подземные трубопроводы, резервуары, морские и речные суда и др. Все эти объекты находятся в постоянном контакте с электролитом, будь то грунтовые воды, химические растворы, морская или речная вода.
Для реализации протекторной защиты необходимо обеспечить соприкосновение самого протектора с чистой поверхностью защищаемого металла См. Рис. 1.
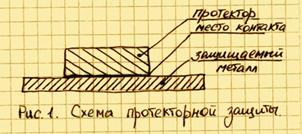
Если на эту конструкцию будет воздействовать внешняя среда, то электроны протектора будут переходить в защищаемый металл и на катоде начнется выделение водорода. Ионы протектора, соединяясь с кислородом (гидроксильными группами OH), вызывают окислительную реакцию, которая приводит к появлению гидроокиси того металла, из которого сделан протектор. Таким образом, обеспечивается катодная защита металла до тех пор, пока протектор полностью не разрушится вследствие коррозии. После полного разрушения начнет корродировать и сам металл.
Среди лакокрасочных материалов выделят класс протекторных грунтовок (цинконаполненных или цинкосодержащих). Применение данного вида материалов получило название «холодное цинкование».
2. Укажите, какие молекулы из перечисленных имеют угловую форму:
H2O, BeCl2, CO2, H2S?
H2O, H2S
3. Определите молярные концентрации ионов Н+ и ОН-; рН и рОН 0,00001 М растворов азотной кислоты и едкого кали, если их степени диссоциации принять равными 1.
-----------------------------------------------------------------------------------------------------------------------------




 Ni2+ + 2 NO3– + H2O
Ni2+ + 2 NO3– + H2O Na+ + OH–.
Na+ + OH–.





