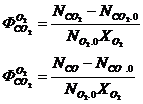Если в основе процесса лежит химическое взаимодействие, то МБ составляется с учётом стехеометрических соотношений химической реакции, поэтому удобно выражать количество веществ в молях и кмолях для периодических процессов, в мольных потоках F для непрерывных процессов. F [моль / с ]. Связь между объёмными W,массовыми G и мольными потоками определяются соотношением
М — молярная масса.
ρ - плотность j -го компонента
С - концентрация
Рассмотрим стехеометрические соотношения для закрытой системы в случае протекания единственной реакции.
YАА + VуY-VвВ + VzZ
Обозначим исходное количество молей веществ NА,О, NY,O, NВ,О, NZ,O. Тогда справедливо соотношение:
n - химическая переменная (глубина, полнота реакции), численно равна количеству молей исходного или конечного вещества, при котором стехиометрические коэффициенты равны 1 и которое прореагировало или образовалось к данному моменту времени.
Если в процессе реакции объем реакционной смеси не меняется, то используют удельную химическую переменную, а количество веществ выражают через концентрацию
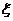 - удельная химическая переменная.
- удельная химическая переменная.
Запишем химическую реакцию в форме равноправной ко всем участникам
Тогда для всех участников:
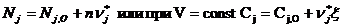
Реакция записывается в форме:
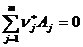 , где т - число участников реакции.
, где т - число участников реакции.
Если в процессе протекает не одна, ар реакций, число участников реакции т, то все реакции можно записать в виде системы из р реакций вида:
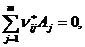
где j = 1.. .т - число участников,
I = 1...р- число уравнений реакции.
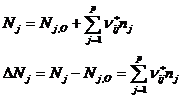 В этой системе можно использовать стехиометрические коэффициенты из уравнений vj, при этом для исходных веществ коэффициенты берутся со знаком «-». Суммарное изменение количества вещества во всех реакциях можно представить в виде:
В этой системе можно использовать стехиометрические коэффициенты из уравнений vj, при этом для исходных веществ коэффициенты берутся со знаком «-». Суммарное изменение количества вещества во всех реакциях можно представить в виде:
Записываем также соотношения для всех т веществ, получаем: МБ процесса
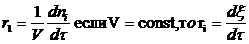 Определим скорость i-ой стадии:
Определим скорость i-ой стадии:
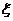 - удельная химическая переменная.
- удельная химическая переменная.
Тогда скорость процесса по j'-му веществу во всем многоступенчатом процессе:
Число уравнений в системе массового баланса, равное числу участников реакции может быть меньше, равно или больше числа реакций р. Такие системы решаются с использованием методов линейной алгебры.
С + О2->СО2 0 = -1С-1О2+1СО2
2С + О2 -> 2СО 0 = -2С - 1О2 + 2 СО
С + СО2 -> 2СО 0 = -1С - 1СО2 + 2СО
2СО + О2 -> 2СО2 0 = 2СО - 1 02 + 2СО2
Запишем материальный баланс по каждому участнику реакции, используя химические переменные:
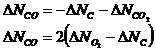 Таким образом, система содержит 2 неизвестных. Из последних трех уравнений следует, что:
Таким образом, система содержит 2 неизвестных. Из последних трех уравнений следует, что:
Выразим исходные вещества:
Элементы, содержащие 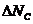 и
и 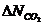 - ключевые, остальные - неключевые.
- ключевые, остальные - неключевые.
Полученные соотношения - стехиометрические соотношения мольного или материального баланса. Число ключевых веществ равно фактическому числу независимых переменных в системе уравнений (А).
Число стехиометрических соотношений мольного баланса равно числу неключевых веществ. Ключевые вещества выбираются произвольно с учетом простоты определения содержания этих компонентов в реакционной смеси.
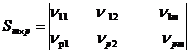 Уравнение мольного баланса можно записать в виде стехиометрической матрицы или матрицы стехиометрических коэффициентов.
Уравнение мольного баланса можно записать в виде стехиометрической матрицы или матрицы стехиометрических коэффициентов.
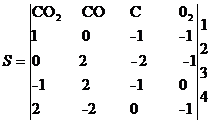 Для упрощения над столбцами пишутся вещества, за строками - номера уравнений реакции.
Для упрощения над столбцами пишутся вещества, за строками - номера уравнений реакции.
Опорным элементом матрицы называется первый слева элемент строки, не равный нулю. Если вся строка равна нулю, то опорного элемента в ней нет.
Ступенчатой называется матрица, в которой в каждой последующей строке опорный элемент стоит правее, чем в предыдущей или последующей, а все остальные строки нулевые.
Матрицей вида Гаусса называется ступенчатая матрица, у которой все опорные элементы равны 1, а над ними стоят нули.
Любую матрицу можно преобразовать к виду Гаусса.
1 + 3 -> 3
1*[-2]+4->4
3-(2+4)->3
 2*0,5->
2*0,5->

Число ненулевых строк гауссовской матрицы -ранг матрицы. Ключевые вещества соответствуют опорным элементам матрицы, т.е. число ключевых веществ равно рангу матрицы.
СО2-С-О2 = 0
СО - С - 0,5О2 = 0 - суммарные уравнения, в каждое из которых входит по одному ключевому элементу со стехиометрическим коэффициентом 1. Число суммарных уравнений равно рангу матрицы.
Химический процесс записывают в виде суммарных реакций, каждой реакции вместо номера присваивают индекс входящего в него ключевого элемента j, по скорости изменения количества которого определяют скорость реакции.
Зная скорости суммарных реакций г, и их тепловые эффекты -  , можно определить скорость тепловыделения в] -той реакции -
, можно определить скорость тепловыделения в] -той реакции - 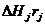 и суммарную скорость тепловыделения
и суммарную скорость тепловыделения 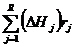 , где К - ранг стехиометрической матрицы.
, где К - ранг стехиометрической матрицы.
По суммарным реакциям записывают мольный баланс, т.е. вместо 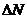 вводят химические переменные стадии для ключевых веществ.
вводят химические переменные стадии для ключевых веществ.
Система суммарных реакций должна быть полной, т.е. учитывать все процессы, протекающие в данной системе между веществами. Если пропустить некоторые реакции, то это скажется на ранге стехиометрической матрицы, т.е. число ключевых элементов будет меньше действительного, а число уравнений мольного баланса больше. Для контроля учета реакций составим молекулярную матрицу, или матрицу состава. Столбцы будут соответствовать участвующим элементам, а строки — веществам. На пересечении строки и столбца проставляем количество атомов элемента в данном соединении. Затем определяем ранг матрицы.
Определяем сумму рангов стехиометрической и молекулярной матриц:
Кс =2, Rм = 2, 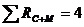
4 - показывает, сколько уравнений реакций должно быть в этой системе.
Основным реагентом называется тот, который взят в недостатке. Для простой реакции это означает, что отношение начального количества вещества к стехиометрическому коэффициенту будет наименьшим.
Например для реакции 5А + ЗY— >В + 2Z
начальные количества веществ следующие:
NA.0=10; NB.0= NZ.0= 1; NY.0= 9; NА = 5
Определим основной реагент и количества остальных элементов после проведения процесса.
По элементу А определяем химическую переменную.
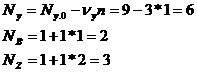 Определим количество всех остальных участников реакций:
Определим количество всех остальных участников реакций:
Для сложных реакций в технологии используются такие безразмерные характеристики материального баланса как степень превращения или конверсия основного реагента, селективность, химический выход.
Степень превращения - отношение числа молей вещества к его исходному количеству.
F — моль/с — мольный поток
G-кг/с - массовый поток
Xа- 0...1
Если реагент А расходуется по нескольким реакциям с образованием различных продуктов, ХА показывает только общую долю превращенного реагента, не исследуя пути превращения.
Селективность — доля превращенного основного реагента, пошедшего на образование данного продукта с учетом стехиометрии.
Различают селективность мгновенную (дифференциальную) и общую (интегральную). Интегральная характеризует превращение за некоторый промежуток времени и определяется по системе суммарных реакций, где ключевым веществом выбирают продукты, а основной реагент А рассматривают как неключевое вещество.
j- индекс ключевого продукта или номер его суммарной реакции;
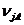 - стехиометрический коэффициент вещества А в суммарной реакции дляj - го вещества, берется с обратным знаком «-».
- стехиометрический коэффициент вещества А в суммарной реакции дляj - го вещества, берется с обратным знаком «-».
Если определить сумму селективностей по всем R ключевым веществам, то она равна 1.
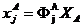 Химический выход - произведение степени превращения вещества А на селективность.
Химический выход - произведение степени превращения вещества А на селективность.
Селективность рассчитывается только по суммарным реакциям для вещества, если оно ключевое.
Рассмотрим суммарные реакции сжигания С в недостатке О2.
СО2-С-О2 = 0
СО - С - 0,5О2 = О
Пример.
Определим селективность для СО2 и СО по О2.



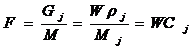
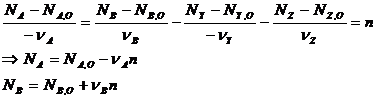
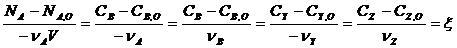
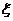 - удельная химическая переменная.
- удельная химическая переменная.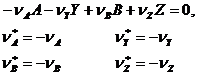
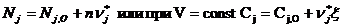
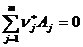 , где т - число участников реакции.
, где т - число участников реакции.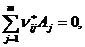
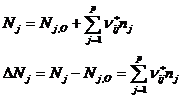 В этой системе можно использовать стехиометрические коэффициенты из уравнений vj, при этом для исходных веществ коэффициенты берутся со знаком «-». Суммарное изменение количества вещества во всех реакциях можно представить в виде:
В этой системе можно использовать стехиометрические коэффициенты из уравнений vj, при этом для исходных веществ коэффициенты берутся со знаком «-». Суммарное изменение количества вещества во всех реакциях можно представить в виде: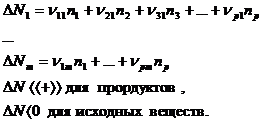
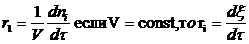 Определим скорость i-ой стадии:
Определим скорость i-ой стадии: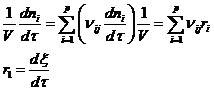
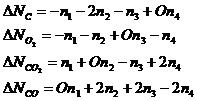
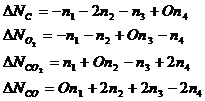
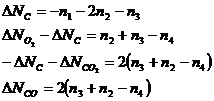
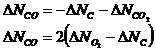 Таким образом, система содержит 2 неизвестных. Из последних трех уравнений следует, что:
Таким образом, система содержит 2 неизвестных. Из последних трех уравнений следует, что: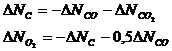
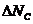 и
и 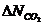 - ключевые, остальные - неключевые.
- ключевые, остальные - неключевые.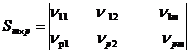 Уравнение мольного баланса можно записать в виде стехиометрической матрицы или матрицы стехиометрических коэффициентов.
Уравнение мольного баланса можно записать в виде стехиометрической матрицы или матрицы стехиометрических коэффициентов.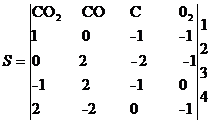 Для упрощения над столбцами пишутся вещества, за строками - номера уравнений реакции.
Для упрощения над столбцами пишутся вещества, за строками - номера уравнений реакции. 2*0,5->
2*0,5->
 , можно определить скорость тепловыделения в] -той реакции -
, можно определить скорость тепловыделения в] -той реакции - 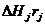 и суммарную скорость тепловыделения
и суммарную скорость тепловыделения 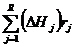 , где К - ранг стехиометрической матрицы.
, где К - ранг стехиометрической матрицы.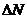 вводят химические переменные стадии для ключевых веществ.
вводят химические переменные стадии для ключевых веществ.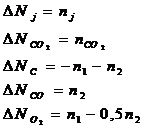
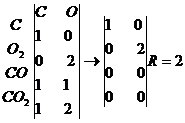
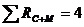
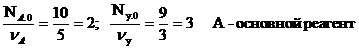
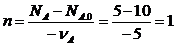
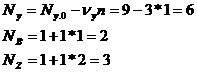 Определим количество всех остальных участников реакций:
Определим количество всех остальных участников реакций: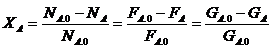
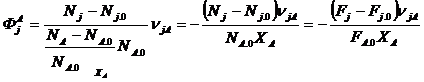
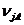 - стехиометрический коэффициент вещества А в суммарной реакции дляj - го вещества, берется с обратным знаком «-».
- стехиометрический коэффициент вещества А в суммарной реакции дляj - го вещества, берется с обратным знаком «-».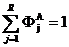
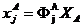 Химический выход - произведение степени превращения вещества А на селективность.
Химический выход - произведение степени превращения вещества А на селективность.