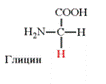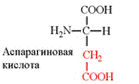ЗАНЯТИЕ 13
СТРУКТУРА И ФУНКЦИИ АМИНОКИСЛОТ И ИХ БИОЛОГИЧЕСКИ ВАЖНЫЕ РЕАКЦИИ
1. Аминокислоты, входящие в состав белков: классификация с учетом химической природы радикала и его способности взаимодействовать с водой. Незаменимые аминокислоты.
Аминокислотами называют бифункциональные производные углеводородов, которые содержат карбоксильную группу -COOH и аминогруппу -NH2.
Классификация аминокислот по полярности их радикалов:
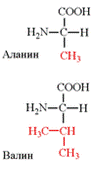
1. Аминокислоты с неполярными (гидрофобными радикалами): содержат в радикале углеводородные группы и ароматические кольца (аланин (ала), валин (вал*), лейцин (лей*), изолейцин (иле*), метионин (мет*), фенилаланин (фен*), триптофан (три*), пролин (про)).
.





2. Аминокислоты с полярными (гидрофильными) незаряженными радикалами: радикалы содержат в своем составе полярные группировки (-ОН, -SH, -NH2). Эти группы взаимодействуют с дипольными молекулами воды, которые ориентируются вокруг них. К полярным незаряженным относятся: глицин (гли), серин (сер), треонин (тре*), тирозин (тир), цистеин (цис), апарагин (асн), глутамин (глн)).


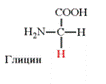


3. Аминокислоты с отрицательно заряженными радикалами: аспартат или аспарагиновая кислота (асп), глутамат или глутаминовая кислота (глу). В нейтральной среде асп и глу приобретают отрицательный заряд.
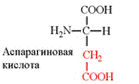

4. Аминокислоты с положительно заряженными радикалами: лизнин (лиз*), аргинин (арг*), гистидин (гис*). Имеют дополнительную аминогруппу (или имидазольное кольцо, как гистидин) в радикале. В нейтральной среде лиз, арг и гис приобретают положительный заряд.



Примечание: * - незаменимые (эссенциальные) аминокислоты.
Существует биологическая классификация аминокислот:
1. Незаменимые аминокислоты: не могут синтезироваться в организме человека и должны обязательно поступать с пищей (вал, иле, лей, лиз, мет, тре, три, фен) и еще 2 аминокислоты относятся к частично незаменимым (арг, гис).
2. Заменимые аминокислоты могут синтезироваться в организме человека (глу, глн, про, ала, асп, асн, тир, цис, сер и гли).
Стереоизомерия аминокислот.
Основной тип построения α-аминокислот, т. е. связь одного и того же атома углерода с двумя разными функциональными группами, радикалом и атомом водорода, уже сам по себе предопределяет хиральность α-атома углерода. Исключение составляет простейшая аминокислота глицин H2NCH2COOH, не имеющая центра хиральности.
Конфигурация α-аминокислот определяется по конфигурационному стандарту - глицериновому альдегиду. Расположение в стандартной проекционной формуле Фишера аминогруппы слева (подобно группе ОН в l-глицериновом альдегиде) соответствует l-конфигурации, справа - d-конфигурации хирального атома углерода. По R, S-системе α-атом углерода у всех α-аминокислот l-ряда имеет S-, а у d-ряда - R-конфигурацию (исключение составляет цистеин).
Большинство α-аминокислот содержит в молекуле один асимметрический атом углерода и существует в виде двух оптически активных энантиомеров и одного оптически неактивного рацемата. Почти все природные α-аминокислоты принадлежат к l-ряду.

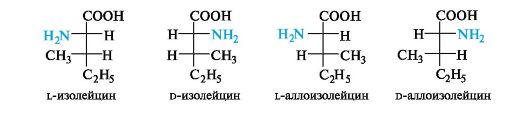
Аминокислоты изолейцин, треонин и 4-гидроксипролин содержат в молекуле по два центра хиральности.

Такие аминокислоты могут существовать в виде четырех стереоизомеров, представляющих собой две пары энантиомеров, каждая из которых образует рацемат. Для построения белков животных организмов используется только один из энантиомеров.
Стереоизомерия изолейцина аналогична рассмотренной ранее стереоизомерии треонина. Из четырех стереоизомеров в состав белков входит l-изолейцин с S-конфигурацией обоих асимметрических атомов углерода С-α и С-β. В названиях другой пары энантиомеров, являющихся диастереомерами по отношению к лейцину, используется приставка алло -.
Образование сложных эфиров
Так как реакция этерификации протекает в кислой среде, сложные эфиры аминокислот образуются в виде солей по аминогруппе:

Образовавшиеся эфиры не могут существовать в виде биполярных ионов, поэтому, в отличие от исходных аминокислот, они растворяются в органических растворителях и имеют более низкие температуры кипения. Это даёт возможность разделить смесь эфиров аминокислот перегонкой.
Образование хлорангидридов.
Эту реакцию часто называют реакцией «активации» карбоксильной группы. Хлорангидриды α-аминокислот получают действием на аминокислоты тионилхлорида (SOCl2) или хлорида фосфора (V) (PCl5). Полученные хлорангидриды неустойчивы и существуют только в виде солей:

Поэтому реакцию обычно проводят, предварительно защитив аминогруппу ацилированием.
Образование амидов аминокислот
Такие амиды получают действием аммиака или первичных аминов на хлорангидриды с защищённой аминогруппой. В случае использования реакции с аминами получают замещённые по азоту амиды аминокислот:

Реакции аминогруппы
Реакция ацилирования. Образование N-замещённых амидов
N-замещенные амиды часто рассматривают как N-ацильные производные. Эта реакция была отмечена ранее как реакция защиты аминогруппы. Её можно рассматривать как процесс ацилирования аминогруппы хлорангидридами или ангидридами кислот:

Реакция протекает лучше в щелочной среде. Примером может служить получение N-бензоилаланина в присутствии водного раствора гидроксида натрия. Этот метод получения N-ацильных производных называют ацилированием по Шоттен-Бауману:

Щёлочь необходима для связывания выделяющегося хлороводорода, т. к. в кислой среде N-ацильные производные легко гидролизуются, освобождая исходную аминокислоту:

Это общепринятый способ удаления защитной группы. Однако в некоторых случаях невозможно удалять защитную группу гидролизом в кислой среде. Например, при гидролизе пептидов будет разрушаться пептидная связь. В этих случаях защиту проводят такими реагентами, удаление которых можно провести не гидролизом, а каким-либо другим методом. Например, аминогруппу можно защищать реакцией с карбобензоксихлоридом (бензиловый эфир хлормуравьиной кислоты).
Карбобензоксигруппа удаляется затем каталитическим гидрогенолизом:

Присутствие у одного атома углерода двух функциональных групп (аминогруппы и карбоксильной) приводит к появлению специфических реакций in vivo.
Образование пептидов - реакция ацилирования одной аминокислоты другой аминокислотой:

Затем дипептид присоединяет следующую молекулу аминокислоты, образуя трипептид, и так далее:

Алкилирование аминокислот
Аминокислоты можно алкилировать по аминогруппе галоидными алкилами (обычно иодистыми алкилами). Например, алкилированием глицина можно получить метиламиноуксусную кислоту - саркозин, которая в связанном виде содержится в некоторых белках.

При избытке иодистого метила образуется четвертичная аммонийная соль:

Взаимодейстивие с динитрофторбензолом (ДНФБ)
Важной реакцией α-аминогруппы является её реакция с
2,4-динитрофторбензолом (ДНФБ) в слабощелочном растворе, которую впервые использовал Фредерик Сенгер для количественного введения метки в аминогруппы аминокислот и пептидов. Эта реакция протекает по механизму нуклеофильного замещения.

Продукт реакции окрашен в интенсивно желтый цвет. Эта реакция представляет исключительную ценность для идентификации N-концевых аминокислот полипептидных цепей.
Все вышеперечисленные реакции аминогруппы аминокислот можно представить следующей схемой:

Качественные реакции. Особенность химии аминокислот и белков заключается в использовании многочисленных качественных (цветных) реакций, составлявших ранее основу химического анализа. В настоящее время, когда исследования проводятся с помощью физико-химических методов, многие качественные реакции продолжают применять для обнаружения α-аминокислот, например, в хроматографическом анализе.
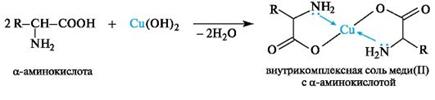
Хелатообразование. С катионами тяжелых металлов α-аминокислоты как бифункциональные соединения образуют внутрикомплексные соли, например, со свежеприготовленным гидроксидом меди (II) в мягких условиях получаются хорошо кристаллизующиеся хелатные соли меди (II) синего цвета (один из неспецифических способов обнаружения α-аминокислот).
Нингидринная реакция. Общая качественная реакция α-аминокислот - реакция с нингидрином. Продукт реакции имеет синефиолетовый цвет, что используется для визуального обнаружения аминокислот на хроматограммах (на бумаге, в тонком слое), а также для спектрофотометрического определения на аминокислотных анализаторах (продукт поглощает свет в области 550-570 нм).

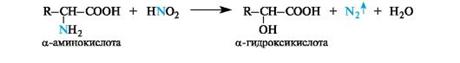
Дезаминирование. В лабораторных условиях эта реакция осуществляется при действии азотистой кислоты на α-аминокислоты. При этом образуется соответствующая α-гидроксикислота и выделяется газообразный азот, по объему которого судят о количестве вступившей в реакцию аминокислоты (метод Ван-Слайка).
Ксантопротеиновая реакция. Эта реакция используется для обнаружения ароматических и гетероциклических аминокислот - фенилаланина, тирозина, гистидина, триптофана. Например, при действии концентрированной азотной кислоты на тирозин образуется нитропроизводное, окрашенное в желтый цвет. В щелочной среде окраска становится оранжевой в связи с ионизацией фенольной гидроксильной группы и увеличением вклада аниона в сопряжение.

Биуретовая реакция. Служит для обнаружения пептидных связей. В биуретовую реакцию вступают пептиды, содержащие не менее двух пептидных связей. Пептиды и белки щелочном растворе с сульфатом меди образуют комплексы, окрашенные в сине-фиолетовый цвет.
Существует также ряд частных реакций, позволяющих обнаруживать отдельные аминокислоты.
• Триптофан обнаруживают при помощи реакции с п-диметиламино-бензальдегидом в среде серной кислоты по появляющемуся красно-фиолетовому окрашиванию (реакция Эрлиха). Эта реакция используется для количественного анализа триптофана в продуктах расщепления белков.
• Цистеин обнаруживают с помощью нескольких качественных реакций, основанных на реакционной способности содержащейся в нем меркаптогруппы. Например, при нагревании раствора белка с ацетатом свинца (СНзСОО)2РЬ в щелочной среде образуется черный осадок сульфида свинца Pb S, что указывает на присутствие в белках цистеина.
Биологически важные реакции аминокислот. Образование аминокислот в результате восстановительного аминирования и реакции трансаминирования
Оксидаза L-аминокислот
В печени и почках обнаружен фермент оксидаза L-аминокислот, способный дезаминировать некоторые L-аминокислоты. Коферментом в данной реакции выступает ФМН (FMN). Однако вклад оксидазы L-аминокислот в дезаминирование, очевидно, незначителен, так как оптимум её действия лежит в щелочной среде (рН 10,0). В клетках, где рН среды близок к нейтральному, активность фермента очень низка.

Синтез дофамина
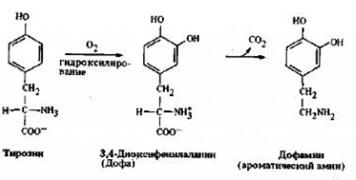
Гидроксилирование ароматической аминокислоты тарозина дает 3,4-диоксифенилаланин (ДОФА), который, в свою очередь, образует при декарбоксилировании ароматический амин дофамин, предшественник в синтезе адреналина и норадреналина.
Синтез триптамина
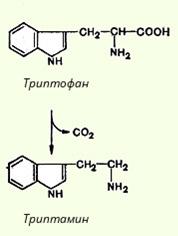
Образующийся из триптофана под действием этого фермента продукт - триптамин - наделен сосудосуживающим действием.
Для осуществления биологической функции в нервных клетках требуется определенная концентрация биогенных аминов. Синтез и секреция их строго регулируются и происходят в ответ на определенные сигналы. Избыточное накопление может вызывать различные патологические состояния.
В связи с этим большое значение имеют механизмы инактивации биогенных аминов, которая осуществляется с большой скоростью преимущественно в печени.
Существует два способа инактивации биогенных аминов и некоторых гормонов.
• Метилирование с участием SAM под действием метилтрансфераз. Таким способом могут инактивироваться различные биогенные амины, но чаще всего гистамин и адреналин:
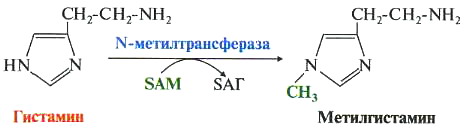
Метилированные производные биогенных аминов обычно теряют биологическую активность, в печени подвергаются конъюгации с глюкуроновой или серной кислотой и выводятся из организма или же окисляются МАО.
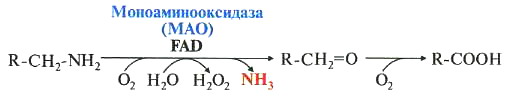
• Окисление ферментами МАО с коферментом FAD. Таким путем чаще происходит инактивация дофамина, норадреналина, серотонина, ГАМК. При этом происходит окислительное дезаминирование биогенных аминов с образованием альдегидов, а затем соответствующих кислот, которые выводятся почками.
Нейромедиаторы - низкомолекулярные вещества - поступают из синаптических пузырьков в синаптическую щель и связываются со своими рецепторами в постсинаптической мембране. Взаимодействие нейромедиатора с рецептором активирует лиганд-зависимые каналы или систему G-белка.
Нейромедиатор должен удовлетворять следующим критериям:
· вещество выделяется из нейрона при его возбуждении;
· в нейроне присутствуют ферменты для синтеза данного вещества;
· постсинаптические клетки имеют рецепторы к этому веществу;
· экзогенный аналог имитирует действие нейромедиатора.
Большинство нейромедиаторов - аминокислоты и их производные. Некоторые нейроны модифицируют аминокислоты с образованием аминов (норадреналин, серотонин, ацетилхолин). Другие нейромедиаторы (эндорфины, энкефалины) имеют пептидную природу. Каждый нейрон может синтезировать более одного нейромедиатора.
Известно более 50 химических веществ, выполняющих функции нейромедиаторов, их можно разделить на следующие группы.
· Аминокислоты: нейтральные (глутамат и аспартат) и кислые (глицин, ГАМК).
· Амины: моноамины (ацетилхолин, серотонин, гистамин) и катехоловые амины (адреналин, норадреналин, дофамин).
· Нейропептиды: ТТГ-РГ, метионин- и лейцин-энкефалины, ангиотензин II, холецистокинин-подобный пептид, окситоцин, соматостатин, люлиберин, вещество Р, нейротензин, гастрин-рилизинг пептид, аргинин-вазопрессин,?-эндорфин, АКТГ, VIP.
· Пурины: АТФ и аденозин.
Газы не являются «классическими» медиаторами, поскольку не содержатся в синаптических пузырьках. Пример: оксид азота (NO).
7. Реакции гидроксилирования (фенилаланин → тирозин, триптофан → 5-гидрокситриптофан, пролин → 4-гидроксипролин). Роль гидроксипролина в стабилизации спирали коллагена дентина и эмали.
Гидроксилированием называют введение в молекулу органического соединения гидроксильной группы. Так, гидроксилирование фенилаланина приводит к образованию тирозина:

Отсутствие в организме фермента, катализирующего эту реакцию, приводит к тяжелому заболеванию - фенилкетонурии.
Гидроксилирование триптофана в 5-гидрокситриптофан (синтез серотонина):

Значительный интерес представляет реакция гидроксилирования пролина:

Гидроксилирование пролина необходимо для стабилизации тройной спирали коллагена, которая осуществляется за счет образования водородных связей.
При цинге нарушается гидроксилирование остатков пролина и лизина. В результате образуются менее прочные коллагеновые волокна, что приводит к хрупкости и ломкости кровеносных сосудов.
ЗАНЯТИЕ 13
СТРУКТУРА И ФУНКЦИИ АМИНОКИСЛОТ И ИХ БИОЛОГИЧЕСКИ ВАЖНЫЕ РЕАКЦИИ
1. Аминокислоты, входящие в состав белков: классификация с учетом химической природы радикала и его способности взаимодействовать с водой. Незаменимые аминокислоты.
Аминокислотами называют бифункциональные производные углеводородов, которые содержат карбоксильную группу -COOH и аминогруппу -NH2.
Классификация аминокислот по полярности их радикалов:
1. Аминокислоты с неполярными (гидрофобными радикалами): содержат в радикале углеводородные группы и ароматические кольца (аланин (ала), валин (вал*), лейцин (лей*), изолейцин (иле*), метионин (мет*), фенилаланин (фен*), триптофан (три*), пролин (про)).
.






2. Аминокислоты с полярными (гидрофильными) незаряженными радикалами: радикалы содержат в своем составе полярные группировки (-ОН, -SH, -NH2). Эти группы взаимодействуют с дипольными молекулами воды, которые ориентируются вокруг них. К полярным незаряженным относятся: глицин (гли), серин (сер), треонин (тре*), тирозин (тир), цистеин (цис), апарагин (асн), глутамин (глн)).


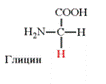


3. Аминокислоты с отрицательно заряженными радикалами: аспартат или аспарагиновая кислота (асп), глутамат или глутаминовая кислота (глу). В нейтральной среде асп и глу приобретают отрицательный заряд.
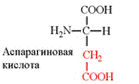

4. Аминокислоты с положительно заряженными радикалами: лизнин (лиз*), аргинин (арг*), гистидин (гис*). Имеют дополнительную аминогруппу (или имидазольное кольцо, как гистидин) в радикале. В нейтральной среде лиз, арг и гис приобретают положительный заряд.



Примечание: * - незаменимые (эссенциальные) аминокислоты.
Существует биологическая классификация аминокислот:
1. Незаменимые аминокислоты: не могут синтезироваться в организме человека и должны обязательно поступать с пищей (вал, иле, лей, лиз, мет, тре, три, фен) и еще 2 аминокислоты относятся к частично незаменимым (арг, гис).
2. Заменимые аминокислоты могут синтезироваться в организме человека (глу, глн, про, ала, асп, асн, тир, цис, сер и гли).