Комплексные соединения широко распространены в природе. В состав многих растений и живых организмов входят соединения с макроциклическими лигандами. Комплексы с участием порфина называются порфиринами.
Транспорт О2 в организме животных и человека осуществляется железосодержащими комплексами - гемоглобином и миоглобином. Оба этих белка содержат «гем-группы», представляющие собой порфириновый комплекс железа:
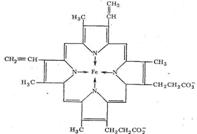
Гемовая группа присоединяется к белковой части молекулы гемоглобина и миоглобина путем координации гистидинового атома азота белка ионом железа гемовой группы. Таким образом, в координационную сферу иона железа входит пять атомов азота (четыре атома азота порфирина, один атом азота белкового гистидина). Шестое координационное место занимает Н2О или О2.
Гемоглобин имеет молекулярную массу 64 500 и включает четыре гем-группы. Миоглобин сходен с гемоглобином по строению, но содержит только одну гем-группу. Гемоглобин почти так же хорошо, как миоглобин, связывает кислород при высоком давлении кислорода, но, когда давление кислорода падает, преимущество в связывании О2 имеет миоглобин. Падение давления О2 наблюдается в тканях мышц, потребляющих кислород. Результатом использования кислорода является накопление в мышцах СО2 и, как следствие, понижение рН. Это еще более способствует высвобождению О2 из гемоглобина и передаче кислорода миоглобину. Таким образом, и гемоглобин, и миоглобин участвуют в переносе кислорода.
Теряя кислород, железо в гемоглобине (форма дезоксигемоглобина, КЧ железа = 5) переходит в высокоспиновое состояние. Ослабление связи с атомами азота порфирина приводит к выходу атома железа из плоскости кольца порфирина (на 0,7-0,8Ǻ). Напротив, вследствие присоединения кислорода к гемоглобину образуется низкоспиновый октаэдрический комплекс, железо в котором находится в плоскости порфиринового кольца (КЧ железа = 6). Хотя связывание молекулярного кислорода гемоглобином и миоглобином сопровождается ослаблением связи O = O в молекулярном кислороде из-за размещения π-дативных электронов железа на разрыхляющих орбиталях О2, этот процесс сам по себе не сопряжен с необратимым переносом электрона, поэтому его обычно не причисляют к ферментативным окислительно-восстановительным реакциям. Отметим, однако, что разрыхление связи O = O в не может не активировать окислительные реакции.
Связь кислорода с железом в макроциклическом комплексе молекулы гемоглобина не очень прочная и поэтому кислород в организме легко реагирует с восстановителями. Связывание гемоглобина молекулами угарного газа (СО) является аналогичным примером разрушения одного биокомплекса – оксигемоглобина за счет формирования в 300 раз более прочного другого биокомплекса – карбоксигемоглобина:
HbO2 + CO → HbCO + O2.
Недостаток железа в организме приводит к болезни - анемии.
К числу ферментов, катализирующих окислительно-восстановительные реакции, относятся гемсодержащие ферменты - цитохромы. Атомы железа в цитохромах, так же как в гемоглобине и миоглобине, координируют пять атомов азота (порфирина и гистидина), шестое координационное место занимает атом серы аминокислоты - метионина. Известно 50 видов ферментов этого типа, несколько различающихся по составу органической его части. Железо в цитохромах играет роль переносчика электронов - оно принимает электроны от восстановителя и передает их окислителю. Окислителем может быть и кислород, но он не участвует в координации железа, входящего в состав цитохромов, поскольку железо в цитохроме имеет полностью насыщенную координационную сферу.
Из других значимых в биологическом отношении комплексных соединений следует выделить витамин В12 и многие металлоферменты (каталаза, переносчики электронов – цитохромы), дефицит которых у человека приводит к серьезным заболеваниям.
Бионеорганические комплексы d-элементов с белковыми молекулами называют биокластерами. Внутри биокластера находится полость, в которой находится ион металла определенного размера, размер иона должен точно совпадать с диаметром полости биокластера. Металл взаимодействует с донорными атомами связующих групп: гидроксильные –ОН¯, сульфгидрильные –SH¯, карбоксильные –СОО¯, аминогруппы белков или аминокислот – NH2. Биокластеры, полости которых образуют центры ферментов, называют металлоферментами. В зависимости от выполняемой функции биокластеры условно подразделяют на:- транспортные, доставляют организму кислород и биометаллы. В качестве координирующего металла могут выступать: Со, Ni, Zn, Fe. Например – трансферрин.- аккумуляторные, накопительные. Например – миоглобин и ферритин.- биокатализаторы и активаторы инертных процессов.Металлоферменты – это ферменты класса протеидов, для каталитического действия которых необходимы ионы металлов. Всего известно около 700 ферментов, четвертую часть которых составляют металлоферменты. В их состав входят в основном ионы переходных металлов (например, железо входит в состав 70 ферментов, медь – 30, марганец – 12).
Металлоферменты делят на две группы:
| Металлоферментные комплексы или металлактивируемые системы, отличительными характеристиками которых являются:
| Истинные металлоферменты. Их основные особенности сводятся к следующему:
|
| -. непрочная связь с апоферментом, обладающим минимальной ферментативной активностью, металл легко отделяется от апофермента;
- металл связывается с апоферментом не в строго стехиометрических соотношениях;
- один металл можно заменить другим, т.е. металл играет роль активатора фермента (например, магний в составе фермента могут заменить марганец, кобальт и никель).
| - металл прочно связан с апоферментом и образует кластер, ответственный за каталитическую активность, включение иона металла в активный центр происходит только в процессе биосинтеза металлофермента;
- металл связан с апоферментом в строго определенных стехиометрических соотношениях (на 1 моль апофермента приходится от 1-2 до 4-6 атомов металла);
- нельзя заменить один металл активного центра на другой.
|
Это деление достаточно условно, величина константы устойчивости комплекса фермент – ион металла 107 – 108 М-1 определяет границу между истинными металлоферментами и металлоферментными комплексами.
Катализируемые металлоферментами реакции можно разделить на две большие группы: гидролитические реакции и окислительно-восстановительные реакции.
В гидролитических реакциях не происходит переноса электронов, а лишь разрушаются и образуются химические связи в различных субстратах. Гидролиз пептидной связи N- и С-концевых участков происходит под действием аминопептидазы с магнием, цинком или марганцом в активном центре и карбоксипептидазы с цинком активном центре.
Окислительно-восстановительные реакции (с переносом электронов) играют большую роль в жизненноважных процессах. Основным окислителем в биологических процессах является молекулярный кислород атмосферы или воды. Главные продукты окисления – вода и углекислый газ. Окисление-восстановление может осуществляться в организме не только путем передачи электронов, но и путем передачи атомов (О, Н и др.) и ионов (например, гидрид-ион Н-).






