ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 27
Метод молекулярных орбиталей.
Основные положения:
1) В методе МО молекула рассматривается как единая система ядер и электронов. Молекулярные орбитали характеризуются определенной формой и энергии.
2) МО рассчитывается согласно методу линейной комбинации атомных орбиталей
3) Число молекулярных орбиталей равно числу атомных орбиталей, участвующих в образовании молекулы
4) Число электронов на молекулярных орбиталях равно сумме числа электронов на атомных орбиталях.
5) Электроны на молекулярных орбиталях располагаются по тем же правилас, что и электроны на атомных орбиталях.
6) Электроны, располагающиеся на связывающих орбиталях, увеличивают энергию связи. Электроны, располагающиеся на разрыхляющих орбиталях, уменьшают энергию связи.
7) Порядок связи рассчитывается по формуле N= n (связ) – n(разрыхл) / 2
8) В методе МО составляются энергетические диаграммы
Составление уравнений окислительно-восстановительных реакций методом полуреакций.
1) По изменению степени окисления находят окислитель и восстановитель.
2) Составляют уравнение полуреакций окислителей и восстановителей:
А) если исходное вещество содержит кислорода больше, чем продукты реакции, то в кислой среде слева пишут Н+, справа Н2О. В нейтральной и щелочной среде наоборот.
Б) Если исходное вещество содержит кислорода меньше, чем продукт, то в кислой и нейтральной среде слева пишут Н2О, справа Н+. В щелочной среде – слева ОН, справа Н2О.
3) Уравнивают заряды в уравнениях полуреакций, прибавляя или вычитая электроны.
4) Составляют полное ионное уравнение реакции.
3. Определите простейшую формулу поташа, если массовый состав этого вещества: калия - 56,6%, углерода - 8,7%, кислорода - 34,8%.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 28
Валентность в ковалентных соединениях. Насыщаемость.
Ковалентная связь – возникает между атомами за счёт образования общей электронной пары и перекрывания электронных облаков.
Под валентностью химических элементов понимается способность свободных его атомов к образованию определённого числа ковалентных связей. В соединениях с ковалентными связями валентность атомов определяется числом образовавшихся двухэлектронных двухцентровых связей
Насыщаемость – способность атомов образовывать ограниченное число ковалентных связей.
Физические свойства металлов.
Все металлы (кроме ртути) – твердые, непрозрачные вещества с характерным металлическим блеском. Металлы обладают хорошей теплопроводностью и электропроводностью. Плотность, прочность и температура плавления металлов значительно различаются. Также металлы по-разному подвергаются обработке, то есть обладают различной ковкостью и пластичностью.
При сжигании 1,55 г фосфора получено 3,53 г фосфорного ангидрида. Определите количественный состав фосфорного ангидрида.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 29
Полярность химической связи. Полярность молекул. Дипольный момент.
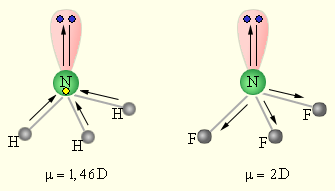
|
| Рисунок 3.1
Сложение дипольных элементов в молекулах NH3 и NF3
|
Полярность молекулы определяется разностью электроотрицательностей атомов, образующих двухцентровую связь, геометрией молекулы, а так же наличием не поделённых электронных пар, так как часть электронной плотности в молекуле может быть локализована не в направлении связей. Полярность связи выражается через ее ионную составляющую, то есть через смещение электронной пары к более электроотрицательному атому. Полярность связи может быть выражена через ее дипольный момент μ, равный произведению элементарного заряда на длину диполя *) μ = e ∙ l. Полярность молекулы выражается через ее дипольный момент, который равен векторной сумме всех дипольных моментов связей молекулы.
*) Диполь – система из двух равных, но противоположных по знаку зарядов, находящихся на единичном расстоянии друг от друга. Дипольный момент измеряется в кулон-метрах (Кл∙м) или в дебаях (D); 1D = 0,333∙10–29 Кл∙м.









