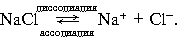ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 1
Основные классы неорганических соединений. Оксиды, основания, кислоты, соли.
Основания - сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами (с точки зрения теории электролитической диссоциации, основания - сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид - анионы OH-).
Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород.
Кислоты - сложные вещества, состоящие из атомов водорода и кислотного остатка. (С точки зрения теории электролитической диссоциации: кислоты - электролиты, которые при диссоциации в качестве катионов образуют только H+).
Соли - сложные вещества, которые состоят из атомов металла и кислотных остатков. Это наиболее многочисленный класс неорганических соединений.
2. Донорно-акцепторная связь. Механизм образования донорно-акцепторной связи.
· Ковалентная связь, образующаяся за счет пары электронов одного из атомов, т.е. по донорно-акцепторному механизму, называется дoнорно-акцeпторной.
Например, такая связь образуется между атомом азота в молекуле метиламина CH3NH2 и протоном H+ кислоты HCl:

Атом азота отдает свою электронную пару для образования связи и выступает в роли донора, а протон предоставляет вакантную орбиталь, играя роль акцептора. Атом-донор при этом приобретает положительный заряд.
Донорно-акцeпторная связь отличается только способом образования; по свойствам она одинакова с остальными ковалентными связями.
3. Железо покрыто медью. Какой из металлов будет коррозировать в случае нарушения покрытия? Составьте электронные уравнения реакций, протекающих при контактной коррозии железа и меди а) в соляной кислоте; б) в атмосферных условиях.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 2
- Основные способы получения оксидов, оснований, кислот солей.
Получение оснований:
1. Реакции активных металлов (щелочных и щелочноземельных металлов) с водой:
2Na + 2H2O ® 2NaOH + H2
2. Взаимодействие оксидов активных металлов с водой:
BaO + H2O ® Ba(OH)2
3. Электролиз водных растворов солей
2NaCl + 2H2O ® 2NaOH + H2 + Cl2
Получение оксидов
1. Взаимодействие простых и сложных веществ с кислородом:
2Mg + O2 ® 2MgO
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Cu(OH)2 –t°® CuO + H2O
Получение кислот
1. Взаимодействие кислотного оксида с водой (для кислородсодержащих кислот):
SO3 + H2O ® H2SO4
2. Взаимодействие водорода с неметаллом и последующим растворением полученного продукта в воде (для бескислородных кислот):
H2 + Cl2 ® 2HCl
3. Реакциями обмена соли с кислотой
Ba(NO3)2 + H2SO4 ® BaSO4¯ + 2HNO3
в том числе, вытеснение слабых, летучих или малорастворимых кислот из солей более сильными кислотами:
Na2SiO3 + 2HCl ® H2SiO3¯ + 2NaCl
Получение солей
Большинство способов получения солей основано на взаимодействии веществ с противоположными свойствами:
1) металла с неметаллом:2Na + Cl2 ® 2NaCl
2) металла с кислотой: Zn + 2HCl ® ZnCl2 + H2
3) металла с раствором соли менее активного металла Fe + CuSO4 ® FeSO4 + Cu
4) основного оксида с кислотным оксидом: MgO + CO2 ® MgCO3
5) основного оксида с кислотой CuO + H2SO4 –t°® CuSO4 + H2O
6) основания с кислотным оксидом Ba(OH)2 + CO2 ® BaCO3¯ + H2O
7) основания с кислотой: Ca(OH)2 + 2HCl ® CaCl2 + 2H2O
8) соли с кислотой: MgCO3 + 2HCl ® MgCl2 + H2O + CO2
9) раствора основания с раствором соли: Ba(OH)2 + Na2SO4 ® 2NaOH + BaSO4¯
10) растворов двух солей 3CaCl2 + 2Na3PO4 ® Ca3(PO4)2¯ + 6NaCl
Металлическая связь.
В металлах валентные электроны удерживаются атомами крайне слабо и способны мигрировать. Атомы, оставшиеся без внешних электронов, приобретают положительный заряд. Они образуют металлическую кристаллическую решётку.
Совокупность обобществлённых валентных электронов (электронный газ), заряженных отрицательно, удерживает положительные ионы металла в определённых точках пространства - узлах кристаллической решётки, например, металла серебро.
Внешние электроны могут свободно и хаотично перемещаться, поэтому металлы характеризуются высокой электропроводностью (особенно золото, серебро, медь, алюминий).
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 3
- Валентность. Графические формулы, правила их составления.
ВАЛЕНТНОСТЬ - способность атома присоединять или замещать определенное число других атомов или атомных групп с образованием химической связи.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 4
- Виды оксидов: основные, кислотные, амфотерные оксиды. Особенности и свойства.
Основные оксиды – соответствуют основаниям (BaO, CuO) – твердые вещ-ва разного цвета, с различной растворимостью в воде.
Химические свойства на примерах:
1. Взаимодействие с водой:
- взаимодействие с водой с образованием основания (или щёлочи)
CaO+H2O = Ca(OH)2 (реакция гашения извести, при этом выделяется большое количества тепла!)
2. Взаимодействие с кислотами:
- взаимодействие с кислотой с образованием соли и воды (раствор соли в воде)
CaO+H2SO4 = CaSO4+ H2O (Кристаллы этого вещества CaSO4 известны под названием "гипс").
3. Взаимодействие с кислотными оксидами: образование соли
CaO+CO2=CaCO3 (Это вещество - обычный мел)
Кислотные оксиды – соответствуют кислотам (CO2, SiO2) – твердые или газообразные вещ-ва с различной растворимостью в воде.
Химические свойства на примерах:
Химическая реакция с водой
CO2+H2O=H2CO3 - это вещество - угольная кислота
2. реакция с щелочами (основаниями):
CO2+NaOH=Na2CO3
3. реакция с основными оксидами:
CO2+MgO=MgCO3 –
Амфотерные оксиды – проявляют свойства кислотных и основных оксидов (MnO2, BeO) – твердые вещ-ва разного цвета, практические нерастворимые в воде.
Химические свойства на примерах:
1. реакция с кислотным оксидом:
ZnO+H2CO3 = ZnCO3 + H2O
2. реакция с основаниями:
ZnO+2NaOH=Na2ZnO2+H2O
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 5
Получение
Общим способом получения амфотерных гидроксидов является осаждение разбавленной щёлочью из растворов солей соответствующего амфотерного элемента, например:
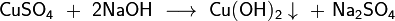
В ряде случаев при осаждении образуется не гидроксид, а гидрат оксида соответствующего элемента (например, гидраты оксидов железа(III), хрома(III), олова(II) и др.).
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 6
- Соли средние, кислые, основные. Особенности строения и свойства.
Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла. Пример:  ,
,  .
.
Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Пример:,
Основные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками.(CuOH)2 CO3
Химические свойства
Химические свойства определяются свойствами катионов и анионов, входящих в их состав.
- Соли взаимодействуют с кислотами и основаниями, если в результате реакции получается продукт, который выходит из сферы реакции (осадок, газ, мало диссоциирующие вещества, например, вода или другие оксиды):

- Соли взаимодействуют с металлами, если свободный металл находится левее металла в составе соли в электрохимическом ряде активности металлов:

- Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции (образуется газ, осадок или вода); в том числе эти реакции могут проходить с изменениемстепеней окисления
атомов реагентов:
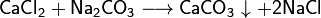
- Некоторые соли разлагаются при нагревании:

ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 7
КАТАЛИЗ - процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами. Катализаторы - вещества, изменяющие скорость химической реакции, которые могут участвовать в реакции, входить в состав промежуточных продуктов, но не входят в состав конечных продуктов реакции и после окончания реакции остаются неизменными.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 8
Основные понятия в химии. Атом, молекула, элемент, атомная масса, молекулярная масса, моль, число Авогадро, молярная масса.
Атомная масса - значение массы атома, выраженное в атомных единицах массы. В настоящее время атомная единица массы принята равной 1/12 массы нейтрального атома наиболее распространённого изотопа углерода.
Константа равновесия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 9
Принцип Ле Шателье – если изменить одно из условий – температуру, давление, концентрацию веществ, - при которых данная система находится в состоянии химического равновесия, то равновесие сместится в направлении, которое препятствует этому изменению.
3. Подберите коэффициенты в уравнениях реакций, пользуясь методом полуреакций:
a) HBr + H2SO4 Þ Br2 + SO2 + H2O,
Br2 + SO2 + 2H2O = 2HBr + H2SO4
2Br +2e =Br(-1) (*2) (окислитель Br2)
S(+4)-2e=S(+6) (восстановитель-сера со степенью окисления +4, т.е. SO2)
б) SO2 + K2Cr2O7 + H2SO4 Þ K2SO4 + Cr2(SO4)3 + H2O,
3SO2 + K2Cr2O7 + H2SO4 = K2SO4 + Cr2(SO4)3 +H2O
S^+4 - 2e = S^+6 - восстановитель *3
2Cr^+6 + 6e = 2Cr^+3 - окислитель
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 10
Закон кратных отношений - Если один и тот же элемент образует несколько соединений с другим элементом, то на одну и ту же массовую часть первого элемента будут приходиться такие массовые части второго, которые относятся друг к другу как небольшие целые числа.
Закон объёмных отношений - при постоянном давлении и температуре объемы газов, вступающих в химическую реакцию, находятся в простых отношениях друг к другу и к объемам газообразных продуктов реакции, то есть отношение объемов, в которых газы участвуют в реакции, соответствует отношению небольших целых чисел.
Химического равновесия.
Влияние концентрации – для увеличения скорости прямой реакции (и, следовательно, для смещения равновесия вправо) нужно увеличивать равновесные концентрации исходных веществ и уменьшать равновесные концентрации продуктов реакции.
Влияние давления – имеет смысл только в реакциях с участием газообразных веществ. Если прямая реакция ведёт к уменьшению числа газообразных частиц, и, следовательно, к уменьшению давления, повышение давления смещает равновесие вправо, а уменьшение смещает влево. Если прямая реакция ведёт к увеличению давления, то повышение давления смещает равновесие влево, а уменьшение смещает вправо. Если же в уравнении обратимой реакции число молекул в левой части равно числу молекул в правой части, то изменение давления не вызовет смещения химического равновесия.
Влияние температуры – при повышении температуры в экзотермических реакциях равновесие смещается влево (в сторону уменьшения исходных веществ), а в эндотермических – вправо. Поэтому экзотермические реакции нужно проводить по возможности при низких температурах. Обратимые эндотермические реакции следует проводить при высокой температуре для смещения равновесия вправо.
3. Подберите коэффициенты в уравнениях реакций, пользуясь методом полуреакций:
а) Cu2S + HNO3 Þ Cu(NO3)2 + H2SO4 + H2O + NO,
В зависимости от степени разбавления и температуры при которой происходит реакция возможны различные продукты, например:
Cu2S + 14 HNO3 => 2 Cu(NO3)2 + H2SO4 + 10 NO2 + 6 H2O
3 Cu2S + 22 HNO3 => 6 Cu(NO3)2 + 3 H2SO4 + 10 NO + 8 H2O
Cu2S + 6 HNO3 => 2 Cu(NO3) + H2SO4 + N2 + 2 H2O
б) Na2SO3 + KIO3 + H2SO4 Þ Na2SO4 + I2 + K2SO4 + H2O,
2KJO3 + 6Na2SO3 + H2SO4 = J2 + 6Na2SO4 + K2SO4 + H2O
2JO3(-) + 12H(+) - 10e = J2 + 6H2O ------x1 иод восстанавливается, KJO3 - окислитель
SO3(2-) + H2O - 2e = SO4(2-) + 2H(+)----x 6 сера окисляется, Na2SO3 - восстановитель
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 11
Эквивалент — это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в ионообменных реакциях или электрону в окислительно-восстановительных реакциях.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 12
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 13
- Основные сведения о строении атомов. Состав атомных ядер. Основные характеристики протона, нейтрона, электрона. Изотопы.

Протоны имеют заряд, равный заряду электрона, но противоположный по знаку (+), и массу, равную массе углерода или 1/12 массы углерода (эта единица называется атомная единица массы, с которой мы познакомимся попозже). Протоны обозначаются знаком р+. Нейтроны не имеют заряда, то есть они электронейтральны, и имеют массу примерно равную массе протона, т.е. 1. Обозначают n0. Сумма числа протонов и нейтронов называется массовым числом. Так как атом электронейтрален, то число протонов и электронов в атоме одинаково.
- Способы выражения концентрации растворов.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 14
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 15
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 16
- Теория строения атома водорода Н.Бора.
Постулаты Бора:
1) Электрон в атоме может находиться не на любых, а только на стационарных орбитах.
2) На стационарных орбитах электрон находится бесконечно долго ни излучая, ни поглощая энергии.
3) При переходе электрона с одной орбиты на другую энергия выделяется или поглощается только целым числом квантов.
- Температура кипения растворов. Эбулиоскопическая постоянная.
Эбулиоскопия — метод исследования растворов, основанный на измерении повышения их температуры кипения по сравнению с чистым растворителем. Используется для определения молекулярной массы растворенного вещества, активности растворителя, степени диссоциации (или изотонического коэффициента).
Температура кипения жидкости — такая температура, при которой давление пара над жидкостью равно внешнему давлению. В то же время давление пара над раствором нелетучего вещества практически полностью определяется давлением пара растворителя и, в соответствии с законом Рауля, может быть выражено уравнением:

где  — мольная доля растворителя.
— мольная доля растворителя.
Эбулиоскопическая константа растворителя равна повышению температуры кипения одномоляльного раствора.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 17
Ответ – 64 раза
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 18
- Квантовые числа. Электронные спектроскопические формулы атомов.
Квантовые числа — энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3,...)
Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, 3,..., n-1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями,
l = 1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m),
l = 2 – d-орбиталями (5 типов),
l = 3 – f-орбиталями (7 типов).
Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +l до -l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: рx, рy, рz.
Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином (от англ. веретено). Для обозначения электронов с различными спинами используются символы:  и
и 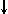 ..
..
- Основные положения теории электролитической диссоциации С.Аррениуса.
1. Электролитам в водной среде (и в расплавленном состоянии) свойственно распадаться на положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы). Свойства ионов резко отличаются от свойств нейтральных атомов составляющих их элементов. Ионы в водных растворах гидратированны (аквакомплексы). Так, нейтральный атом натрия +11Na 1 s 22 s 22 p 63s1 при обычных условиях легко отдает наружный (3 s 1) электрон (окисляется). Натрий бурно реагирует с водой, кислотами, химически активен.
Ион (катион) натрия +11Na+ 1 s 22 s 22 p 6 не может отдавать электроны (окисляться), не реагирует с водой.
2. Беспорядочное (хаотичное) движение ионов в растворе под действием электрического поля становится направленным: положительно заряженные ионы (катионы) движутся к электроду с отрицательным зарядом (катоду), а анионы – к аноду. Этим объясняется ионная проводимость водных растворов и расплавов электролитов.
NaOH 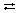 Na+ + OH–. Na+ + OH–.
| Гидpaтированныe анионы гидроксильных групп, двигаясь к аноду, окрашивают нейтральный (фиолетового цвета) лакмус в синий цвет.
|
HCl 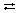 H+ + Cl–. H+ + Cl–.
| Катионы гидроксония H3O+, двигаясь к катоду, окрашивают лакмус в красный цвет.
|
3. Процесс диссоциации электролитов в водной среде (расплавах) является обратимым:
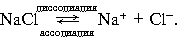
3. При 100 oC реакция заканчивается за 40 минут. Принимая температурный коэффициент реакции равным 3, определите время протекания этой же реакции при 200оС.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 19
- История открытия Периодического закона Д.И.Менделеева.
Периодическая система химических элементов — естественная классификация химических элементов, которая является графическим (табличным) выражением периодического закона химических элементов. Структура ее, во многом сходная с современной, разработана Д. И. Менделеевым на основе периодического закона в 1869-1871 гг. Прообразом периодической системы был «Опыт системы элементов, основанной на их атомном весе и химическом сходстве», составленный Д.И. Менделеевым 1 марта 1869 г. На протяжении двух лет ученый непрерывно совершенствовал «Опыт системы», ввел представление о группах, рядах и периодах элементов. В результате структура периодической системы приобрела во многом современные очертания.
Важным для ее эволюции стало понятие о месте элемента в системе, определяемом номерами группы и периода. Опираясь на это понятие, Менделеев пришел к выводу, что необходимо изменить атомные массы некоторых химических элементов: урана, индия, церия и его спутников. Это было первое практическое применение периодической системы. Менделеев также впервые предсказал существование нескольких неизвестных элементов. Ученый описал важнейшие свойства экаалюминия (будущего галлия), экабора (скандия) и экасилиция (германия). Кроме того, он предсказал существование аналогов марганца (будущих технеция и рения), теллура (полония), йода (астата), цезия (франция), бария (радия), тантала (протактиния). Прогнозы ученого в отношении данных элементов носили общий характер, поскольку эти элементы располагались в малоизученных областях периодической системы.
Первые варианты периодической системы химических элементов во многом представляли лишь эмпирическое обобщение. Ведь был неясен физический смысл периодического закона, отсутствовало объяснение причин периодического изменения свойств элементов в зависимости от возрастания атомных масс. В связи с этим оставались нерешенными многие проблемы. Есть ли границы периодической системы? Можно ли определить точное количество существующих элементов? Оставалась неясной структура шестого периода — каково точное количество редкоземельных элементов. Было неизвестно, существуют ли еще элементы между водородом и литием, какова структура первого периода. Поэтому вплоть до физического обоснования периодического закона и разработки теории периодической системы перед ней не раз возникали серьезные трудности. Неожиданным было открытие в 1894 — 1898 гг. плеяды инертных газов, которым, казалось, не находилось места в периодической системе. Эта трудность была устранена благодаря идее включить в структуру периодической системы самостоятельную нулевую группу. Массовое открытие радиоэлементов на стыке XIX и ХХ вв. (к 1910 г. их число составляло около 40) привело к резкому противоречию между необходимостью их размещения в периодической системе и ее сложившейся структурой. Для них было только 7 вакантных мест в шестом и седьмом периодах. Эта проблема была решена в результате установления правил сдвига и открытия изотопов.
Одна из главных причин невозможности объяснить физический смысл периодического закона и структуру периодической системы состояла в том, что было неизвестно, как построен атом. Важнейшей вехой на пути развития периодической системы явилось создание атомной модели Э. Резерфордом (1911). На ее основе голландский ученый А. Ван ден Брук (1913) высказал предположение, что порядковый номер элемента в периодической системе численно равен заряду ядра его атома (Z). Это экспериментально подтвердил английский ученый Г. Мозли (1913). Периодический закон получил физическое обоснование: периодичность изменения свойств элементов стала рассматриваться в зависимости от Z-заряда ядра атома элемента, а не от атомной массы.
В результате структура периодической системы Менделеева значительно упрочилась. Была определена нижняя граница системы. Это водород - элемент с минимальным Z = 1. Стало возможным точно оценить количество элементов между водородом и ураном. Были определены «пробелы» в периодической системе, соответствующие неизвестным элементам с Z = 43, 61, 72, 75, 85, 87. Однако оставались неясными вопросы о точном количестве редкоземельных элементов и, что особенно важно, не были вскрыты причины периодичности изменения свойств элементов в зависимости от Z.
Опираясь на сложившуюся структуру периодической системы и результаты изучения атомных спектров, датский ученый Н. Бор в 1918 — 1921 гг. развил представления о последовательности построения электронных оболочек и подоболочек в атомах. Ученый пришел к выводу, что сходные типы электронных конфигураций атомов периодически повторяются. Таким образом, было показано, что периодичность изменения свойств химических элементов объясняется существованием периодичности в построении электронных оболочек и подоболочек атомов.
В настоящее время периодическая система охватывает 117 элементов. Из них все трансурановые элементы (Z' = 93 — 117), а также элементы с Z = 43 (технеций), 61 (прометий), 85 (астат), 87 (франций) получены искусственно.
Фундаментальным принципом построения периодической системы является ее подразделение на группы и периоды. Менделеевское понятие рядов элементов ныне не употребляется, поскольку лишено физического смысла. Группы, в свою очередь, подразделяются на главную (а) и побочную (b) подгруппы. В каждой подгруппе содержатся элементы — химические аналоги. Элементы а- и b-подгрупп в большинстве групп также обнаруживают между собой определенное сходство, главным образом в высших степенях окисления, которые, как правило, равны номеру группы.
- Особенности диссоциации кислот, оснований, солей (средних, кислых, основных).
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 20
Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как: HCl, HBr, HI, HNO3).
Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты), основания p-, d-, и f- элементов.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 21
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 22
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 23
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 24
Окислительно – восстановительные реакции (ОВР)– реакции, протекающие с изменением степеней окисления элементов. Окисление – процесс отдачи электронов. Восстановление – процесс принятия электронов. Восстановитель – отдает электроны, то есть окисляется. Окислитель – принимает электроны, то есть восстанавливается.
Межмолекулярные ОВР – окислитель и восстановитель находятся в разных веществах.
S0 + O20 S+4O2-2
S - восстановитель; O2 - окислитель
Внутримолекулярные ОВР – окислитель и восстановитель находятся в одном веществе.
2KCl+5O3-2 2KCl-1 + 3O20
Cl+5 - окислитель; О-2 – восстановитель
Реакции диспропорционирования – степень окисления одного и того же элемента одновременно уменьшается и увеличивается.
Cl20 + 2KOH KCl+1O + KCl-1 + H2O
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ №25
Составьте формулы
сульфата алюминия - Al 2(SO 4)3.

Гидроксокарбоната меди(II).
(CuOH)2CO3
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 26
Метод электронного баланса.
Метод электронного баланса — один из методов уравнивания окислительно-восстановительных реакций (ОВР).Заключается в том чтобы на основании степеней окисления расставить коэффициенты в ОВР. Для правильного уравнивания следует придерживаться определённой последовательности действий:
1) Найти окислитель и восстановитель.
2) Составить для них схемы (полуреакции) переходов электронов, отвечающие данному окислительно-восстановительному процессу.
3) Уравнять число отданных и принятых электронов в полуреакциях.
4) Просуммировать порознь левые и правые части полуреакций.
5) Расставить коэффициенты в уравнении окислительно восстановительной реакции.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 27
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 28
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 29
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 30
Действие кислот на металлы.
Рассказать про коррозию.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 31
1. Ионная связь. Механизм образования ионной связи. Свойства ионной связи. Достоинства и недостатки теории ионной связи.
Свойства ионной связи
Так как ион может притягивать к себе ионы противоположного знака в любом направлении, ионная связь в отличие от ковалентной отличается ненаправленностью.
Взаимодействие друг с другом двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей. Поэтому они могут притягивать и другие ионы противоположного знака, то есть ионная связь отличается ненасыщенностью.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 32
Принцип Ле Шателье – если изменить одно из условий – температуру, давление, концентрацию веществ, - при которых данная система находится в состоянии химического равновесия, то равновесие сместится в направлении, которое препятствует этому изменению.
3. Мышьяк образует два оксида, содержащих 65,2% и 75,7% мышьяка соответственно. Определите эквивалент и эквивалентную массу мышьяка в обоих оксидах.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 33
Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как: HCl, HBr, HI, HNO3).
Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты), основания p-, d-, и f- элементов.
В растворах некоторых электролитов диссоциирует лишь часть молекул. Для количественной характеристики электролитической диссоциации было введено понятие степени диссоциации.
Степень диссоциации (α) — отношение числа молекул, диссоциировавших на ионы к общему числу молекул растворенного электролита.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 34
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 35
Гидролиз солей.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 36
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 37
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 38
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 39
Химическая коррозия — это процесс взаимодействия металла с коррозионной средой, при котором окисление металла и восстановление окислительного компонента среды протекают единовременно в одном акте. Продукты взаимодействия пространственно не разделены.
Электрохимическая коррозия — это процесс взаимодействия металла с коррозионной средой (раствором электролита), при котором ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала.
Коррозия внешним током и коррозия блуждающим током. В первом случае — это коррозия металла, возникающая под воздействием тока от внешнего источника. Во втором случае — под воздействием блуждающего тока.
Коррозия под напряжением — коррозия, вызванная одновременным воздействием коррозионной среды и механических напряжений. Если это растягивающие напряжения, то может произойти растрескивание металла. Это очень опасный вид коррозии, особенно для конструкций, испытывающих механические нагрузки (оси, рессоры, автоклавы, паровые котлы, турбины и т.д.). Если металлические изделия подвергаются циклическим растягивающим напряжениям, то можно вызвать коррозионную усталость. Происходит понижение предела усталости металла. Такому виду коррозии подвержены рессоры автомобилей, канаты, валки прокатных станов.
Фреттинг-коррозия — это коррозия, вызванная одновременно вибрацией и воздействием коррозионной среды. Устранить коррозию при трении или вибрации возможно правильным выбором конструкционного материала, снижением коэффициента трения, применением покрытий и т.д.
Коррозия называется сплошной, если она охватывает всю поверхность металла. Сплошная коррозия может быть равномерной, если процесс протекает с одинаковой скоростью по всей поверхности металла, и неравномерной когда скорость процесса неодинакова на различных участках поверхности. Равномерная коррозия наблюдается, например, при коррозии железных труб на воздухе.
При избирательной коррозии разрушается одна структурная составляющая или один компонент сплава. В качестве примеров можно привести графитизацию чугуна или обесцинкование латуней.
Местная (локальная) коррозия охватывает отдельные участки поверхности металла. Местная коррозия может быть выражена в виде отдельных пятен, не сильно углубленных в толщу металла; язв - разрушений, имеющих вид раковины, сильно углубленной в толщу металла, или точек (питтингов), глубоко проникающих в металл.
Первый вид наблюдается, например, при коррозии латуни в морской воде. Язвенная коррозия отмечена у сталей в грунте, а питтинговая — у аустенитной хромоникелевой стали в морской воде.
Подповерхностная коррозия начинается на поверхности, но затем распространяется в глубине металла. Продукты коррозии оказываются сосредоточенными в полостях металла. Этот вид коррозии вызывает вспучивание и расслоение металлических изделий.
Межкристаллитная коррозия характеризуется разрушением металла по границам зерен. Она особенно опасна тем, что внешний вид металла не меняется, но он быстро теряет прочность и пластичность и легко разрушается. Связано это с образованием между зернами рыхлых малопрочных продуктов коррозии. Этому виду разрушений особенно подвержены хромистые и хромоникелевые стали, никелевые и алюминиевые сплавы.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 40
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 41
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 42
Гидролиз солей.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 43
Металлические покрытия.
Металлические покрытия наносят гальваническим методом (гальванический электролиз), погружением деталей в расплавленный металл, лужением и методом металлизации (газотермическим напылением).
Гальванические покрытия используют в качестве защитно-декоративных покрытий различных металлических изделий (покрытие хромом, никелем, серебром) и антикоррозионных покрытий крепежных деталей, труб (покрытие цинком, кадмием, медью).
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 44
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 1
Основные классы неорганических соединений. Оксиды, основания, кислоты, соли.
Основания - сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами (с точки зрения теории элект






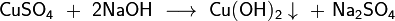
 ,
,  .
.




 — мольная доля растворителя.
— мольная доля растворителя. и
и  ..
..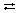 Na+ + OH–.
Na+ + OH–.