

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...
Топ:
Комплексной системы оценки состояния охраны труда на производственном объекте (КСОТ-П): Цели и задачи Комплексной системы оценки состояния охраны труда и определению факторов рисков по охране труда...
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
История развития методов оптимизации: теорема Куна-Таккера, метод Лагранжа, роль выпуклости в оптимизации...
Интересное:
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
Вопрос Закон Авогадро. Следствия из закона.
Закон Авогадро — В равных объемах различных газов при постоянных температуре и давлении содержится одинаковое число молекул.
Из Закона Авогадро выводится 2 следствия:
Следствие 1: Один моль любого газа при одинаковых условиях занимает одинаковый объем
В частности, при нормальных условиях (T=0 °C (273К) и p=101,3 кПа) объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm. Пересчитать эту величину на другие температуру и давление можно с помощью уравнения Менделеева-Клапейрона


Из Уравнения Менделеева-Клапейрона выводятся еще 3 закона
1) Закон Шарля: 
2) Закон Гей-Люссака: 
3) Закон Боля-Мариотта: 
Следствие 2: Отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов
Эта постоянная величина называется относительной плотностью газов и обозначается D. Так как молярные объемы всех газов одинаковы (1-е следствие закона Авогадро), то отношение молярных масс любой пары газов также равна этой постоянной:

В Формуле мы использовали:
 — Относительная плотность газа
— Относительная плотность газа
 — Молярные массы
— Молярные массы
 — Давление
— Давление
 — Молярный объем
— Молярный объем
 — Масса
— Масса
 — Универсальная газовая постоянная
— Универсальная газовая постоянная
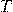 — Абсолютная температу
— Абсолютная температу
Следствия закона
Первое следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимаетодинаковый объём.
В частности, при нормальных условиях, т. е. при 0 °C (273К) и 101,3 кПа, объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm. Пересчитать эту величину на другие температуру идавление можно с помощью уравнения Менделеева-Клапейрона:
 .
.
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массывторого газа на относительную плотность первого газа по второму.
Положение это имело громадное значение для развития химии, так как оно дает возможность определятьчастичный вес[2] тел, способных переходить в газообразное или парообразное состояние. Если через m мыобозначим частичный вес тела, и через d — удельный вес[3] его в парообразном состоянии, то отношение m / d должно быть постоянным для всех тел. Опыт показал, что для всех изученных тел, переходящих в пар безразложения, эта постоянная равна 28,9, если при определении частичного веса исходить из удельного весавоздуха, принимаемого за единицу, но эта постоянная будет равняться 2, если принять за единицу удельныйвес водорода. Обозначив эту постоянную, или, что то же, общий всем парам и газам частичный объём через С, мы из формулы имеем с другой стороны m = dC. Так как удельный вес пара определяется легко, то, подставляя значение d в формулу, выводится и неизвестный частичный вес данного тела.
|
|
Элементарный анализ, например, одного из полибутиленов указывает, в нём пайное отношение углерода кводороду, как 1 к 2, а потому частичный вес его может быть выражен формулой СН2 или C2H4, C4H8 и вообще(СН2)n. Частичный вес этого углеводорода тотчас определяется, следуя закону Авогадро, раз мы знаемудельный вес, т. е. плотность его пара; он определен Бутлеровым и оказался 5,85 (по отношению к воздуху); т. е. частичный вес его будет 5,85 · 28,9 = 169,06. Формуле C11H22 отвечает частичный вес 154, формулеC12H24 — 168, а C13H26 — 182. Формула C12H24 близко отвечает наблюденной величине, а потому она идолжна выражать собою величину частицы нашего углеводорода CH2.
Строение вещества
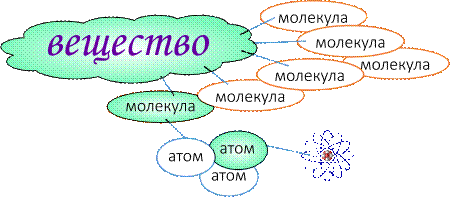
Структура любого атома похожа на миниатюрную модель солнечной системы, у которой в центре расположено ядро, состоящее из нейтронов и протонов, а вокруг ядра вращаются электроны. Каждый элемент атома имеет свой заряд: электрон - отрицательный; протон - положительный; нейтрон - нейтрален. В нормальном состоянии атом имеет нейтральный заряд, так как количество электронов и протонов всегда одинаковое.
От количества протонов в ядре атома зависит к какому химическому элементу относится сам атом. У одного и того же химического элемента в ядре атома может содержаться различное количество нейтронов. Например, атом водорода в своем ядре может содержать один или два протона, либо вообще не содержать протонов. При этом все три вида вещества будут относится к одному химическому элементу - водороду, но будут иметь разные физические свойства. Подобные элементы называются изотопами элемента. Группа изотопов одного элемента называется - нуклидами.

Значительная часть изотопов из-за своей сложной структуры и большого количества элементов в ядре атома, имеют не стабильную структуру и как следствие непродолжительное время существования. Если в ядре атома количество протонов и нейтронов сильно различается, то такой элемент является нестабильным. В результате одни элементы распадаются, образуя более простые элементы, а те в свою очередь так же могут распадаться на еще более простые и стабильные элементы. Данный процесс называется радиоактивным распадом вещества, а время, за которое часть вещества распадается, называется периодом полураспада вещества. Одни элементы могут оставаться стабильными миллиарды лет, другие могут существовать лишь тысячные доли секунды. Процесс распада в природе происходит по определённым цепочкам, от одного вещества к другому на протяжении всего существования материи.
|
|
Существует и обратный процесс, кода из более простых веществ, образуются более сложные вещества - данный процесс называется синтезом. Подобные процессы происходят в звездах и других небесных телах, в которых протекают активные термоядерные реакции. Например, в нашем солнце один из основных процессов, это слияние молекул водорода и образование из них молекул гелия.
Вопрос. Квантовая теория излучения Планка. Модель строения атома Н. Бора.
Принцип наименьшей энергии
В атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей связи его с ядром).
Энергия электрона в основном определяется главным квантовым числом n и побочным квантовым числом l, поэтому сначала заполняются те подуровни, для которых сумма значений квантовых чисел n и l является наименьшей. Например, энергия электрона на подуровне 4s меньше, чем на подуровне 3d, так как в первом случае n + 1 = 4 + 0 = 4, а во втором n + l = 3 + 2 =5; на подуровне 5s (n + l= 5 + 0 = 5) энергия меньше, чем на 4d (n + l = 4 + 2 = 6); на 5р (n + l = 5 + 1 = 6) энергия меньше, чем на 4f (n + l = 4 + 3 = 7) и т.д.
В.М. Клечковский впервые в 1961 г. сформулировал общее положение, гласящее, что электрон занимает в основном состоянии уровень не с минимальным возможным значением n, а с наименьшим значением суммы n + l.
В том случае, когда для двух подуровней суммы значений n и l равны, сначала идет заполнение подуровня с меньшим значением n. Например, на подуровнях Зd, 4р, 5s сумма значений n и l равна 5. В этом случае происходит сначала заполнение подуровней с меньшими значениями n, т.е. Зd — 4р – 5s и т.д. В периодической системе элементов Менделеева последовательность заполнения электронами уровней и подуровней выглядит следующим образом

Следовательно, согласно принципу наименьшей энергии во многих случаях электрону энергетически выгоднее занять подуровень «вышележащего» уровня, хотя подуровень "нижележащего" уровня не заполнен
 Именно поэтому в четвертом периоде сначала заполняется подуровень 4s и лишь после этого подуровень Зd.
Именно поэтому в четвертом периоде сначала заполняется подуровень 4s и лишь после этого подуровень Зd. 
Следующий элемент этого периода — 24Сr. На основании трех основных положений — принципа Паули, правила Гунда и принципа наименьшей энергии — его электронную конфигурацию можно представить так
|
|

хотя на самом деле у атома 24Cr обнаружены некоторые аномалии и действительная его электронная конфигурация несколько иная (как и еще у одного элемента 29Сr).
Для атомов Mn, Fe, Со и Ni электронные конфигурации будут следующие

Наконец, последние восемь элементов четвертого периода имеют конфигурации

Принцип наименьшей энергии справедлив только для основных состояний атомов. В возбужденных состояниях электроны могут находиться на любых орбиталях атомов, если при этом не нарушается принцип Паули.
Электронные формулы атомов химических элементов, слои расположены в порядке заполнения подуровней. Электронные слои атомов заполняются электронами в порядке, согласно правилу Клечковского.
Порядок заполнения атомных орбиталей по мере увеличения энергии следующий: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈ 6d < 7p < 8s. При заполнении орбитальных оболочек атома более предпочтительны (более энергетически выгодны), и, значит, заполняются раньше те состояния, для которых сумма главного квантового числа n и побочного (орбитального) квантового числа l, т.е. n + l, имеет меньшее значение.
10вопрос. Периодический закон Д.И.Менделеева.
периодический закон - закон, объясняющий закономерности изменения свойств элементов. Он был открыт в результате огромной исследовательской работы Д.И.Менделеева. Д.И.Менделеев пришел к открытию закона, сопоставляя свойства и относительные атомные массы элементов различных естественных групп. В то время было известно 6 таких групп – щелочные металлы, щелочноземельные металлы, галогены, группа кислорода, группа азота, группа углерода. В своей черновой работе над классификацией элементов Д.И.Менделеев использовал карточки элементов, в которых были выписаны их основные характеристики, эти карточки он располагал в порядке увеличения атомных весов элементов. Благодаря глубокому анализу, сравнению и обобщению известных данных в 1869 г. Д.И.Менделеев сформулировал периодический закон: «Свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от их атомного веса».
На основе периодического закона Д.И.Менделеев исправил характеристики некоторых известных элементов (например, атомный вес и валентность Ве), а также предсказал новые элементы, которые ещё не были известны в то время (Д.И.Менделеев назвал их экаалюминием, экабором, экасилицием. Позднее эти элементы были открыты и получили название галлий, скандий, германий).
11 вопрос 11. Периодическая система элементов. Её значение в свете учения о строении атома
Периодический закон Менделеева фундаментальный закон, устанавливающий периодическое изменение свойств химических элементов в зависимости от увеличения зарядов ядер их атомов. Открыт Д. И. Менделеевым в 1869 при сопоставлении свойств всех известных в то время элементов и величин их атомных весов. Термин "периодический закон" Менделеев впервые употребил в ноябре 1870, а в октябре 1871 дал окончательную формулировку П. з.: "... свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса" ("Периодический закон. [Основные статьи] ", 1958, с. 111). Графическим (табличным) выражением П. з. явилась разработанная Менделеевым периодическая система элементов.
|
|
Физический смысл П. з. был вскрыт лишь после выяснения того, что заряд ядра атома возрастает при переходе от одного химического элемента к соседнему (в периодической системе) на единицу элементарного заряда. Численно заряд ядра равен порядковому номеру (атомному номеру Z) соответствующего элемента в периодической системе, то есть числу протонов в ядре, в свою очередь равному числу электронов соответствующего нейтрального атома (см. Атом). Химические свойства атомов определяются структурой их внешних электронных оболочек, периодически изменяющейся с увеличением заряда ядра, и, следовательно, в основе П. з. лежит представление об изменении заряда ядра атомов, а не атомной массы элементов. Наглядная иллюстрация П. з. - кривые периодические изменения некоторых физических величин (ионизационных потенциалов, атомных радиусов, атомных объёмов) в зависимости от Z (см. Атомная физика). Какого-либо общего математического выражения П. з. не существует.
П. з. имеет огромное естественнонаучное и философское значение. Он позволил рассматривать все элементы в их взаимной связи и прогнозировать свойства неизвестных элементов. Благодаря П. з. многие научные поиски (например, в области изучения строения вещества - в химии, физике, геохимии, космохимии, астрофизике) получили целенаправленный характер. П. з. - яркое проявление действия общих законов диалектики, в частности закона перехода количества в качество.
Ионная связь
Отдельные атомы какого-либо элемента будут стремиться к устойчивой восьмиэлектронной структуре, теряя или приобретая электроны. Атомы, захватившие электроны, имеют отрицательный заряд и называются анионами, атомы, потерявшие электрон, имеют положительный заряд и называются катионами. При встрече анионов с катионами образуется ионная связь, а образуемое соединение называется ионным.
Подробнее >>
Донорно-акцепторная связь
Донорно-акцепторная связь является частным случаем ковалентной связи, когда один атом выступает в роли донора электронной пары, а другой атом — его акцептором (предоставляет свободную орбиталь). Данную связь часто называют координационной связью, т.к. она часто возникает при образовании комплексных соединений.
|
|
Подробнее >>
Метод валентных связей
Метод валентных связей (локализованных электронных пар) предполагает, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар. Поэтому химическая связь представляется двухэлектронной и двухцентровой, т.е. локализована между двумя атомами. В структурных формулах соединений обозначается черточкой: H-Cl, H-H, H-O-H Рассмотрим в свете Метода ВС, такие особенности связи, как насыщаемость, направленность и поляризуемость.
Подробнее >>
Водородная связь
Водородная связь весьма распространена и играет важную роль в биологических объектах. Рассмотрим ее образование подробнее. Можно предположить, что в любом ряду веществ с молекулами одинаковой формы и полярности температуры плавления и кипения должны повышаться прямо пропорционально возрастанию молекулярной массы, однако существуют некоторые несоответствия. На следующем рисунке приведены кривые зависимости температуры кипения гидридов элементов 6 группы от молекулярной массы.
Металлическая связь
Большинство металлов имеют общие свойства, которые отличны от свойств других простых или сложных веществ. Это такие свойства как повышенные температуры плавления, значительные электро- и теплопроводность, способность отражать свет и прокатываться в листы и имеют характерный металлический блеск. Эти свойства связаны с существованием в металлах металлической связи — связи между положительно заряженными ионами металлов. Металлическая связь возникает за счет притяжения свободно движущихся по кристаллу электронов.
вопрос Химия на современном этапе развития.
История химии изучает и описывает сложный процесс накопления специфических знаний, относящихся к изучению свойств и превращений веществ; её можно рассматривать как пограничную область знания, которая связывает явления и процессы, относящиеся к развитию химии, с историей человеческого общества. При изучении истории развития химии возможны два взаимно дополняющих подхода: хронологический и содержательный.
При хронологическом подходе историю химии принято подразделять на несколько периодов. Следует учитывать, что периодизация истории химии, будучи достаточно условной и относительной, имеет скорее дидактический смысл. При этом на поздних этапах развития науки (в случае химии – уже с начала XIX века) в связи с её дифференциацией неизбежны отступления от хронологического порядка изложения, поскольку приходится отдельно рассматривать развитие каждого из основных разделов науки.
Как правило, большинство историков химии выделяют следующие основные этапы её развития:
1. Предалхимический период: до III в. н.э.
В предалхимическом периоде теоретический и практический аспекты знаний о веществе развивались относительно независимо друг от друга. Происхождение свойств вещества рассматривала античная натурфилософия, практические операции с веществом являлись прерогативой ремесленной химии.
2. Алхимический период: III – XVII вв.
Алхимический период, в свою очередь, разделяется на три подпериода – александрийскую (греко-египетскую), арабскую и европейскую алхимию. Алхимический период – это время поисков философского камня, считавшегося необходимым для осуществления трансмутации металлов. В этом периоде происходило зарождение экспериментальной химии и накопление запаса знаний о веществе; алхимическая теория, основанная на античных философских представлениях об элементах, была тесно связана с астрологией и мистикой. Наряду с химико-техническим "златоделием" алхимический период примечателен также и созданием уникальной системы мистической философии.
3. Период становления (объединения): XVII – XVIII вв.
В период становления химии как науки произошла её полная рационализация. Химия освободилась от натурфилософских и алхимических взглядов на элементы как на носители определённых качеств. Наряду с расширением практических знаний о веществе начал вырабатываться единый взгляд на химические процессы и в полной мере использоваться экспериментальный метод. Завершившая этот период химическая революция окончательно придала химии вид самостоятельной (хотя и тесно связанной с другими отраслями естествознания) науки, занимающейся экспериментальным изучением состава тел.
4. Период количественных законов (атомно-молекулярной теории): 1789 – 1860 гг.
Период количественных законов, ознаменовавшийся открытием главных количественных закономерностей химии – стехиометрических законов, и формированием атомно-молекулярной теории, окончательно завершил превращение химии в точную науку, основанную не только на наблюдении, но и на измерении.
5. Период классической химии: 1860 г. – конец XIX в.*
Период классической химии характеризуется стремительным развитием науки: были созданы периодическая система элементов, теория валентности и химического строения молекул, стереохимия, химическая термодинамика и химическая кинетика; блестящих успехов достигли прикладная неорганическая химия и органический синтез. В связи с ростом объёма знаний о веществе и его свойствах началась дифференциация химии – выделение её отдельных ветвей, приобретающих черты самостоятельных наук.
* В большинстве учебников и учебных пособий при рассмотрении периодизации истории химии за периодом количественных законов следует современный период. Однако, по мнению автора, это не совсем корректно, т. к. в начале XX в. теоретические основания химии претерпели существеннейшие изменения. Вторая половина XIX в. является чрезвычайно важным особым этапом развития химических знаний. В этот период окончательно формируется атомно-молекулярная теория и учение о химических элементах, классические разделы химии, создаётся периодический закон, возникают две новых концептуальных системы химии – структурная химия и учение о химическом процессе.
6. Современный период: с начала XX века по настоящее время
В начале ХХ века произошла революция в физике: на смену системе знаний о материи, основанной на механике Ньютона, пришли квантовая теория и теория относительности. Установление делимости атома и создание квантовой механики вложили новое содержание в основные понятия химии. Успехи физики в начале XX века позволили понять причины периодичности свойств элементов и их соединений, объяснить природу валентных сил и создать теории химической связи между атомами. Появление принципиально новых физических методов исследования предоставило химикам невиданные ранее возможности для изучения состава, структуры и реакционной способности вещества. Всё это в совокупности обусловило в числе прочих достижений и блестящие успехи биологической химии второй половины XX века – установление строения белков и ДНК, познание механизмов функционирования клеток живого организма.
|
|
|

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...

Адаптации растений и животных к жизни в горах: Большое значение для жизни организмов в горах имеют степень расчленения, крутизна и экспозиционные различия склонов...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!