НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
621.38 № 3269
п 845
ПРОЦЕССЫ МИКРО-
И НАНОТЕХНОЛОГИИ
Методическое руководство
к лабораторным работам для студентов III курса РЭФ
(направление 210100) заочной и дневной форм обучения
Новосибирск
УДК 621.382.017.7(076.5)
П 845
Составитель: канд. техн. наук В.А. Илюшин
Рецензент: канд. физ.- мат. наук, доц. Е.А. Макаров
Работа подготовлена на кафедре полупроводниковых приборов
и микроэлектроники
Ó Новосибирский государственный
технический университет, 2006
ОГЛАВЛЕНИЕ
Лабораторная работа № 1. Химическое травление
пластин кремния.......................................................................... 4
Лабораторная работа № 2. Термическое окисление
кремниевых пластин в сухом и влажном
кислороде......................................................................................... 14
Лабораторная работа № 3. Метод вакуумного напыления....... 27
Лабораторная работа № 4. Фотолитография в производстве
полупроводниковых приборов В ИНТЕГРАЛЬ-
ных схем........................................................................................... 39
Лабораторная работа № 1
Химическое травление
пластин кремния
Цель работы – практическое освоение технологических приемов химического травления и контроля качества поверхности пластин кремния.
Химическое травление полупроводниковых
Материалов
Большинство процессов или реакций, используемых для получения или обработки полупроводниковых материалов, являются гетерогенными, т. е. протекают на границе раздела двух различных фаз. Условия равновесия определяются законом действующих масс: в равновесном состоянии отношение произведений концентраций начальных веществ к произведению концентраций конечных веществ – постоянная величина. Однако при проведении гетерогенных процессов достижение состояния равновесия часто менее существенно, чем возможность управления кинетикой процессов, которая определяет производительность процесса и качество получаемого материала.
Гетерогенные процессы многостадийны. Например, в случае взаимо-действия полупроводникового материала с любым травителем должны наблюдаться следующие стадии:
1) доставка компонентов травителя к поверхности полупроводника;
2) адсорбция компонентов травителя поверхностью;
3) поверхностная диффузия адсорбированных компонентов и химические реакции;
4) десорбция продуктов реакции;
5) удаление десорбированных продуктов от поверхности.
При последовательно протекающих стадиях общая скорость обычно лимитируется скоростью самой медленно протекающей стадии. Если в какой-либо из последовательно протекающих стадий имеет место ряд параллельных процессов, то скорость этой стадии будет определяться наиболее быстрым из них. Для ускорения процесса в целом необходимо выявить лимитирующую стадию и найти способ ее интенсификации. При этом произойдет смена лимитирующей стадии.
Таким образом, в гетерогенных системах реакции протекают на границе раздела фаз и процесс в целом состоит не менее чем из трех этапов. Кинетика реакции может быть относительно простой, если максимальная скорость одного из приведенных этапов значительно меньше скорости любого другого. При таком допущении можно разделить гетерогенные процессы на два основных класса: на процессы, протекающие в диффузионном режиме, и на процессы, протекающие в кинетическом режиме. Лимитирующая стадия оказывает влияние не только на кинетику процесса травления, но и на окончательный результат. Так, если лимитирующими являются поверхностные процессы, то заметно влияние ориентации поверхности подложки и ее морфологии.
Жидкостное травление полупроводников может рассматриваться как процесс окисления поверхности полупроводника с образованием растворимых в травителе продуктов окисления. Например, при травлении германия перекисью водорода по реакции
 (1)
(1)
возникающая двуокись германия растворяется в воде с образованием метагерманиевой кислоты:
 (2)
(2)
Результирующая реакция окисления германия с образованием жидкофазных продуктов записывается в виде
 (3)
(3)
В тех случаях, когда образующийся окисел нерастворим в воде, например в случае  , появлющегося при травлении кремния в азотной кислоте, в состав травителя наряду с окислителем вводят также растворитель окисла, например фтористоводородную кислоту. Она раст-воряет
, появлющегося при травлении кремния в азотной кислоте, в состав травителя наряду с окислителем вводят также растворитель окисла, например фтористоводородную кислоту. Она раст-воряет  с образованием жидкофазного соединения
с образованием жидкофазного соединения 
 . (4)
. (4)
В результате атомы кремния переходят в водный раствор в форме устойчивых комплексных ионов  , возникающих за счет гидролитической диссоциации соединения по реакции
, возникающих за счет гидролитической диссоциации соединения по реакции  .
.
В этот травитель часто вводят в качестве разбавителя уксусную кислоту. Она замедляет процесс травления, что облегчает контроль процесса и обеспечивает бóльшую однородность.
Для выяснения общих закономерностей кинетики жидкостного травления запишем химическую реакцию (3) в обобщенном виде:
 (5)
(5)
Реакция приведена к одному молю жидкого травителя Х. Схематически процесс травления показан на рис. 1.
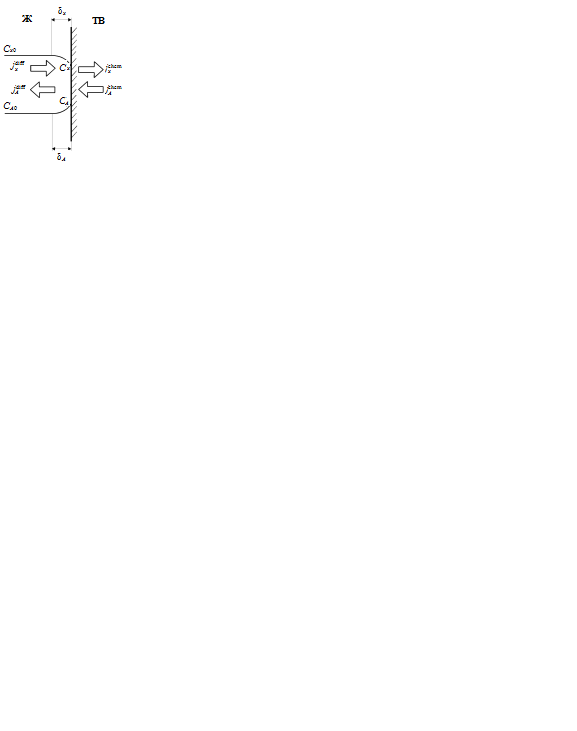
Рис. 1. Распределение в жидкой фазе концентраций
травящего компонента Х и одного из продуктов (А)
химической реакции при травлении твердого вещества s
Будем считать, что процесс травления проходит в три последовательные стадии:
– подвод химического травителя  к поверхности
к поверхности  (диффузионный поток
(диффузионный поток  );
);
– гетерогенная химическая реакция на поверхности  (химические потоки
(химические потоки 


 для всех участников реакции S, X, A, B,...);
для всех участников реакции S, X, A, B,...);
– отвод продуктов реакции 
 ... от поверхности
... от поверхности  (диффузионные потоки
(диффузионные потоки  ,
,  ,...).
,...).
Относительно быстрые сорбционные процессы на поверхности (адсорбция, поверхностная миграция, десорбция) включены во вторую стадию.
Для каждого жидкофазного участника реакции плотность диффузионного потока может быть представлена в виде
 (6)
(6)
где 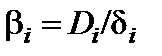 – коэффициент массопереноса i -го компонента в жидкой фазе;
– коэффициент массопереноса i -го компонента в жидкой фазе;  – коэффициент диффузии;
– коэффициент диффузии;  – толщина диффузионного слоя.
– толщина диффузионного слоя.
В стационарном режиме травления диффузионный поток должен быть равен химическому потоку для каждого компонента, тогда

 (7)
(7)

Условие стехиометрии для реакции травления устанавливает следующее соотношение между химическими потоками:
 (8)
(8)
В соответствии с основным законом химической кинетики
 (9)
(9)
где  – константа скорости травления.
– константа скорости травления.
Подстановкой (9) в первое уравнение (7) получаем концентрацию травителя 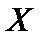 на реакционной поверхности
на реакционной поверхности  :
:
 (10)
(10)
Формулы (8)–(10) дают окончательное выражение для плотности потока травления твердого вещества  :
:
 (11)
(11)
где введена эффективная константа травления  , такая что
, такая что
 (12)
(12)
Чтобы найти скорость травления, определяемую как  (мкм/мин), используем соотношение
(мкм/мин), используем соотношение
 (13)
(13)
где  – число молекул в единице объема твердого вещества
– число молекул в единице объема твердого вещества  .
.
 (14)
(14)
Воспользовавшись аналогией с электрическими цепями, выражение (11) можно представить в виде
 (15)
(15)
Подобно электрическому току, протекающему через сопротивление под действием электродвижущей силы, поток  создается заданной концентрацией травителя
создается заданной концентрацией травителя  в объеме жидкой фазы, которая играет роль «движущей силы» процесса травления. Система оказывает сопротивление протеканию потока
в объеме жидкой фазы, которая играет роль «движущей силы» процесса травления. Система оказывает сопротивление протеканию потока  , складывающееся из диффузионного
, складывающееся из диффузионного  и химического
и химического  сопротивлении. В зависимости от соотношения между этими сопротивлениями различают диффузионную и кинетическую области процесса травления.
сопротивлении. В зависимости от соотношения между этими сопротивлениями различают диффузионную и кинетическую области процесса травления.
Диффузионная область травления реализуется при  или
или  В этом случае из двух последовательных стадий процесса – диффузионного массопереноса и собственно химической реакции – наиболее медленной (лимитирующей) стадией является диффузия. Именно она управляет процессом травления в целом, при этом
В этом случае из двух последовательных стадий процесса – диффузионного массопереноса и собственно химической реакции – наиболее медленной (лимитирующей) стадией является диффузия. Именно она управляет процессом травления в целом, при этом  и
и  . Скорость травления ограничивается скоростью диффузионной доставки молекул травителя
. Скорость травления ограничивается скоростью диффузионной доставки молекул травителя  к реакционной поверхности
к реакционной поверхности  . Поскольку диффузионная константа
. Поскольку диффузионная константа  для жидкой фазы является изотропной, все кристаллографические грани кристалла и дефекты травятся с одинаковой скоростью, что обеспечивает достаточно гладкую зеркально полированную поверхность пластины. Иными словами, в диффузионной области реализуется режим полирующего травления. Увеличение полирующих свойств травителя может быть достигнуто за счет усиления неравенства
для жидкой фазы является изотропной, все кристаллографические грани кристалла и дефекты травятся с одинаковой скоростью, что обеспечивает достаточно гладкую зеркально полированную поверхность пластины. Иными словами, в диффузионной области реализуется режим полирующего травления. Увеличение полирующих свойств травителя может быть достигнуто за счет усиления неравенства  . Следовательно, введение вязких добавок в травящий раствор и понижение температуры должны улучшать полирующее действие травителя за счет снижения коэффициента диффузии
. Следовательно, введение вязких добавок в травящий раствор и понижение температуры должны улучшать полирующее действие травителя за счет снижения коэффициента диффузии  , в то время как интенсивное перемешивание раствора может оказать обратное действие в результате уменьшения эффективной толщины диффузионного слоя
, в то время как интенсивное перемешивание раствора может оказать обратное действие в результате уменьшения эффективной толщины диффузионного слоя  .
.
Кинетическая область травления реализуется при  или
или  . В этом случае из двух стадий процесса наиболее медленной (лимитирующей) стадией является собственно химическая реакция, при этом
. В этом случае из двух стадий процесса наиболее медленной (лимитирующей) стадией является собственно химическая реакция, при этом 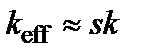 и
и 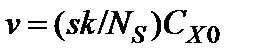 . Процесс травления протекает в кинетической области, так как его скорость ограничивается скоростью химической реакции, а быстрая диффузионная доставка молекул травителя
. Процесс травления протекает в кинетической области, так как его скорость ограничивается скоростью химической реакции, а быстрая диффузионная доставка молекул травителя  обеспечивает практически постоянную их концентрацию на поверхности
обеспечивает практически постоянную их концентрацию на поверхности 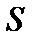 , равную
, равную 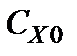 . Так как константа травления
. Так как константа травления  чувствительна к дефектности поверхности и имеет различные значения для разных граней кристалла, для кинетической области протекания процесса характерно селективное и анизотропное травление.
чувствительна к дефектности поверхности и имеет различные значения для разных граней кристалла, для кинетической области протекания процесса характерно селективное и анизотропное травление.
Селективность травления проявляется в преимущественном вытравливании дефектных мест на поверхности в форме ямок травления (например, в районе выходов дислокаций). Здесь активационный барьер для константы  понижен, что увеличивает локальную скорость травления. Анизотропность травления связана с различной скоростью травления разных кристаллографических граней, характеризуемых различными индексами Миллера. Обычно (например, для Si и GaAs) выполняются неравенства
понижен, что увеличивает локальную скорость травления. Анизотропность травления связана с различной скоростью травления разных кристаллографических граней, характеризуемых различными индексами Миллера. Обычно (например, для Si и GaAs) выполняются неравенства 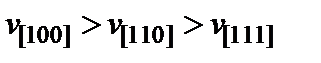 . В результате этого даже на бездефектных поверхностях, ориентированных по плоскостям {100} или {111}, при локальном травлении через специальные окна в защитной маске можно получить профилированные углубления, ограниченные плоскостями, характеризующимися малыми скоростями травления.
. В результате этого даже на бездефектных поверхностях, ориентированных по плоскостям {100} или {111}, при локальном травлении через специальные окна в защитной маске можно получить профилированные углубления, ограниченные плоскостями, характеризующимися малыми скоростями травления.
Порядок выполнения работы
Получить у преподавателя пластины кремния, пинцет, резиновые перчатки. Ознакомиться с рабочим местом: оборудованием, приборами, приспособлениями, инструментом, материалами.
Термическое окисление
Кремниевых пластин
В сухом и влажном кислороде
Цель работы – ознакомиться с технологией и освоить процесс термического окисления кремния в атмосфере «сухого» и «влажного» кислорода.
Окисления кремния
Окисление поверхности кремния принято осуществлять с помощью следующих химических реакций:
 ,
,

при температуре в интервале 900...1200 °C. Окисление может производиться в сухом кислороде по первой реакции, в парах воды – по второй реакции, либо во влажном кислороде – с использованием обеих реакций. Наиболее качественные пленки получаются при окислении в сухом кислороде, тогда как окисление в парах воды обеспечивает наибольшую скорость формирования пленки. Часто применяется комбинированное окисление: сначала в сухом кислороде формируется совершенная граница раздела с минимальной плотностью поверхностных состояний, затем в увлажненном кислороде толщина пленки доводится до требуемого значения. Возможно уплотнение полученной таким образом пленки при окислении на заключительной стадии в сухом кислороде.
Схематически процесс окисления изображен на рис. 2. Собственно окисление происходит на внутренней границе  . В процессе можно выделить три основные стадии, протекающие последовательно.
. В процессе можно выделить три основные стадии, протекающие последовательно.
1. Диффузионный перенос частиц окислителя из объема газовой фазы на внешнюю поверхность  и растворение окислителя в приповерхностном слое диоксида кремния.
и растворение окислителя в приповерхностном слое диоксида кремния.

Рис. 2. Распределение молекул окислителя
в газовой фазе и в растущем слое SiO2
в процессе окисления кремния
2. Диффузионный перенос частиц окислителя через пленку 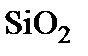
к границе раздела диоксид–кремний.
3. Химическая реакция на границе раздела с кремнием, приводящая к образованию 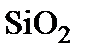 .
.
Введем обозначения:  – поток окислителя, определяемый как количество молекул окислителя, пересекающих единичную площадь одной из границ раздела фаз в единицу времени;
– поток окислителя, определяемый как количество молекул окислителя, пересекающих единичную площадь одной из границ раздела фаз в единицу времени;  – концентрация молекул окислителя на одной из границ раздела системы
– концентрация молекул окислителя на одной из границ раздела системы 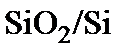 ,
,  – толщина слоя диоксида. Трем стадиям процесса окисления соответствуют потоки
– толщина слоя диоксида. Трем стадиям процесса окисления соответствуют потоки  , которые в стационарных условиях должны быть равными
, которые в стационарных условиях должны быть равными

В промышленных условиях для процесса термического окисления кремния используется принудительный поток окислителя, проходящий через рабочую камеру с определенной скоростью. Внутри газовой фазы концентрация молекул окислителя соответствует парциальному давлению  В процессе роста
В процессе роста 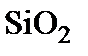 происходит непрерывное растворение молекул окислителя в окисле, сопровождающееся обеднением приповерхностной области газа этими молекулами. По этой причине концентрация молекул окислителя на границе раздела фаз при
происходит непрерывное растворение молекул окислителя в окисле, сопровождающееся обеднением приповерхностной области газа этими молекулами. По этой причине концентрация молекул окислителя на границе раздела фаз при  всегда меньше, чем в объеме газовой фазы. В приповерхностном диффузионном слое толщиной
всегда меньше, чем в объеме газовой фазы. В приповерхностном диффузионном слое толщиной  возникает градиент концентрации молекул окислителя, который создает диффузионный поток окислителя по направлению к границе, определяемый выражением
возникает градиент концентрации молекул окислителя, который создает диффузионный поток окислителя по направлению к границе, определяемый выражением 
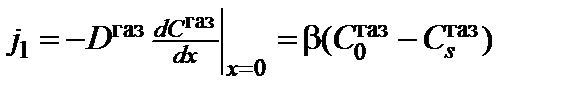 ,
,
где  – константа скорости газообразного массопереноса окислителя;
– константа скорости газообразного массопереноса окислителя;  – коэффициент диффузии окислителя в газовой фазе;
– коэффициент диффузии окислителя в газовой фазе;  и
и  – равновесная концентрация окислителя в объеме газовой фазы и концентрация окислителя в газовой фазе у поверхности оксида соответственно. В случае ламинарного потока окислителя можно принять, что
– равновесная концентрация окислителя в объеме газовой фазы и концентрация окислителя в газовой фазе у поверхности оксида соответственно. В случае ламинарного потока окислителя можно принять, что 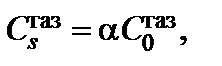 где
где  . Окислитель, адсорбированный поверхностью оксида, растворяется в
. Окислитель, адсорбированный поверхностью оксида, растворяется в  . Соотношение между концентрациями окислителя в газовой
. Соотношение между концентрациями окислителя в газовой  и твердой
и твердой  фазах устанавливается коэффициентом распределения. Движущей силой процесса растворения является градиент концентраций, поэтому может быть введен соответствующий ему поток растворителя
фазах устанавливается коэффициентом распределения. Движущей силой процесса растворения является градиент концентраций, поэтому может быть введен соответствующий ему поток растворителя

равный  , однако, поскольку процесс растворения не был выделен в отдельную стадию, а включен в первую, необходимо поток
, однако, поскольку процесс растворения не был выделен в отдельную стадию, а включен в первую, необходимо поток  выразить через
выразить через  . Процесс растворения подчиняется закону Генри. Поэтому
. Процесс растворения подчиняется закону Генри. Поэтому

где  – коэффициент растворимости молекул окислителя в диоксиде кремния;
– коэффициент растворимости молекул окислителя в диоксиде кремния;  – парциальное давление окислителя при
– парциальное давление окислителя при 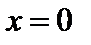 . Очевидно, что должно быть верным и уравнение
. Очевидно, что должно быть верным и уравнение

Введенная формально величина  определяет концентрацию растворенных в
определяет концентрацию растворенных в  молекул окислителя, если в законе Генри вместо давления
молекул окислителя, если в законе Генри вместо давления  подставить
подставить  . Тогда
. Тогда
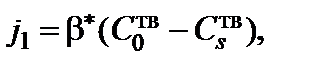
где  – коэффициент массопереноса молекул окис-лителя в газовой фазе, приведенный к твердой фазе.
– коэффициент массопереноса молекул окис-лителя в газовой фазе, приведенный к твердой фазе.
В стационарном режиме производная по времени в диффузионном уравнении равна нулю. Следовательно, и  . Тогда концентрация окислителя линейно зависит от
. Тогда концентрация окислителя линейно зависит от  . Диффузионный поток окислителя от поверхности диоксида к границе раздела диоксид–кремний
. Диффузионный поток окислителя от поверхности диоксида к границе раздела диоксид–кремний
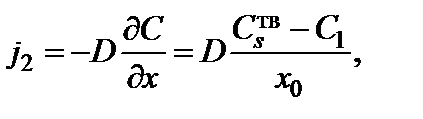
где  – концентрация молекул окислителя на границе раздела диоксид–кремний;
– концентрация молекул окислителя на границе раздела диоксид–кремний; 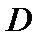 – коэффициент диффузии окислителя в
– коэффициент диффузии окислителя в  .
.
Химический поток  следует понимать как убыль молекул окислителя вследствие их превращения в молекулы
следует понимать как убыль молекул окислителя вследствие их превращения в молекулы  . Скорость реакции окисления пропорциональна концентрации окислителя, поэтому
. Скорость реакции окисления пропорциональна концентрации окислителя, поэтому

где  – константа скорости реакции окисления.
– константа скорости реакции окисления.
В стационарном режиме окисления концентрации не зависят от времени и все потоки равны  :
:
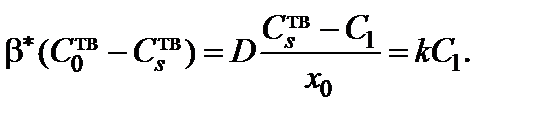
Решение этой системы относительно неизвестных 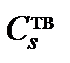 и
и 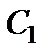 дает
дает
 ,
,

Скорость роста слоя  определяется величиной химического потока
определяется величиной химического потока  . За время
. За время 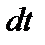 на единицу площади поверхности кремния посту-пает количество молекул окислителя, равное
на единицу площади поверхности кремния посту-пает количество молекул окислителя, равное  В результате этого толщина слоя
В результате этого толщина слоя  увеличивается на величину, поэтому
увеличивается на величину, поэтому
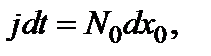
где  – число молекул окислителя, необходимое для формирования единицы объема
– число молекул окислителя, необходимое для формирования единицы объема  . В единице объема диоксида кремния содержится
. В единице объема диоксида кремния содержится  молекул
молекул  , где
, где  г/см
г/см  – массовая плотность
– массовая плотность 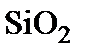 ,
,  г/моль – молярная масса
г/моль – молярная масса  ,
,  моль
моль  – число Авогадро. Приведенные значения дают
– число Авогадро. Приведенные значения дают 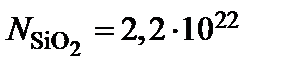 см
см  , тогда
, тогда  см
см  для окисления в сухом кислороде и
для окисления в сухом кислороде и  см
см  для окисления в парах воды.
для окисления в парах воды.
Дифференциальное уравнение для нахождения 

После разделения переменных и интегрирования с граничным условием  получаем
получаем

где  и
и  .
.
Это уравнение имеет единственный неотрицательный корень

Проведем анализ данного решения для двух частных случаев.
1. Начальная стадия роста, когда  а
а  Воспользуемся соотношением
Воспользуемся соотношением  при
при  . Тогда
. Тогда

Этой стадии соответствует линейный по времени закон роста.
 .
.
Обычно 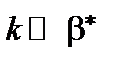 . Это означает, что лимитирующей стадией, ограничивающей скорость роста диоксида, является химическая реакция, и процесс окисления протекает в кинетической области. В этом случае константа линейного роста
. Это означает, что лимитирующей стадией, ограничивающей скорость роста диоксида, является химическая реакция, и процесс окисления протекает в кинетической области. В этом случае константа линейного роста  пропорциональна парциальному давлению
пропорциональна парциальному давлению  окислителя в газовой фазе, коэффициенту растворимости
окислителя в газовой фазе, коэффициенту растворимости  молекул окислителя в диоксиде кремния и не зависит от коэффициента диффузии
молекул окислителя в диоксиде кремния и не зависит от коэффициента диффузии  :
:

Таким образом,

Отметим, что скорость роста линейно возрастает с увеличением давления окислителя. С увеличением температуры молекулярная растворимость газов, как правило, падает по экспоненциальному закону, однако этот спад компенсируется увеличением константы скорости реакции  и константа скорости линейного роста
и константа скорости линейного роста  с ростом температуры всегда увеличивается.
с ростом температуры всегда увеличивается.
На поверхности кремния всегда присутствует естественный окисел толщиной  3...5 нм. Для учета этого окисла необходимо изменить граничное условие
3...5 нм. Для учета этого окисла необходимо изменить граничное условие 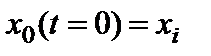 . В этом случае решение дифференциального уравнения для начальной стадии роста имеет вид
. В этом случае решение дифференциального уравнения для начальной стадии роста имеет вид  , где
, где 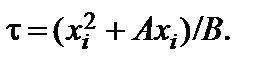 Влияние этого параметра заметно только в начальный момент окисления.
Влияние этого параметра заметно только в начальный момент окисления.
2. Конечная стадия роста, когда  а
а 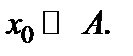 В этом случае
В этом случае

где  – коэффициент проницаемости диоксида кремния молекулами окислителя;
– коэффициент проницаемости диоксида кремния молекулами окислителя;  – коэффициент растворимости молекул окислителя в диоксиде кремния;
– коэффициент растворимости молекул окислителя в диоксиде кремния;  – коэффициент диффузии окислителя в
– коэффициент диффузии окислителя в  . Поскольку
. Поскольку
 ,
,
рост на данной стадии называется параболическим.


| Рис. 3. Зависимость толщины
пленки диоксидаот времени
|
Температурная зависимость
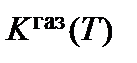
определяет влияние температуры на процесс параболического роста

. Как и
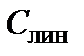
, с ростом температуры

всегда увеличивается. Константа параболического роста не включает константу скорости химической реакции, поэтому процесс роста на конечной стадии протекает в диффузионной области. Лимитирующей стадией является процесс массопереноса через слой

. С увеличением парциального давления

константа

возрастает как

.
Зависимость толщины пленки диоксида от времени представлена графически на рис. 3. Область I соответствует кинетическому режиму окисления, область II – диффузионному, область III – диффузионно-кинетическому. В последнем случае скорости диффузионного массопереноса и химической реакции сравнимы.
Порядок выполнения работы
1. Получить у преподавателя необходимые приборы и инструменты. Диффузионная печь заранее подготовлена к проведению лабораторной работы преподавателем или лаборантом. Запрещается включать и выключать оборудование, изменять режим работы диффузионной печи, регулировать газовые потоки. Студенты выполняют только операции, указанные в настоящем перечне.
2. Произвести измерение температур в каналах диффузионной печи. Убедиться, что разность температур составляет не более 5 °C. Для проведения измерений извлечь термопару из контейнера, подключить к клеммам милливольтметра и поместить поочередно в каждый канал. Считывание показаний милливольтметра производить после установления стационарного состояния (через 3...5 мин). После проведения измерений термопару немедленно поместить обратно в контейнер.
Соблюдайте осторожность. Температура кварцевого чехла термопары близка к 1000 °C. По калибровочной таблице термопары определить температуры в каналах.
3. Пинцетом поместить кремниевые пластины вертикально в кварцевые лодочки по 4 шт. в каждую. Одну лодочку поместить в канал окисления в сухом, другую – в канал окисления во влажном кислороде. Кварцевой штангой медленно (3 мин) переместить лодочки в центральные области каналов. Штангу убрать в контейнер. Запустить таймер.
4. Через 20 мин кварцевой штангой переместить лодочки из центральной части каналов к краям. Убрать штангу в контейнер. Пинцетом снять по одной пластине с каждой лодочки и поместить в металлические контейнеры, так как пластины горячие. Кварцевой штангой переместить лодочки в центральную область каналов. Убрать штангу в контейнер.
5. Повторить п. 4 еще три раза.
6. Определить толщину пленок диоксида кремния. Для этого химическим травлением сформировать в слоях диоксида ступеньки с клиновидным профилем: нанести фторопластовой палочкой каплю концентрированной плавиковой кислоты на край окисленной пластины кремния. Кислота смачивает поверхность оксида и не смачивает поверхность кремния. В момент изменения типа смачивания смыть кислоту водой. Высушить пластины бумажными фильтрами. Толщину определять по цвету оксида при нормальном падении света, пользуясь таблицей, приведенной ниже и учитывая порядок интерференции, определяемый по числу повторений темного фиолетово-красного цвета на вытравленном клине.
7. Построить графики зависимости толщины пленки диоксида кремния от времени при окислении в сухом и влажном кислороде.
Материалы
1. Полированные пластины кремния n-типа с удельным сопротивлением 0,50... 4,5 Ом×см, разрезанные на 4 части. Перед проведением работы пластины должны быть обезжирены кипячением в толуоле в течение 5 мин и подвергнуты химической обработке, включающей кипячение в концентрированной азотной кислоте, промывку в дистиллированной воде, обработку плавиковой кислотой (20 мин) для удаления оксида и финишную промывку дистиллированной водой.
2. Кислота плавиковая концентрированная.
Определение толщины пленок методом цветовых оттенков
| d, мкм
| Порядок интерференции
| Цвет последней полосы
|
| 0,050
|
| Бежевый
|
| 0,0700
|
| Коричневый
|
| 0,0960
|
| Темно-коричнево-красный
|
| 0,1020
|
| Индиго
|
| 0,1433
|
| Голубовато-серый
|
| 0,1500
|
| Светло-голубой
|
| 0,1688
|
| Зелено-голубой
|
| 0,1700
|
| Металлический
|
| 0,1786
|
| Бледно-зеленый
|
| 0,1836
| I
| Желто-зеленый
|
| 0,1883
|
| Светло-зеленый
|
| 0,1916
|
| Зелено-желтый
|
| 0,1963
|
| Золотисто-желтый
|
| 0,2000
|
| Светло-золотистый
|
| 0,2200
|
| Золотистый
|
| 0,2216
|
| Оранжевый
|
| 0,2490
|
| Светло-красный
|
| 0,2500
|
| Красный
|
| 0,2700
|
| Красно-фиолетовый
|
| 0,2753
|
| Пурпурный
|
| 0,2810
|
| Пурпурно-
|
| 0,2886
|
| фиолетовый
|
| 0,3000
|
| Фиолетовый
|
| 0,3033
|
| Фиолетово-голубой
|
| 0,3100
|
| Индиго
|
| 0,3160
|
| Голубой
|
| 0,3200
| II
| Темно-голубой
|
| 0,3400
|
| Зелено-голубой
|
| 0,3500
|
| Светло-зеленый
|
| 0,3760
|
| Зеленый
|
| 0,3830
|
| Желтовато-зеленый
|
Окончание таблицы
| d, мкм
| Порядок интерференции
| Цвет последней полосы
|
| 0,3900
|
| Грязно-зеленый
|
| 0,4100
|
| Желтый
|
| 0,4193
|
| Светло-оранжевый
|
| 0,4200
|
| Телесный
|
| 0,4400
|
| Красный
|
| 0,4476
|
| Фиолетово-красный
|
| 0,4586
|
| Фиолетовый
|
| 0,4600
|
| Красно-фиолетовый
|
| 0,4757
|
| Голубовато-фиолетово-серый
|
| 0,4800
|
| Голубовато-фиолетовый
|
| 0,4900
|
| Голубой
|
| 0,4983
|
| Зелено-голубой
|
| 0,5000
|
| Голубовато-зеленый
|
| 0,5200
|
| Зеленый
|
| 0,5403
|
| Тускло-зеленый
|
| 0,5526
| III
| Желто-зеленый
|
| 0,5606
|
| Зелено-желтый
|
| 0,5703
|
| Желто-серый
|
| 0,5800
|
| Светло оранжевый
|
| 0,5813
|
| Сиреневато-серовато-красный
|
| 0,6000
|
| Темно-розовый
|
| 0,6088
|
| Карминово-красный
|
| 0,6300
|
| Фиолетово-красный
|
| 0,6423
|
| Серовато-красный
|
| 0,6690
|
| Голубовато-серый
|
| 0,6800
|
| Голубоватый
|
| 0,6826
|
| Голубовато-зеленый
|
| 0,7200
| IV
| Зеленый
|
| 0,7700
|
| Желтоватый
|
| 0,7793
|
| Бледно-розовый
|
| 0,8000
|
| Оранжевый
|
| 0,8200
|
| Желтовато-розовый
|
| 0,8500
|
| Светло-красновато-фиолетовый
|
| 0,8600
|
| Фиолетовый
|
| 0,8700
| V
| Голубовато-фиолетовый
|
| 0,8893
|
| Бледно-зелено-голубоватый
|
| 0,8900
|
| Голубой
|
| 0,9200
|
| Голубовато-зеленый
|
| 0,9500
|
| Желто-зеленый
|
| 0,9700
|
| Желтый
|
Контрольные вопросы
1. Какие методы применяются для получения пленок 
|
|
|



 (1)
(1) (2)
(2) (3)
(3) , появлющегося при травлении кремния в азотной кислоте, в состав травителя наряду с окислителем вводят также растворитель окисла, например фтористоводородную кислоту. Она раст-воряет
, появлющегося при травлении кремния в азотной кислоте, в состав травителя наряду с окислителем вводят также растворитель окисла, например фтористоводородную кислоту. Она раст-воряет  с образованием жидкофазного соединения
с образованием жидкофазного соединения 
 . (4)
. (4) , возникающих за счет гидролитической диссоциации соединения по реакции
, возникающих за счет гидролитической диссоциации соединения по реакции  .
.  (5)
(5)
 к поверхности
к поверхности  (диффузионный поток
(диффузионный поток  );
); (химические потоки
(химические потоки 


 для всех участников реакции S, X, A, B,...);
для всех участников реакции S, X, A, B,...);
 ... от поверхности
... от поверхности 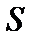 (диффузионные потоки
(диффузионные потоки  ,
,  ,...).
,...). (6)
(6)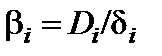 – коэффициент массопереноса i -го компонента в жидкой фазе;
– коэффициент массопереноса i -го компонента в жидкой фазе;  – коэффициент диффузии;
– коэффициент диффузии;  – толщина диффузионного слоя.
– толщина диффузионного слоя.
 (7)
(7)
 (8)
(8) (9)
(9) – константа скорости травления.
– константа скорости травления.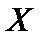 на реакционной поверхности
на реакционной поверхности  :
: (10)
(10) :
: (11)
(11) , такая что
, такая что (12)
(12) (мкм/мин), используем соотношение
(мкм/мин), используем соотношение (13)
(13) – число молекул в единице объема твердого вещества
– число молекул в единице объема твердого вещества  .
. (14)
(14) (15)
(15) создается заданной концентрацией травителя
создается заданной концентрацией травителя  в объеме жидкой фазы, которая играет роль «движущей силы» процесса травления. Система оказывает сопротивление протеканию потока
в объеме жидкой фазы, которая играет роль «движущей силы» процесса травления. Система оказывает сопротивление протеканию потока  , складывающееся из диффузионного
, складывающееся из диффузионного  и химического
и химического  сопротивлении. В зависимости от соотношения между этими сопротивлениями различают диффузионную и кинетическую области процесса травления.
сопротивлении. В зависимости от соотношения между этими сопротивлениями различают диффузионную и кинетическую области процесса травления. или
или  В этом случае из двух последовательных стадий процесса – диффузионного массопереноса и собственно химической реакции – наиболее медленной (лимитирующей) стадией является диффузия. Именно она управляет процессом травления в целом, при этом
В этом случае из двух последовательных стадий процесса – диффузионного массопереноса и собственно химической реакции – наиболее медленной (лимитирующей) стадией является диффузия. Именно она управляет процессом травления в целом, при этом  и
и  . Скорость травления ограничивается скоростью диффузионной доставки молекул травителя
. Скорость травления ограничивается скоростью диффузионной доставки молекул травителя  к реакционной поверхности
к реакционной поверхности  . Поскольку диффузионная константа
. Поскольку диффузионная константа  для жидкой фазы является изотропной, все кристаллографические грани кристалла и дефекты травятся с одинаковой скоростью, что обеспечивает достаточно гладкую зеркально полированную поверхность пластины. Иными словами, в диффузионной области реализуется режим полирующего травления. Увеличение полирующих свойств травителя может быть достигнуто за счет усиления неравенства
для жидкой фазы является изотропной, все кристаллографические грани кристалла и дефекты травятся с одинаковой скоростью, что обеспечивает достаточно гладкую зеркально полированную поверхность пластины. Иными словами, в диффузионной области реализуется режим полирующего травления. Увеличение полирующих свойств травителя может быть достигнуто за счет усиления неравенства  . Следовательно, введение вязких добавок в травящий раствор и понижение температуры должны улучшать полирующее действие травителя за счет снижения коэффициента диффузии
. Следовательно, введение вязких добавок в травящий раствор и понижение температуры должны улучшать полирующее действие травителя за счет снижения коэффициента диффузии  , в то время как интенсивное перемешивание раствора может оказать обратное действие в результате уменьшения эффективной толщины диффузионного слоя
, в то время как интенсивное перемешивание раствора может оказать обратное действие в результате уменьшения эффективной толщины диффузионного слоя  .
. или
или  . В этом случае из двух стадий процесса наиболее медленной (лимитирующей) стадией является собственно химическая реакция, при этом
. В этом случае из двух стадий процесса наиболее медленной (лимитирующей) стадией является собственно химическая реакция, при этом 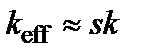 и
и 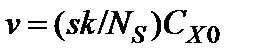 . Процесс травления протекает в кинетической области, так как его скорость ограничивается скоростью химической реакции, а быстрая диффузионная доставка молекул травителя
. Процесс травления протекает в кинетической области, так как его скорость ограничивается скоростью химической реакции, а быстрая диффузионная доставка молекул травителя  обеспечивает практически постоянную их концентрацию на поверхности
обеспечивает практически постоянную их концентрацию на поверхности 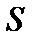 , равную
, равную 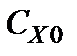 . Так как константа травления
. Так как константа травления  чувствительна к дефектности поверхности и имеет различные значения для разных граней кристалла, для кинетической области протекания процесса характерно селективное и анизотропное травление.
чувствительна к дефектности поверхности и имеет различные значения для разных граней кристалла, для кинетической области протекания процесса характерно селективное и анизотропное травление. понижен, что увеличивает локальную скорость травления. Анизотропность травления связана с различной скоростью травления разных кристаллографических граней, характеризуемых различными индексами Миллера. Обычно (например, для Si и GaAs) выполняются неравенства
понижен, что увеличивает локальную скорость травления. Анизотропность травления связана с различной скоростью травления разных кристаллографических граней, характеризуемых различными индексами Миллера. Обычно (например, для Si и GaAs) выполняются неравенства 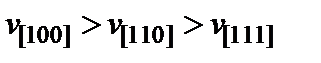 . В результате этого даже на бездефектных поверхностях, ориентированных по плоскостям {100} или {111}, при локальном травлении через специальные окна в защитной маске можно получить профилированные углубления, ограниченные плоскостями, характеризующимися малыми скоростями травления.
. В результате этого даже на бездефектных поверхностях, ориентированных по плоскостям {100} или {111}, при локальном травлении через специальные окна в защитной маске можно получить профилированные углубления, ограниченные плоскостями, характеризующимися малыми скоростями травления. ,
,
 . В процессе можно выделить три основные стадии, протекающие последовательно.
. В процессе можно выделить три основные стадии, протекающие последовательно. и растворение окислителя в приповерхностном слое диоксида кремния.
и растворение окислителя в приповерхностном слое диоксида кремния.
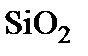
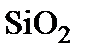 .
. – поток окислителя, определяемый как количество молекул окислителя, пересекающих единичную площадь одной из границ раздела фаз в единицу времени;
– поток окислителя, определяемый как количество молекул окислителя, пересекающих единичную площадь одной из границ раздела фаз в единицу времени;  – концентрация молекул окислителя на одной из границ раздела системы
– концентрация молекул окислителя на одной из границ раздела системы 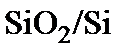 ,
,  – толщина слоя диоксида. Трем стадиям процесса окисления соответствуют потоки
– толщина слоя диоксида. Трем стадиям процесса окисления соответствуют потоки  , которые в стационарных условиях должны быть равными
, которые в стационарных условиях должны быть равными
 В процессе роста
В процессе роста 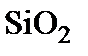 происходит непрерывное растворение молекул окислителя в окисле, сопровождающееся обеднением приповерхностной области газа этими молекулами. По этой причине концентрация молекул окислителя на границе раздела фаз при
происходит непрерывное растворение молекул окислителя в окисле, сопровождающееся обеднением приповерхностной области газа этими молекулами. По этой причине концентрация молекул окислителя на границе раздела фаз при  всегда меньше, чем в объеме газовой фазы. В приповерхностном диффузионном слое толщиной
всегда меньше, чем в объеме газовой фазы. В приповерхностном диффузионном слое толщиной  возникает градиент концентрации молекул окислителя, который создает диффузионный поток окислителя по направлению к границе, определяемый выражением
возникает градиент концентрации молекул окислителя, который создает диффузионный поток окислителя по направлению к границе, определяемый выражением 
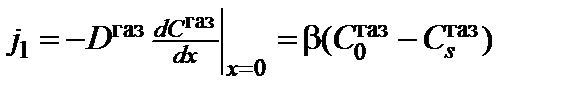 ,
, – константа скорости газообразного массопереноса окислителя;
– константа скорости газообразного массопереноса окислителя;  – коэффициент диффузии окислителя в газовой фазе;
– коэффициент диффузии окислителя в газовой фазе;  и
и  – равновесная концентрация окислителя в объеме газовой фазы и концентрация окислителя в газовой фазе у поверхности оксида соответственно. В случае ламинарного потока окислителя можно принять, что
– равновесная концентрация окислителя в объеме газовой фазы и концентрация окислителя в газовой фазе у поверхности оксида соответственно. В случае ламинарного потока окислителя можно принять, что 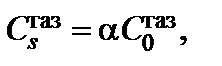 где
где  . Окислитель, адсорбированный поверхностью оксида, растворяется в
. Окислитель, адсорбированный поверхностью оксида, растворяется в  . Соотношение между концентрациями окислителя в газовой
. Соотношение между концентрациями окислителя в газовой  и твердой
и твердой  фазах устанавливается коэффициентом распределения. Движущей силой процесса растворения является градиент концентраций, поэтому может быть введен соответствующий ему поток растворителя
фазах устанавливается коэффициентом распределения. Движущей силой процесса растворения является градиент концентраций, поэтому может быть введен соответствующий ему поток растворителя
 , однако, поскольку процесс растворения не был выделен в отдельную стадию, а включен в первую, необходимо поток
, однако, поскольку процесс растворения не был выделен в отдельную стадию, а включен в первую, необходимо поток  выразить через
выразить через  . Процесс растворения подчиняется закону Генри. Поэтому
. Процесс растворения подчиняется закону Генри. Поэтому
 – коэффициент растворимости молекул окислителя в диоксиде кремния;
– коэффициент растворимости молекул окислителя в диоксиде кремния;  – парциальное давление окислителя при
– парциальное давление окислителя при 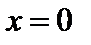 . Очевидно, что должно быть верным и уравнение
. Очевидно, что должно быть верным и уравнение
 определяет концентрацию растворенных в
определяет концентрацию растворенных в  молекул окислителя, если в законе Генри вместо давления
молекул окислителя, если в законе Генри вместо давления  подставить
подставить  . Тогда
. Тогда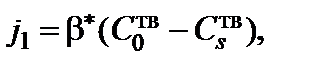
 – коэффициент массопереноса молекул окис-лителя в газовой фазе, приведенный к твердой фазе.
– коэффициент массопереноса молекул окис-лителя в газовой фазе, приведенный к твердой фазе. . Тогда концентрация окислителя линейно зависит от
. Тогда концентрация окислителя линейно зависит от  . Диффузионный поток окислителя от поверхности диоксида к границе раздела диоксид–кремний
. Диффузионный поток окислителя от поверхности диоксида к границе раздела диоксид–кремний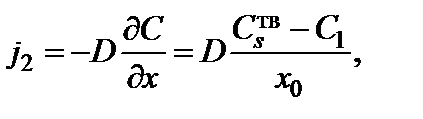
 – концентрация молекул окислителя на границе раздела диоксид–кремний;
– концентрация молекул окислителя на границе раздела диоксид–кремний; 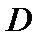 – коэффициент диффузии окислителя в
– коэффициент диффузии окислителя в  .
. следует понимать как убыль молекул окислителя вследствие их превращения в молекулы
следует понимать как убыль молекул окислителя вследствие их превращения в молекулы 
 – константа скорости реакции окисления.
– константа скорости реакции окисления. :
: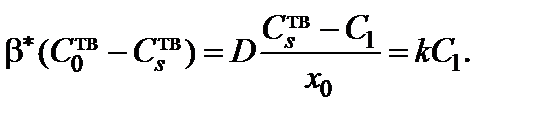
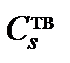 и
и 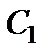 дает
дает ,
,
 . За время
. За время 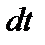 на единицу площади поверхности кремния посту-пает количество молекул окислителя, равное
на единицу площади поверхности кремния посту-пает количество молекул окислителя, равное  В результате этого толщина слоя
В результате этого толщина слоя 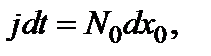
 – число молекул окислителя, необходимое для формирования единицы объема
– число молекул окислителя, необходимое для формирования единицы объема  молекул
молекул  г/см
г/см  – массовая плотность
– массовая плотность  ,
,  г/моль – молярная масса
г/моль – молярная масса  моль
моль  – число Авогадро. Приведенные значения дают
– число Авогадро. Приведенные значения дают 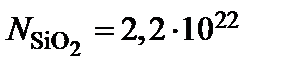 см
см  , тогда
, тогда  см
см  для окисления в сухом кислороде и
для окисления в сухом кислороде и  см
см  для окисления в парах воды.
для окисления в парах воды.

 получаем
получаем
 и
и  .
.
 а
а  Воспользуемся соотношением
Воспользуемся соотношением  при
при  . Тогда
. Тогда
 .
.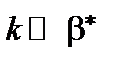 . Это означает, что лимитирующей стадией, ограничивающей скорость роста диоксида, является химическая реакция, и процесс окисления протекает в кинетической области. В этом случае константа линейного роста
. Это означает, что лимитирующей стадией, ограничивающей скорость роста диоксида, является химическая реакция, и процесс окисления протекает в кинетической области. В этом случае константа линейного роста  пропорциональна парциальному давлению
пропорциональна парциальному давлению  окислителя в газовой фазе, коэффициенту растворимости
окислителя в газовой фазе, коэффициенту растворимости  молекул окислителя в диоксиде кремния и не зависит от коэффициента диффузии
молекул окислителя в диоксиде кремния и не зависит от коэффициента диффузии  :
:

 и константа скорости линейного роста
и константа скорости линейного роста  с ростом температуры всегда увеличивается.
с ростом температуры всегда увеличивается. 3...5 нм. Для учета этого окисла необходимо изменить граничное условие
3...5 нм. Для учета этого окисла необходимо изменить граничное условие 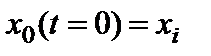 . В этом случае решение дифференциального уравнения для начальной стадии роста имеет вид
. В этом случае решение дифференциального уравнения для начальной стадии роста имеет вид  , где
, где 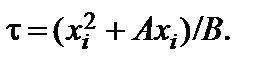 Влияние этого параметра заметно только в начальный момент окисления.
Влияние этого параметра заметно только в начальный момент окисления. а
а 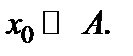 В этом случае
В этом случае
 – коэффициент проницаемости диоксида кремния молекулами окислителя;
– коэффициент проницаемости диоксида кремния молекулами окислителя;  – коэффициент растворимости молекул окислителя в диоксиде кремния;
– коэффициент растворимости молекул окислителя в диоксиде кремния;  – коэффициент диффузии окислителя в
– коэффициент диффузии окислителя в  . Поскольку
. Поскольку ,
,

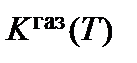 определяет влияние температуры на процесс параболического роста
определяет влияние температуры на процесс параболического роста  . Как и
. Как и 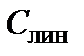 , с ростом температуры
, с ростом температуры  всегда увеличивается. Константа параболического роста не включает константу скорости химической реакции, поэтому процесс роста на конечной стадии протекает в диффузионной области. Лимитирующей стадией является процесс массопереноса через слой
всегда увеличивается. Константа параболического роста не включает константу скорости химической реакции, поэтому процесс роста на конечной стадии протекает в диффузионной области. Лимитирующей стадией является процесс массопереноса через слой  . С увеличением парциального давления
. С увеличением парциального давления  константа
константа  возрастает как
возрастает как  .
.



