Белками называются высокомолекулярные природные полимеры, молекулы которых построены из остатков аминокислот, число которых сильно колеблется и достигает нескольких тысяч. Каждый белок обладает своей присущей ему, последовательностью расположения остатков аминокислот.
В молекуле аминокислоты содержится несколько функциональных групп: аминогруппа - NH2, карбоксильная - COOH и радикалы - R, имеющие различное строение.
 COOH
COOH
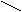 R-CH
R-CH
NH2
В построении белков участвуют α - аминокислоты, в молекуле которых аминогруппа расположена у соседнего с карбоксильной группой атома углерода. Среди природных аминокислот (их около 150) выделяют 20 протеиногенных, которые входят в состав белков. В молекуле белка α - аминокислоты связаны между собой пептидными связями.






















 -N-CH-C-N-CH-C-N-CH-C-
-N-CH-C-N-CH-C-N-CH-C-
H R O H R1 O H R2 O



Последовательность соединения аминокислотных остатков в полипептидной цепи получила название первичной структуры белка. Учитывая число возможных аминокислотных комбинаций, разнообразие белков практически безгранично, но не все они встречаются в природе. Общее число белков различных типов у всех видов живых организмов составляет порядка 1010 - 1012
Для белков кроме первичной структуры различают и более высокие уровни организации - вторичную, третичную и четвертичную структуры.
Пептидные цепи за счет водородных связей между пептидными группами аминокислотных остатков -S-S- связей приобретают спиралевидную форму (α - структура) - вторичная структура белковой молекулы, α - структурой обладает большая часть белков.
Водородные связи могут обеспечивать и соединение соседних полипептидных цепочек с образованием вторичной структуры другого типа - складчатой β - структуры.
Полипептидные цепочки с определенной вторичной структурой могут быть по- разному расположены в пространстве - это пространственное расположение получило название третичной структуры. В образовании третичной структуры кроме водородных связей большую роль играет ионное и гидрофобное взаимодействие. По характеру «упаковки» белковой молекулы различают глобулярные или шаровидные и фибриллярные или нитевидные белки.
В ряде случаев отдельные субъединицы белка с помощью водородных связей, электростатического взаимодействия, сил Вандер - Ваальса образуют сложные ансамбли. Образуется четвертичная структура белка.
Классификация. Существует несколько классификаций белков. По степени сложности белки делят на простые (протеины), состоящие только из остатков аминокислот и протеиды - сложные белки - состоящие из белковой и небелковой групп.
Протеины по растворимости в отдельных растворителях классифицируются на:
а) альбумины - белки растворимые в воде – белок яйца, - овальбумин;
б) глобулины - растворяются в водных растворах солей (10 %)-
лактоглобулин молока, фазеолин фасоли;
в) проламины - растворяются в 60-80 % растворе этилового спирта - глиадин ржи и пшеницы, зеин кукурузы;
г) глютелины - растворяются только в растворах щелочей - глютенин пшеницы, оризенин риса.
Протеиды - подразделяются на:
- нуклеопротеиды - в качестве простетической группы содержат нуклеиновые кислоты - содержатся в клеточных ядрах;
- фосфопротеиды - присутствует остаток фосфорной кислоты - казеин молока;
- липопротеиды - содержат кроме белка липиды - встречаются в протоплазме и в мембранах клеток;
- гликопротеиды - роль простетической группы играет углевод - запасной белок семян фасоли вицилин;
- хромопротеиды - простетическая группа Гем - азотистое основание, содержащее железо - гемоглобин крови.
Кроме того, существует классификация белков в соответствии с
выполняемыми ими биологическими функциями:
1) ферменты – белки, обладающие каталитической активностью;
2) транспортные - белки плазмы крови связывают и переносят специфические молекулы или ионы из одного органа в другой (гемоглобин - кислород, липопротеиды - липиды из печени в другие органы);
3) пищевые и запасные - откладываются в семенах растений, потребляются на первых стадиях развития зародыша (глиадин пшеницы);
4)сократительные и двигательные - наделяют клетку или организм способностью сокращаться, изменять форму или передвигаться (миозин в сократительной системе скелетной мышцы);
5)структурные - выполняют опорную функцию, скрепляя биологические структуры и придавая им прочность (кератин - белок, из которого состоят волосы, ногти, перья);
6)защитные - защищают организм от вторжения других организмов или предохраняют его от повреждений (иммуноглобулины распознают проникшие в организм бактерии, вирусы или чужеродные белки и нейтрализуют их);
7)регуляторные - участвуют в системе регуляции клеточной или физиологической активности (гормон инсулин);
8)имеется много других белков, функции которых довольно необычны, что затрудняет их классификацию (белки со свойствами антифриза - предохраняющие кровь рыб от замерзания в ледяной воде).
Технологи имеют дело с ферментами, запасными белками и регуляторными, как ингибиторами ферментов.
Белки как компоненты пищи
Значение белков определяется не только многообразием их функций, но и их незаменимостью другими пищевыми веществами.
Первичный синтез полного набора протеиногенных аминокислот, необходимых для синтеза белков, осуществляется только в растениях. Для этого растения используют диоксид углерода, воду и нитраты в качестве источника азота. В организме животных и человека, первичный синтез аминокислот осуществляться не может. Для синтеза своих специфических белков животные и человек должны получать готовые аминокислоты в соотношениях, соответствующих аминокислотному составу их белков. Поэтому белки являются обязательным и незаменимым компонентом пищевого рациона.
Если белок не содержит в достаточном количестве хотя бы одной незаменимой аминокислоты, то такой белок считается неполноценным в питательном отношении, т.к. он не может обеспечить нормальный белковый обмен нашего организма.
В организме человека под влиянием ферментов протеиназ и пептидаз белки пищи в основном расщепляются до свободных аминокислот:
протеиназа пептидаза
белок-------------- пептиды -------------- аминокислоты
Аминокислоты всасываются в кровь, разносятся ко всем органам и расходуются на обновление белков организма. В организме человека каждые 150 дней происходит замена белков мышечной ткани, через каждые 10 дней - замена белков печени и крови.
Постоянный обмен и обновление осуществляется между тканевыми белками и фондом свободных аминокислот, образующихся в процессе переваривания пищи и поступающих в кровь.
О стационарном состоянии и целостности организма свидетельствует равновесие между скоростью синтеза и распада белков тела:
переваривание


 Белки пищи фонд свободных белки тканей
Белки пищи фонд свободных белки тканей
аминокислот организма
СО2 Энергия
Выводимый азот
Эффективность обмена белков в значительной степени зависит от количественного и качественного состава пищи. При поступлении белков с пищей ниже нормы, в организме начинают распадаться белки тканей (печени, плазмы крови и т. д.), а образующиеся аминокислоты - расходоваться на синтез ферментов, гормонов и других, необходимых для поддержания жизнедеятельности организма биологически активных соединений. Для оценки степени обеспеченности человека белковой пищей используется показатель азотистого баланса. Он представляет собой разность между количеством поступающего с пищей азота и количеством азота выводимого в виде конечных продуктов обмена, выраженными в одних и тех же единицах (г/сут.). Для взрослого здорового человека, потребляющего полноценные белки в необходимом количестве, характерно состояние азотистого равновесия и азотистый баланс равен нулю. Положительный баланс характерен для растущего организма и беременных женщин, отрицательный - для людей, пища которых бедна белком, для больных и людей пожилого возраста.
Пищевая ценность белка обуславливается:
а) его аминокислотным составом;
б) его усвояемостью.
Восемь аминокислот белка являются незаменимыми.
Оптимальное содержание незаменимых аминокислот в 1 г.
“идеального” белка (мг):
Изолейцин 40
Лейцин 70
Лизин 55
Метионин + цистин 35
Фенилаланин + тирозин 60
Триптофан 10
Треонин 40
Валин 50
Так как из метионина и фенилаланина в организме синтезируется цистин и тирозин, то наличие в пище в достаточном количестве этих двух заменимых аминокислот сокращает потребность в незаменимых предшественниках.
Две аминокислоты являются частично заменимыми - аргинин и гистидин, т. к. в организме они синтезируются медленно. Отсутствие в пище хотя бы одной незаменимой аминокислоты вызывает отрицательный азотистый баланс, нарушение деятельности центральной нервной системы, остановку роста и тяжелые клинические последствия типа авитаминоза. Нехватка одной незаменимой аминокислоты приводит к неполному усвоению других.
Наиболее близки к идеальному животные белки. Большинство растительных белков имеет недостаточное содержание одной или даже двух, трёх незаменимых аминокислот. Например, в белке пшеницы приблизительно 50 % лизина по сравнению с составом “идеального” белка.
Для характеристики биологической ценности белка используют показатель аминокислотный скор, позволяющий выявить так называемые лимитирующие аминокислоты.
Мг аминокислоты в 1 г.
исследуемого белка
скор =------------------------------------ x 100 %
мг аминокислоты в 1 г.
“идеального” белка
Определение лимитирующих аминокислот и степени их недостатка состоит в сравнении процентного содержания аминокислот в изучаемом белке и в таком же количестве условного “идеального” белка, т. е. белка полностью удовлетворяющего потребности организма. Все аминокислоты, скор которых составляет менее 100 %, считаются лимитирующими, а аминокислота с наименьшим скором является главнойлимитирующей аминокислотой (или первой).
Растительные белки усваиваются организмом хуже, чем животные: белки яиц и молока - на 96 %, белки хлеба - на 85 %, картофеля и бобовых - на 70 %. Это объясняется в значительной степени содержанием в растительных продуктах клетчатки, которая снижает усвояемость компонентов пищи.
Пониженная усвояемость растительных белков связана с тем, что оболочки растительных клеток, построенные из клетчатки и близких к ней полисахаридов, не разрушаются пищеварительными ферментами и тем самым препятствуют более полному использованию питательных веществ.
Полнота расщепления и утилизации белков в значительной степени зависит от характера и длительности термической обработки продукта, в котором они содержатся. Например, при высоких температурах в молоке, твороге разрушаются аминокислоты лизин и метионин. В результате заметно снижается усвояемость молочного белка - казеина. А белки куриного яйца расщепляются и утилизируются быстрее и полнее после их термической обработки.
Для взрослых достаточно 1-1,5 г. белка в день на 1кг. веса тела, что соответствует 85 г. (детям требуется больше). Учитывая, что растительные белки менее полноценны, чем животные, необходимо потреблять около 55 % белков животного происхождения от общего количества белков в рационе.
Основным источником животного белка в питании является мясо, рыба, затем молоко и молочные продукты. Основными источниками растительного белка являются хлеб и крупы.
Содержание белка в продуктах питания,(%):
Сыр 25
Горох, фасоль 22…23
Мясо 16…20
Яйца 13
Творог 14
Овсяная крупа, пшено 12
Макароны 10…11
Хлеб 5…8
Молоко 2,9
Рыба 17…25
Нарушение деятельности пищеварительного тракта приводит к попаданию в кровь пептидов. Они индивидуальны для каждого организма; для человека они чужеродны, в результате может возникнуть пищевая аллергия. Институт питания своими исследованиями показал, что некоторые пептиды могут находиться в крови долго и давать аллергическую реакцию. Например, непереносимость белка яиц у детей. Медики считают, что небольшое количество пептидов должно попадать в кровь, так как они осуществляют тренинг иммунной системы организма.
Велика роль белков в организме человека. Кроме того, каждая аминокислота в организме выполняет определённую функцию. Для примера рассмотрим функции отдельных аминокислот:
1) аминокислоты глютаминовая, аспарагиновая, глицин - выполняют в организме роль регуляторов нервной системы мозга, они являются медиаторами: веществами, которые выступают в роли посредников при передаче нервных импульсов;
2) тирозин при окислении дает продукты меланины, обеспечивающие окраску волос, глаз, цвет кожи и т. д. При нарушении системы окисления тирозина - заболевание альбинизм;
3) цистин - радиопротектор, т. е. вещество, которое снижает повреждающее действие радиации.



 COOH
COOH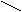 R-CH
R-CH









 Белки пищи фонд свободных белки тканей
Белки пищи фонд свободных белки тканей