В молекулярной физике широко пользуются двумя методами: молекулярно-кинетическим и термодинамическим. Молекулярно-кинетическая теория качественно объясняет основные свойства тел.
Термодинамика изучает общие свойства тел и различные процессы в них, сопровождающиеся превращениями энергии, на основе законов превращения и сохранения энергии (начал термодинамики). В термодинамике изучаются тепловые процессы — процессы, связанные с изменением температуры тела, а также с изменением его агрегатного состояния.
Преимущество термодинамического метода заключается в том, что основан на положениях, выведенных из многолетней человеческой практики. Существенный недостаток термодинамического метода заключается в том, что он, не вскрывая внутреннего механизма явлений, описывает только, как протекает данный процесс, не выясняя, почему он так протекает.Термодинамический и молекулярно-кинетический методы, применяемые к одним и тем же объектам, дополняют друг друга.
Термодинамические параметры состояния тела
В термодинамике имеют дело с термодинамическими системами. Под термодинамической системой подразумевается любое конечных размеров макротело или совокупность макротел. Под макротелом имеется в виду тело, размеры которого велики по сравнению с атомными размерами и которое состоит из огромного числа микрочастиц.
Состояние термодинамической системы определяется набором значений термодинамических параметров, т.е. физических величин, характеризующих свойства системы в целом. Некоторые из этих величин, как например, P и T, не применимы к микрочастицам, из которых состоит термодинамическая система. Термодинамические параметры являются макровеличинами,либо выражены через другие, непосредственно измеряемые на опыте величины. Число параметров, определяющих состояние системы, зависит от рода системы и внешних воздействий. Состояние простейших термодинамических систем (однородных газов и жидкостей, не подверженных действию каких-либо полей) определяется P, V и T.
Внутренняя энергия тел
В состав внутренне энергии входят: 1)WKEN поступательная, вращательная и калебательного движения молекул и атомов; 2)потенциальная W взаимодействия атомов и малекул; 3)W электронных оболочек атомов; 4)внутри-ядерная W.
Внутренняя энерг. в Т/д представляют собой сумму WKEN всех малекул+Wпотенц. их взаимодействия. U=WKEN+Wпот. –Внутр. энерг.
В идеальном газе малекулы не взаимод. между собой,поэтому Wпот.=0 и внутрен. энерг. U=WKEN
Внутрен. энерг. представляет собой WKEN всех молекул зависит только от T и числа малекул. Изминение внутрен. энерг. определ. только изменением T и не зависит от характера процесса. ΔU=U2-U1; ΔT=T2-T1; U=NWKEN=3/2Nа kT; N= Nа; WKEN=3/2kT;
Измерение внутренней энергии
Изминение внутрен. энерг. определ. только изменением T.ΔU=U2-U1; ΔT=T2-T1; U=NWKEN=3/2Nа kT; N= Nа; WKEN=3/2kT.
Способы изменения U:1) При выполнении мех. работы.2)При изменении темп.
Теплообмен -передача внутренней энергии от одного тела к др. без совершения работы.3-и вида теплообмена: теплопроводность, конвекция,излучение. Теплопроводность - процесс теплообмена между телами при их непросредственном контакте,обусловленной хоотическим движ. частиц тела. Конвекция – передача нагретыми патоками жидкости или газа из одних участков занимаемого ими V в другие. Излучение – теплообмен по средствам электромагнитных волн.
Количестао теплоты
Мерой изменения Wмех является А работа сил, приложенных к системе.ΔWмех=А. При теплообмене происходит изменения внутренней энергии тела.Мера изменения внутр. энергии –является
количеством теплоты. Количества теплоты - мера изменения внутр. энерг. которое тело получает в процессе теплообмена Q=ΔU.[Q]=1Дж
Количество теплоты необходимое для нагревания тела массой m от темп. Т1 до Т2,рассчитывается по форм.:Q=cm(T2-T1)=cmΔT. C-удел. теплоемкость вещества. с=Q/m(T2-T1). [c]=1дж/кг*К.
Удельная теплоемкость -равна колич.теплоты которое неоходимо сообщить телу m 1кг, чтобы нагреть его на 1Кл. Теплоемкость тела-
Ст=Q/(T2-T1)=cm.[C]=Дж/Кл.Для превращения жидкость в пар при T=const необходимо затр. Q=rm.r-уделю теплота парообразования.
При конденсации пара выдел. тоже кол. теплоты Q=-rm.
Для расплавления тела массой m при Т плав.неоходимо сообщ.телу Q
λ-удел. теплота плав. Q, которое выделяется при полном сгорании топлива =: Q=qm. q-удельная теплота сгорания.
Работа в термодинамике
F Газ с темп. Т1 нагрев. до Т2.Газ изобарически
2 расширяется и поршень переместится из
полож. 1 в 2.Газ совершает А против
F внешней F.Так как Р=const, то F=pS тоже
1 соnst. А рассчитывается: A=FΔL=pSΔL=pΔV=
L1 L2 ; =p(V2-V1).Газ выполняет А в процессе
изменения V причем газ расшир. и А>0,
Δ V>0.При зжатии газ V<0,A<0.
Уравн. Миндилеева-Клаперона:pV/T=m/M*R; pV1= m/M*R*T1;
pV2= m/M*R*T2; pV2-pV1= m/M*R*T2- m/M*R*T1; pΔV= m/M*R*ΔT.
A=pΔV;A= m/M*R*ΔT.Если m=M=1, ΔT=1К,то A=R.
Первый закон термодинамики
Первый закон термодинамики — это закон сохранения и превращения энергии в применении к тепловым процессам.
Если механическая энергия системы не изменяется, а система не замкнута и между ней и окружающей средой происходит теплообмен, то изменяется внутренняя энергия.

Первый закон термодинамики формулируется так:
изменение внутренней энергии при переходе системы из одного состояния в другое равно работе внешних сил плюс количество теплоты, переданное системе в процессе теплообмена.
Если вместо работы внешних сил А внввести работу А системы над внешними телами А = -Авн, то запишется: 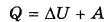
Тогда I закон термодинамики можно сформулировать так: количество теплоты, сообщенное системе, идет на изменение ее внутренней энергии и на совершение системой работы против внешних сил.
Из первого закона термодинамики вытекает невозможность создания вечного двигателя первого рода, т.е. такого двигателя, который совершал бы работу без затраты энергии извне.
Действительно, если к системе не подводится энергия Q = 0, то А =-ΔU и работа может быть совершена за счет убыли внутренней энергии системы. После того, как запас энергии окажется исчерпанным, двигатель перестанет работать.
Если система замкнута (Авн=0) и адиабатически изолирована (Q = 0) то первый закон термодинамики будет иметь вид:ΔU=0
Если в такой системе имеются тела с различной температурой, то между ними будет происходить теплообмен: тела, у которых температура выше, будут отдавать энергию и охлаждаться, а тела с меньшей температурой будут получать энергию и нагреваться. Это будет происходить до тех пор, пока температуры у всех тел не станут одинаковыми. При этом ΔU1+ΔU2+…ΔUn=0 или Q1+Q2+…+Qn=0
Первый закон термодинамики для незамкнутой и адиабатически изолированной системы называют уравнением теплового баланса.