

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...
Топ:
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Комплексной системы оценки состояния охраны труда на производственном объекте (КСОТ-П): Цели и задачи Комплексной системы оценки состояния охраны труда и определению факторов рисков по охране труда...
Интересное:
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Рассмотреть электронное строение молекул карбоновых кислот и выявить закономерности, определяющие силу кислот.
Вопрос – ответ:
Рассмотрите строение молекулы карбоновой кислоты. Из каких двух самостоятельных групп состоит карбоксильная группа?
Карбонил: - С = О
׀
Гидроксил: - ОН
Какова особенность электронного строения карбонильной группы?
Связь С=О полярная, плотность смещена к атому кислорода.
Какие свойства придает спиртам наличие гидроксила?
За счет подвижности атома водорода спирты проявляют слабые кислотные свойства.
И вот две эти функциональные группы соединены между собой.
Проблема: Как распределена электронная плотность в получившемся фрагменте? Как это отражается на свойствах карбоновых кислот?
 T СЛАЙД
T СЛАЙД
1. По сравнению с альдегидами и кетонами углеродный атом – С = О несет меньший положительный заряд. Это происходит благодаря положительному мезомерному эффекту атома кислорода гидроксильного фрагмента, имеющего неподеленную электронную пару. Таким образом, карбонильная группа становится не способна к реакциям присоединения, характерным для альдегидов и кетонов.
2. Вместе с тем, возрастает полярность связи – О — Н гидроксильного фрагмента, ион водорода легче отщепляется, кислотные свойства карбоновых кислот значительно сильнее по сравнению со спиртами.
Проблема: Ученые, путем незамысловатых действий, пришли к выводу, что лимонный сок обладает большей кислотностью, чем томатный, а кислотность томатного выше, чем пота и мочи. Как определить кислотность, и от чего она зависит?
Работа со схемой (числовая прямая рН)
Для наглядности предлагаю расставить достаточно известные всем кислоты в порядке увеличения их кислотности на числовой оси.
|
|
Описание:
На первом месте окажется рекордсмен по кислотности – лимонная кислота, которая так же является рекордсменом по плодам и ягодам, в которых она содержится: это крыжовник, листья махорки, хвоя, малина, свекловичный сок, листья хлопчатника, недозрелые лимоны и китайский лимонник (соответственно 80 и 70%).
На втором месте располагается щавелевая кислота, содержащаяся в листьях щавеля, ревеня, шпината, клевера и даже плодах томата. Но с данной кислотой нужно держать «ухо в остро». Ее соли – оксалаты – нерастворимы в воде, поэтому «любители щавеля» могут заработать себе камни в почках и мочевом пузыре.
Ниже располагаются винная и молочная кислоты. Они различаются по строению, и тем не менее, их кислотность приблизительно одинакова. Винная кислота содержится во многих растениях, но особенно много ее в виноградном соке. При достаточно длительном брожении виноградного сока в сосуде может выпасть серовато – красноватый осадок «винного камня» - соли виной кислоты. О молочной кислоте мы уже говорили. Она есть везде, где есть сахар, в том числе в моче и поте человека.
Янтарная кислота уже относится к разряду слабых кислот. Это деление, конечно, условно, поскольку и она вызывает химические ожоги на коже человека.
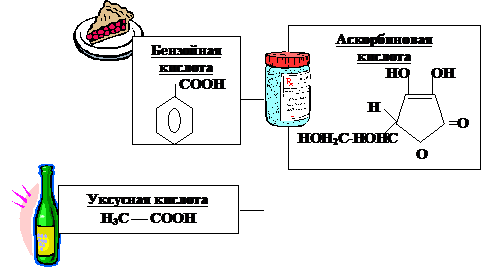
Однако бензойная кислота еще слабее, чем янтарная. Большое количество бензойной кислоты содержится в клюкве и бруснике.
T СЛАЙД (последовательное заполнение схемы)


 | |||||||
 | |||||||
 | |||||||
 | |||||||
 |
Вопрос: вы, наверняка, знаете, какими свойствами характеризуется эта ягода?
Медицинское антисептическое средство. Клюквенный сок вызывает гибель стафилококков, ответственных за воспалительные процессы организма. Благодаря этой способности клюква и брусника не гниют и могут долго сохраняться в свежем виде.Благодаря своим свойствам бензойная кислота используется как пищевая добавка - консервант Е210.
|
|
Вопросы – подсказки:
· Что подразумевается под словом «кислотность»?
· Чем определяется сила кислоты?
· Какие особенности строения влияют на силу кислот?
Выводы по схеме:
Задание: Дополните ряд кислот в нужной последовательности, используя приведенные ниже примеры. Подтвердите свои выводы экспериментальным путем.
Формулы веществ:
 СООН НООС – СН – СН2 – СООН Н3С – СООН НСООН
СООН НООС – СН – СН2 – СООН Н3С – СООН НСООН
ОН
ОСОСН3 яблочная уксусная муравьиная
Ацетилсалициловая
 Цель: Выполнив задания № 5, вы сможете сопоставить строение кислот и их силу, сравнив теоретические выводы с данными, полученными экспериментальным путем.
Цель: Выполнив задания № 5, вы сможете сопоставить строение кислот и их силу, сравнив теоретические выводы с данными, полученными экспериментальным путем.
| Группа | Задание |
| I |
|
| II |
|
| III |
|
| IV |
|
T СЛАЙД (продолжение последовательного заполнения схемы)
|
|
Шестую позицию мы предоставим яблочной кислоте. Она, как и винная, и янтарная, двухосновная, но в ее молекуле содержится гидроксил, который усиливает кислотные свойства, оттягивая электронную плотность атома углерода.
Самой слабой окажется уксусная кислота. Она одноосновная без заместителей в радикале и двумя атомами углерода в молекуле. Как только не называли эту кислоту: «кислой влажностью», «древесной кислотой», так как долгое время ее получали из древесины. Она имеет широкий спектр применения – растворитель лекарств и душистых веществ, реагент в химическом синтезе. Но сейчас, как и три тысячи лет назад, уксусная кислота – один из важнейших консервантов в пищевой промышленности. В продаже бывает несколько сортов уксуса: винный, фруктовый, столовый. Они отличаются содержанием различных добавок. Наиболее распространенный 9% - ный уксус – раствор уксусной эссенции (70%). При работе с ней необходимо соблюдать особые меры осторожности, так как даже 30% - ный раствор кислоты способен оставлять сильные ожоги на коже.
На третьем месте располагается муравьиная кислота, которая в 10 раз сильнее, чем уксусная кислота за счет самого маленького углеводородного радикала. Муравьиная кислота содержится не только в железах муравьев, но и в волосках крапивы. Данная кислота обладает бактерицидными свойствами, поэтому ее применяют, как консервант. Народная медицина традиционно использовала муравьиную кислоту для лечения ревматических болей и радикулитов, а пчеловоды ценят ее как эффективное средство от болезней пчел, связанных с пчелиными клещами – паразитами.
|
|
На четвертое место мы поставим ацетилсалициловую кислоту, так как в ее молекуле находится группа – ОСОСН3, являющаяся ориентантом II рода, и усиливающим подвижность атома водорода в карбоскиле, она гораздо сильнее бензойной кислоты. Аспирин обладает противовоспалительным, жаропонижающим и болеутоляющим действием, поэтому его применяют при лихорадочном состоянии и ревматизме. Аспирин подавляет болевую чувствительность и помогает от головной боли. Однако у этого чудо – лекарства есть противопоказания, а именно: его нельзя применять при язве желудка.
Вопрос: почему?
Кислая среда, которую создает аспирин при реакции с водой, может усугубить течение болезни.
VI. Содержание аскорбиновой кислоты в продуктах питания
Познакомиться с одной из самых распространенных в природе карбоновых кислот - аскорбиновой. Изучить ее функции в организме человека, природные источники и методы их исследования.
Внимание! Посмотрите, после расстановки всех формул кислот на шкале осталось одно свободное место.
Проблема: сейчас начинается наиболее опасное для здоровья время года, когда учащаются случаи простуды. С чем связана данная проблема?
В зимнее – весенний период у людей наблюдается авитаминоз.
Одним из наиболее необходимых веществ для устойчивости организма к простудным заболеваниям является витамин С (Аскорбиновая кислота). Ее кислотность равна кислотности бензойной кислоты, хотя формула сильно отличается.
Вопрос: что вы знаете о функциях аскорбиновой кислоты и содержании ее в продуктах питания?
Аскорбиновая кислота влияет на образование соединительной ткани, красных кровяных телец, она ускоряет всасывание железа и предохраняет другие витамины от окисления. При недостатке в организме данного вещества возникает слабость, возможно опухание конечностей, кровоточивость.
Суточная норма, рекомендуемая для потребления аскорбиновой кислоты – 60 мг.
T СЛАЙД
Работа с диаграммой:
 Важнейшие источники витамина С
Важнейшие источники витамина С
|
|
|

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!