

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...
Топ:
Техника безопасности при работе на пароконвектомате: К обслуживанию пароконвектомата допускаются лица, прошедшие технический минимум по эксплуатации оборудования...
Методика измерений сопротивления растеканию тока анодного заземления: Анодный заземлитель (анод) – проводник, погруженный в электролитическую среду (грунт, раствор электролита) и подключенный к положительному...
Интересное:
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным...
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
Лабораторная работа № 1
Обнаружение токоферола (витамина Е)
Витамины группы Е (токоферолы) являются производными токола, самый активный из них - a-токоферол. Качественные реакции на a-токоферол обусловлены окислением его в a-токоферилхинон, окрашенный в красный цвет.
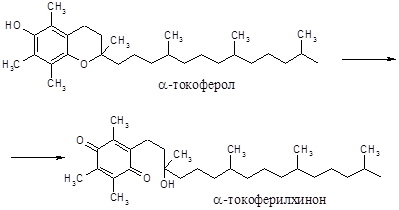
Добавление к a-токоферолу хлорида железа (FeCl3) вызывает появление красной окраски.

Ход работы. 5 капель спиртового раствора a-токоферола смешивают с 0,5 мл 1%-го раствора хлорного железа. Смесь тщательно перемешивают и наблюдают появление красного окрашивания. (температура?)
Качественные реакции на витамины группы Р (биофлавоноиды)Реакция Фелинга на рутин
При кислотном гидролизе рутина отщепляется молекула дисахарида рутинозы, которая затем распадается на D-глюкозу и L-рамнозу, обладающие восстанавливающими свойствами.
Ход работы. К 0,5 г порошка рутина приливают 5 мл 0,5%-го раствора соляной кислоты, нагревают при периодическом перемешивании до кипения и кипятят в течение 1 минуты. Пробирку охлаждают, и раствор фильтруют через бумажный фильтр. К фильтрату добавляют 3 мл 10%-го раствора гидроксида натрия и 3 мл свежеприготовленного реактива Фелинга (1,5 мл раствора Фелинга I и 1,5 мл раствора Фелинга II). Содержимое пробирки перемешивают стеклянной палочкой, нагревают до кипения и наблюдают образование красного осадка оксида меди (I).
Обнаружение никотиновой кислоты или никотинамида (витамин РР)
При нагревании никотиновой кислоты с раствором уксуснокислой меди образуется плохорастворимый синий осадок медной соли витамина РР.
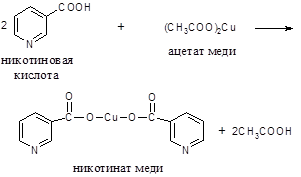
Ход работы. 5-10 мг никотиновой кислоты растворяют при нагревании в 1-2 мл 10%-го раствора уксусной кислоты. К нагретому до кипения раствору добавляют равный объем 5%-го раствора ацетата меди. Жидкость становится мутной, окрашивается в голубой цвет, а при стоянии выпадает синий осадок никотината меди.
|
|
Лабораторная работа №2
Лабораторная работа №3
Лабораторная работа №4
Лабораторная работа №5
Определение гемоглобина в крови
Приготовить пробы в соответствии со схемой определения
Схема определения
| Раствор | Опытная проба |
| Трансформирующий раствор, мл | |
| Образец, мл | 0,02 |
Содержимое пробирок тщательно перемешать и оставить стоять 10 мин при комнатной температуре. Измерить оптическую плотность опытной пробы (Е обр.) относительно трансформирующего раствора.
Расчет
Содержание гемоглобина в крови высчитывается по формуле:
Hb=E обр.*K
где Hb – концентрация гемоглобина, г/л.
K – коэффициент пересчета (заранее расчитаный)
Нормальные величины: мужчины – 130-160 г/л, женщины – 115-145 г/л.
Лабораторная работа №
Аллиум – тест
Разработанный более 50 лет назад (А. Леваном в 1938) тест на для оценки мутагенного, митозмодифицирующего и токсического эффектов факторов химической и физической природы, в котором в качестве материала используются корешки проростков репчатого лука Allium cepa. Корневая система - это часть любого растения, которая первой вступает в контакт с химическими загрязняющими агентами, находящимися в составе почв и вод.
Материалы и оборудование: Ацетоорсеин 2 %,Фиксатор Кларка, Спирт 70 %, Уксусная кислота40-45 %, чашки Петри, цилиндры мерные (25 и 100 мл), пенициллиновые флаконы или аналогичные ёмкости на 20 мл с глубоким дном, стёкла предметные и покровные, бюксы (15, 25 и 100 мл), пипетки мерные (1,0; 2,0; 10,0), пипетки глазные, лупы стереоскопические МБС-9, микроскопы.
Ход работы:
Выберите луковицы для исследования. Выборка должна быть однородной как в контрольном, так и в опытном вариантах опыта. Средняя масса севка — 10-20 г, диаметром 1,5-2 см. Выбранные луковицы не должны быть пересушены. Это можно понять, сняв лишнюю шелуху, которая к тому же может мешать проведению опыта. До начала эксперимента у луковиц не должно быть проклюнувшихся зеленых ростков листьев.
|
|
Луковицы помещают для проращивания корешков в чистую воду (дистиллированную или очищенную слабо минерализованную). По достижении корешками 1-2 см луковицы переносят в ёмкости с исследуемым раствором на определённое время (от 2 часов в случае с раствором колхицина до 3 дней). Луковицы проращиваются от 3 до 4 дней. Желательно использовать ёмкости диаметром 1,5 см и высотой 10 см, чтобы по мере роста корни не упирались в дно ёмкости, в которой они находятся.
Оценка параметров роста корней. Оценивается твердость кончиков. Твёрдость кончиков корней связана со степенью токсичности фактора. При высокой токсичности фактора тургесценция падает, что может привести к гибели корней. Изменение цвета корней. И длинна корней. По окончании эксперимента корни срезаются у луковицы под основание, измеряется длина каждого корешка, вычисляется среднее значение (среднее значение для каждой луковицы). Повреждённые корни не учитываются. Затем устанавливается среднее значение длины корней для всей выборки луковиц. Рассчитывается средняя длина корней для каждой луковицы в опытных и контрольных сериях экспериментов. Затем вычисляется общее среднее значение длины для опытной серии и контрольной. Вычисляется во сколько раз длина корней в опытной серии больше/меньше чем в контрольной и выражается в процентах. Изменение длины корней в Allium test-е является показателем токсичности. Если происходит значительное угнетение роста корней по сравнению с контролем, то отмечают токсический эффект воздействующего фактора. В случае значительного прироста корней, говорят о стимулирующем эффекте.
При необходимости для долговременного хранения проводят процедуру фиксации. Для фиксации корешки помещают в ёмкости с фиксатором Кларка. Ёмкости герметично закрывают и оставляют для фиксации клеток на 1-2 дня. Затем материал промывают два раза от фиксатора в 70 % спирте, и помещают в ёмкости с 70 % спиртом для долговременного хранения. Спирт должен превосходить материал по объёму в 4-5 раз.
Процедура окраски для приготовления препаратов для микроскопического анализа.
|
|
Окраску корешков производят 2 % ацетоорсеином. Корешки отмывают от спирта в воде (удобно в чашках Петри). Материал переносят в небольшие фарфоровые тигли с держателем, которые на 2/3 заполняют красителем. Тигель накрывают предметным стеклом. Нагревают над пламенем спиртов до тайного кипения (запотевание покровного стекла). Тигель с материалом оставляют на некоторое время для прокрашивания хромосом (от 2 часов до 1 суток). После этого можно готовить препараты для микроскопирования.
Микроскопический анализ. Готовят временные давленые препараты корневых меристем. Для этого от окрашенного корешка лезвием отрезают кончик меристемы длинной 2-3 мм (кончик отличается по более тёмной окраске и утолщением), помещают на предметное стекло в каплю 45 % уксусной кислоты, накрывают покровным стеклом и с помощью спички аккуратно раздавливают до получения монослоя клеток. Препараты анализируют под микроскопом при увеличении 12,5×1,5×40. На препаратах рассматривают мелкие, округло-квадратной формы клетки с хорошо прокрашенными ядрами и неповреждёнными клеточными стенками.
Лабораторная работа № 1
Зависимость окраски антоцианов от рН среды
Материалы и оборудование: красный лук/ свекла, 10%-й раствор CH3COOH, 10%-й раствор КОН, кристаллическая щелочь, дистиллированная вода, штатив с пробирками, весы, разновесы, водяная баня, колба на 100 мл, карандаш по стеклу, ножницы, пинцет, лакмусовый индикатор, микропипетка, глазные пипетки.
Ход работы
1. 3-5 гр листьев лука/ свеклы измельчить ножницами и поместить в термостойкую колбу.
2. Залить 30-50 мл воды и поставить в кипящую водяную баню на 10-15 мин.
3. Полученную вытяжку остудить.
4. Пронумеровать 5 пробирок.
5. В каждую пробирку налить по 3-4 мл вытяжки.
6. Раствор в пробирке 1 оставить в качестве контроля. В остальные добавить реактивы в соответствии со схемой опыта (см. табл.).
7. Пронаблюдать за изменением окраски растворов, рН.
8. Результаты занести в таблицу.
9. Сделать выводы.
Таблица 1. Результаты опыта с красным луком
| № пробирки | Вариант опыта | Окраска раствора | рН |
| Контроль | |||
| + 3-5 капель 10% раствора CH3COOH | |||
| + микрокаплю 10% раствора КОН | |||
| + 2-3 капли 10% раствора КОН | |||
| + 2-3 кристаллика щелочи |
|
|
Таблица 2. Результаты опыта со свеклой
| № пробирки | Вариант опыта | Окраска раствора | рН |
| Контроль | |||
| + 3-5 капель 10% раствора CH3COOH | |||
| + микрокаплю 10% раствора КОН | |||
| + 2-3 капли 10% раствора КОН | |||
| + 2-3 кристаллика щелочи |
Обнаружение тиамина (витамина В1)
При добавлении к раствору тиамина в щелочной среде диазо-реактива образуется сложное соединение этого витамина с диазо-бензолсульфокислотой, окрашенное в оранжевый или красный цвет. Диазобензолсульфокислота образуется в результате реакции диазотирования при взаимодействии сульфаниловой кислоты с нитритом натрия (или калия):
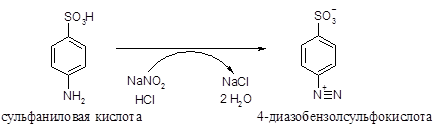
· Затем диазобензолсульфокислота реагирует в щелочной среде с тиамином с образованием окрашенного азосоединения:
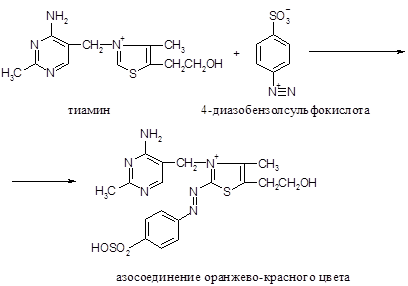
Ход работы. К диазореактиву, состоящему из 1%-го раствора сульфаниловой кислоты и 1%-го раствора нитрита натрия в соотношении 1:1, в объеме 2 мл, прибавляют 0,5мл раствора тиамина и затем по стенке, наклонив пробирку, осторожно добавляют 1 мл 20%-го раствора бикарбоната натрия. На границе двух жидкостей образуется оранжево-красное кольцо.
Обнаружение витамина В2 (рибофлавина)
Реакция обусловлена восстановлением рибофлавина водородом, образующимся при добавлении металлического цинка к соляной кислоте. При этом желтая окраска раствора переходит в розовую, затем раствор обесцвечивается. При взбалтывании обесцвеченного раствора лейкосоединение вновь окисляется кислородом воздуха в рибофлавин.

Ход работы. В пробирку наливают 1 мл раствора витамина, добавляют 5 капель концентрированной соляной кислоты и небольшой кусочек металлического цинка. Наблюдают бурное выделение пузырьков водорода и изменение окраски жидкости. Выделяющийся водород реагирует с рибофлавином, восстанавливая его, и жидкость постепенно окрашивается в розовый цвет за счет образования промежуточного соединения – родофлавина, а затем обесцвечивается за счет образования лейкоформы рибофлавина.
Обнаружение пиридоксина (витамина В6)
При взаимодействии пиридоксина с хлорным железом образуется комплексная соль типа фенолята железа, окрашенная в красный цвет Ход работы. В пробирку наливают 1 мл раствора витамина В6, добавляют 2 капли 5%-го раствора хлорида железа и содержимое встряхивают. Жидкость окрашивается в красный цвет.
|
|
|

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!