Цель работы
Изучение основ коагуляционной обработки воды. Определение оптимальной дозы| коагулянта.
Теоретическая часть
Одним из наиболее широко применяемых на практике приемов снижения содержания взвешенных и коллоидных примесей является их седиментация.
Однако примеси, обуславливающие мутность и цветность природных и сточных вод, отличаются малыми размерами (или находятся в молекулярном состоянии), из–за чего их осаждение происходит крайне медленно, так как диффузионные силы превалируют над силами тяжести. Для ускорения процессов осаждения, фильтрования, флотации прибегают к коагулированию воды.
Коагуляцией примесей воды называют процесс агломерации мельчайших коллоидных и дисперсированных частиц, происходящий вследствие их слипания под действием сил молекулярного притяжения. Коагуляция завершается образованием видимых невооруженным глазом агрегатов–хлопьев их отделением от жидкой среды.
Различают два типа коагуляции: коагуляция в свободном объеме (происходит в камерах хлопьеобразования) и контактная коагуляция (в толще зернистой загрузки или в массе взвешенного осадка). Дисперсированные коллоидные и взвешенные примеси природных и сточных вод в большинстве случаев имеют одинаковые заряды, что обуславливает возникновение межмолекулярных сил отталкивания и, создавая тем самым агрегативную устойчивость. В технологии очистки воды производят частичное или полное удаление примесей, поэтому их агрегативную устойчивость стремятся разрушить, снизив их заряд до нуля или до очень малых значений.
Это достигается добавлением к воде коагулянтов: сульфатов алюминия, железа (II и Ш), хлорида алюминия и железа (Ш), алюминия натрия, оксихлорида алюминия и других веществ, которые либо нарушают агрегативную устойчивость примесей, либо вследствие гидролиза образуя коллоиды, которые эти примеси сорбируют.
 Примеси природной воды образуют вместе с ней гетерофазную систему, в которой вода является дисперсионной средой, а масса распределенных в воде коллоидных частиц – дисперсной фазой. Эти частицы представляют собой мелкие агрегаты кристаллического или аморфного характера с огромной удельной поверхностью (до 800 м2/г), обладающей весьма значительной поверхностной энергией и, следовательно, и высокой адсорбционной емкостью. Это обстоятельство имеет большое значение для очистки, так как коагулирование связано с адсорбцией на коллоидных частичках примесей, содержащихся в воде в растворенном состоянии.
Примеси природной воды образуют вместе с ней гетерофазную систему, в которой вода является дисперсионной средой, а масса распределенных в воде коллоидных частиц – дисперсной фазой. Эти частицы представляют собой мелкие агрегаты кристаллического или аморфного характера с огромной удельной поверхностью (до 800 м2/г), обладающей весьма значительной поверхностной энергией и, следовательно, и высокой адсорбционной емкостью. Это обстоятельство имеет большое значение для очистки, так как коагулирование связано с адсорбцией на коллоидных частичках примесей, содержащихся в воде в растворенном состоянии.
Образованию коллоидных частиц предшествует формирование твердой фазы (ядра), адсорбирующей из растворов потенциал образующие ионы. В результате поглощения ионов поверхность ядра приобретает заряд.
Присутствующие в воде разноименные заряженные ионы группируются у поверхности ядра вследствие электрического притяжения между разноименными электрическими зарядами, образуя коллоидную частицу. Коллоидная частица вместе с окружающим ее диффузионным слоем называется мицеллой.
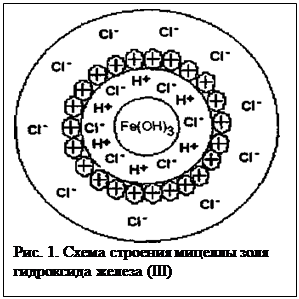
На рис. 1 представлена схема строения мицеллы золя гидроксида железа III полученного путем гидролиза хлорного железа.
Коллоидная частица золя гидроксида железа (III) состоит из ядра (см. рис. 1), образованного гидроксидом железа III, адсорбционно связанных с ним потенциал образующих водородных ионов (n Н+) и некоторого количества ионов хлора (n –– х)Сl- меньшего, чем количество ионов водорода, в результате чего частица имеет положительный заряд. Ионы водорода и входящие в состав частицы противоионы хлора образуют двойной электрический слой.
 Отдельные ионы хлора (Сl-) образуют диффузный слой и вместе с коллоидной частицей составляют мицеллу золя гидроксида железа III. (Золь – система, состоящая из коллоидных частиц, распределенных в жидкой или газообразной среде, если такой средой является вода, то система – гидрозоль).
Отдельные ионы хлора (Сl-) образуют диффузный слой и вместе с коллоидной частицей составляют мицеллу золя гидроксида железа III. (Золь – система, состоящая из коллоидных частиц, распределенных в жидкой или газообразной среде, если такой средой является вода, то система – гидрозоль).
Большинство коллоидов природных и сточных вод в интервале рН 6,5–8,5 в отличие от золей коагулянтов заряжено отрицательно. К ним относятся распространенные в природных водах кремниевая кислота, мельчайшие глинистые и гумусовые вещества.
На процесс коагуляции примесей воды в объеме оказывают влияние следующие факторы: концентрация ионов водорода, содержание в воде естественных взвесей, температура воды, условия перемешивания и наконец, правильный выбор дозы коагулянта.
Правильный выбор дозы коагулянта имеет первостепенное значение для коагулирования примесей. Под дозой коагулянта подразумевается определенное количество реагента, которое добавляется к единице объема обрабатываемой воды. Доза коагулянта измеряется в мг/л или г/м3.
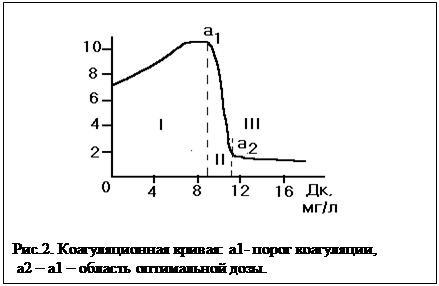
Наглядное представление о влиянии дозы коагулянта на процессы осветления и обесцвечивания воды дает коагуляционная кривая (рис. 2).
Кривую можно разбить на три зоны. В первой зоне при недостаточных дозах коагулянта эффект осветления – отрицательный, за счет образования коллоидных частиц самого коагулянта. Во второй зоне увеличение дозы резко сказывается на эффекте осветления и обесцвечивания. Граница между первой и второй зоной носит название порога коагуляции. В третьей зоне увеличение дозы коагулянта не дает заметного улучшения эффекта осветления и обесцвечивания воды.
Зона между второй и третьей зонами носит название оптимальных доз.
В настоящее время оптимальную дозу определяют методом пробного коагулирования. Суть его заключается в том, что отбирают из анализируемой среды шесть одинаковых проб, в которые вводят различные дозы коагулянта, после определенного времени определяют степень осветления каждой пробы и строят кривую коагулирования, по которой определяют зону оптимального коагулирования. Как правило, этот процесс занимает несколько часов.
Такое определение основано на законе Бугера–Ламберта–Бера, который гласит, что при всех прочих равных условиях ослабление светового потока, проходящего через анализируемую среду при одной и той же массовой концентрации взвешенных частиц пропорционально размеру этих частиц. В этом методе предлагается фиксировать порог коагуляции оптическим методом.
Порядок выполнения работы
1. Приготовить раствор коагулянта с концентрацией 1 г/л(сульфата алюминия или хлорида алюминия).
2. Ввести в емкость 1 л воды с 100 мг калиброванной бентонитовой глины, перемешать созданную суспензию.
3. Получить у преподавателя длину волны, на которой будут проводиться измерения с помощью фотометра КФК-3.
4. Приготовить суспензии для построения калибровочного графика. Для этого приготовить 5 пробирок с концентрацией бентонитовой глины 100, 50, 25, 12,5, 6,25 мг/л, т.е. разбавить часть исходного раствора 2, 4, 8, 16 раз. С помощью фотометра КФК-3 снять показания τ и внести полученные значения в таблицу 1. Построить калибровочный график.
Таблица 1 – Данные для построения калибровочного графика
| Сглины, мг/л
|
|
|
| 12,5
| 6,25
|
| τ, %
|
|
|
|
|
|
5. Приготовить 6 пробирок по 50 мл исходного раствора (с концентрацией бентонитовой глины 100 мг/л) В каждую пробирку ввести разные дозы коагулянта в количестве: 2, 4, 5, 7, 8, 9 мг/л, тщательно перемешать.
6. Оставить смесь на 20-30 минут для завершения процесса коагуляции.
7. С помощью фотометра КФК-3 определить коэффициенты пропускания τ для всех проб, внести значения в таблицу 2.
Таблица 2 – Данные для определения оптимальной дозы коагулянта
8. На основании полученного значения оптимальной дозы коагулянта для пробы, объемом 50 мл, рассчитать значение оптимальной дозы коагулянта для исходной суспензии с концентрацией 100 мг/л.
9. Используя калибровочный график определить остаточную концентрацию бентонитовой глины в растворе Сост (концентрация, при которой τ на калибровочном графике соответствует τ раствора с оптимальной дозой коагулянта).
10. Определить эффективность очистки по формуле:
η=100·(Сисх- Сост)/ Сисх,
где Сисх – исходная концентрация бентонитовой глины, равная 100 мг.
Содержание отчета
1. Калибровочный график, построенный в соответствии с п.4.
2. Заполненные таблицы 1 и 2.
3. Экспериментальная коагуляционная кривая, построенная в соответствии с п.7.
4. Определение оптимальной дозы коагулянта.
5. Расчет эффективности очистки загрязненного раствора.
6. Выводы по работе.
Контрольные вопросы
1. Чем определяется устойчивость коллоидных систем.
2. Возможные коллоидные загрязнения природных и сточных вод.
3. Механизм коагуляции.
4. Оптимальная доза коагулянта.



 Примеси природной воды образуют вместе с ней гетерофазную систему, в которой вода является дисперсионной средой, а масса распределенных в воде коллоидных частиц – дисперсной фазой. Эти частицы представляют собой мелкие агрегаты кристаллического или аморфного характера с огромной удельной поверхностью (до 800 м2/г), обладающей весьма значительной поверхностной энергией и, следовательно, и высокой адсорбционной емкостью. Это обстоятельство имеет большое значение для очистки, так как коагулирование связано с адсорбцией на коллоидных частичках примесей, содержащихся в воде в растворенном состоянии.
Примеси природной воды образуют вместе с ней гетерофазную систему, в которой вода является дисперсионной средой, а масса распределенных в воде коллоидных частиц – дисперсной фазой. Эти частицы представляют собой мелкие агрегаты кристаллического или аморфного характера с огромной удельной поверхностью (до 800 м2/г), обладающей весьма значительной поверхностной энергией и, следовательно, и высокой адсорбционной емкостью. Это обстоятельство имеет большое значение для очистки, так как коагулирование связано с адсорбцией на коллоидных частичках примесей, содержащихся в воде в растворенном состоянии. Отдельные ионы хлора (Сl-) образуют диффузный слой и вместе с коллоидной частицей составляют мицеллу золя гидроксида железа III. (Золь – система, состоящая из коллоидных частиц, распределенных в жидкой или газообразной среде, если такой средой является вода, то система – гидрозоль).
Отдельные ионы хлора (Сl-) образуют диффузный слой и вместе с коллоидной частицей составляют мицеллу золя гидроксида железа III. (Золь – система, состоящая из коллоидных частиц, распределенных в жидкой или газообразной среде, если такой средой является вода, то система – гидрозоль).


