Тема 7: Механика промывочных жидкостей и тампонажных растворов.
1 Адсорбция.
2. Абсорбция.
3. Поверхностно-активные вещества.
Адсорбция
Адсорбция - это явление самопроизвольного повышения концентрации газообразного или растворенного вещества на поверхности твердого тела или
жидкости в гетерогенных (неоднородных) системах. Различают физическую, или
Ван-дер-Ваальсову, адсорбцию и химическую, или хемосорбцию. Более общим термином, характеризующим самопроизвольное cгущение какого-то компонента на поверхности раздела двух фаз, является сорбция. При этом поглощающее вещество называется сорбентом, поглощаемое - сорбтивом. В зависимости от того, насколько глубоко проникают частицы сорбтива в сорбент, различают адсорбцию (вещество поглощается в поверхностном слое) и абсорбцию (вещество поглощается всем объемом тела).
В физикохимии буровых и тампонажных растворов велика роль как физических, так и химических поверхностных явлений. Они обусловливают такие
свойства этих систем, как устойчивость к коагулирующему действию электролитов, структурно-механические показатели. С адсорбционными явлениями связан механизм действия реагентов-стабилизаторов, понизителей вязкости и замедлителей сроков схватывания цементных растворов. Адсорбционные слои при физической
адсорбции имеют электрическую природу. Эти силы возникают при взаимодействии молекул с жестким (постоянным) диполем, жестким и индуцированным диполем, между неполярными молекулами, вследствие мгновенного дипольного момента и между молекулами при водородной связи. К химическим связям относятся ионные,
ковалентные и координационные.
Независимо от состава поверхностных слоев адсорбционные процессы характеризуются следующими общими свойствами.
Ø Процессы адсорбции обратимы и носят избирательный характер.
Частицы, находящиеся в адсорбционных слоях, не закреплены жестко, они могут выходить за пределы действия межмолекулярных сил, т.е. отрываться от адсорбента и уходить в окружающее пространство - десорбироваться. Со временем среднее число частиц, покинувших поверхностный слой, становится равным
числу адсорбируемых частиц за тот же период времени и в системе устанавливается адсорбционное равновесие.
Ø Процесс адсорбции экзотермичен, т.е. протекает с выделением тепла. В соответствии с принципом смещения равновесий (принцип Ле–Шателье). адсорбцию выгодно осуществлять при низких температурах.
Ø Абсорбция характеризуется малой энергией активации, т.е. малым энергетическим барьером, а следовательно, большой скоростью ее протекания.
Адсорбция - это самопроизвольный процесс повышения концентрации газообразных и растворенных веществ на границе раздела фаз, вызванный избытком свободной поверхностной энергии и сопровождающийся её; понижением за счет снижения (S=const).
Концентрированно газов и растворенных веществ на границе раздела
происходит в результате притяжения (поглощения) молекул, атомов или ионов из окружающей среды поверхностью вещества, обладающей нескомпенсированным силовым полем. Вещество, способное поглощать (адсорбировать) на своей поверхности другое вещество, называется адсорбентом, а вещество, которое поглощается - адсорбтивом.
В некоторых случаях молекулы поглощенного газа диффундируют
вглубь поглотителя и распределяются по всему объему. Такой процесс называется абсорбцией. Адсорбция и абсорбция объединяются общим понятием сорбции. Адсорбция - это поверхностная сорбция, абсорбция - объемная сорбция. К сорбции относят и капиллярную конденсацию, заключающуюся в поглощении твердыми пористыми адсорбентами, газов и паров и конденсации их в порах.
В нефтепромысловой практике имеют место все сорбционные процессы, но наибольшее значение имеет адсорбция.
Адсорбционные явления имеют большое значение для технологии промывки и цементирования скважин. Твердая фаза буровых и тампонирующих растворов является хорошим адсорбентом. В качестве адсорбтивов выступают химические реагенты, вводимые в состав буровых и тампонирующих растворов для регулирования их технологических свойств.
Для адсорбции характерны следующие свойства:
1) термодинамическая обратимость, т.е. динамическое равновесие двух противоположных процессов - адсорбции и десорбции:
адсорбция десорбция
Десорбцией называют обратимый процесс перехода вещества из поверхностного слоя в объемную фазу;
2) экзотермичность процесса вследствие самопроизвольного взаимодействия между частицами адсорбента и адсорбтива;
3) малая энергия активации, а, следовательно, большая скорость
протекания адсорбции.
Количественно величина адсорбции - r определяется избытком
адсорбтива в поверхностном слое по сравнению с его количеством в объеме фазы, отнесенным к единице площади поверхности адсорбента:
r C 0 CP
S
, (13)
где С0 и СР - начальная и равновесная концентрации адсорбтива, моль;
S - поверхность адсорбента, м2.
Если адсорбентом является твердое пористое тело, общую поверхность которого определить невозможно, то адсорбцию a относят к единице массы
адсорбента m:
a C 0 CP
m
(14)
При установлении равновесия в системе количество адсорбированного вещества в поверхностном слое находится в определенной зависимости от концентрации или парциального давления этого компонента в объеме и от температуры.
Адсорбцию чаще всего характеризуют зависимостью величины адсорбции от концентрации (или парциального давления) адсорбтива при постоянной температуре:
r=f(Cp) или r=f(Pp) при Т=const
Эту зависимость называют изотермой адсорбции,
Адсорбция может идти на поверхностях раздела газ - раствор, жидкость - раствор, газ - твердое тело, раствор - твердое тело. Агрегатное состояние смежных фаз придает определенную специфику явлению адсорбции.
Адсорбция газов
Адсорбцию на границе твердое тело-газ следует учитывать в процессах добычи природного газа, а также при использовании воздуха и газа для очистки скважин от выбуренной породы.
Величина адсорбции определяется уравнением Лэнгмюра, при выводе
которого он исходил из следующих положений
1. Адсорбция молекул происходит не на всей поверхности адсорбента, а только на определенных её участках - активных центрах.
2. Каждый активный центр энергетически эквивалентен и может взаимодействовать только c одной молекулой адсорбтива, поэтому на адсорбенте образуется мономолекулярный слой адсорбтива, который экранирует поверхность адсорбента.
3. Адсорбированные молекулы не взаимодействуют друг с другом.
4. Адсорбция молекул обратима.
Схема процесса адсорбции газа может быть представлена в следующем
виде.
Молекула Свободный активный адсорбция Адсорбционный
Газа центр поверхности ------- комплекс адсорбента
десорбция
При постоянной температуре адсорбционное равновесие характеризуется равенством скоростей адсорбции и десорбции: Va=Vд. Скорость адсорбции газа пропорциональна его давлению числу столкновений молекул c поверхностью адсорбента, т.е. парциальному давлению газа и концентрации (числу) незанятых свободных активных
центров на поверхности адсорбента - А:
v 0 K a PA, (16)
где Ка - константа скорости адсорбции.
Количество активных незанятых центров определяет количество вещества, которое может поглотиться поверхностью. Поэтому А можно представить как разность между максимально возможной адсорбцией – rмакс (когда поверхность полностью заполнена молекулами адсорбтива) и количеством уже адсорбированного вещества Г при данных условиях, т.е. А
= rмакс- r.
Следовательно,
va K a P (rмакс
r)
(17)
Скорость десорбции газа зависит от фактической величины адсорбции
r, поэтому
v g k g r (18)
где kg - константа скорости десорбции.
При адсорбционном равновесии
K a P (rмакс
r) K g r
(19)
Обозначив отношение Ка/Кg через b, получим уравнение изотермы адсорбции Лэнгмюра, выражающее зависимость адсорбции от давления:
Г Г
вР
макс 1 вР
(20)
где в - константа, зависящая от силы взаимодействия между адсорбционными центрами и адсорбированными молекулами, т.е. от природы адсорбента и адсорбтива.
Уравнение адсорбции Лэнгмюра позволяет вычислить количество вещества, адсорбированного на единице поверхности адсорбента.
Достоинство этого уравнения заключается в том, что оно в отличие от уравнения Гиббса не содержит значение σ, которое не поддается прямому определению для твердых поверхностей. Уравнение (20) справедливо и для адсорбции на границах раздела газ-жидкость, жидкость-жидкость.
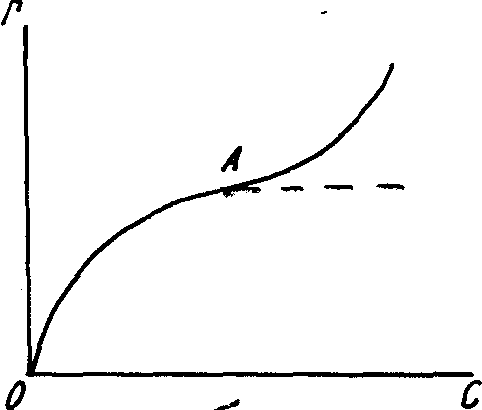
Уравнению Лэнгмюра соответствует изотерма адсорбции (рис. 19а), по форме аналогичная изотерме Гиббса.
При малых давлениях или концентрациях, когда С→0, величиной вР в знаменателе можно пренебречь, тогда r=rмакс вР, т.е. в области низких давлений или концентраций количество адсорбированного газа растет пропорционально давлению (участок изотермы I).
При больших давлениях и концентрациях можно пренебречь единицей как малой величиной в знаменателе уравнения, тогда r=rМАКС, т.е. количество адсорбированного газа достигает максимальной величины и от давления (или от концентрации) не зависит (участок изотермы III).
Уравнение Лэнгмюра справедливо для мономолекулярной адсорбции на адсорбенте с энергетически эквивалентными адсорбционными центрами. Однако реальные поверхности твердых тел, как правило, не обладают таким свойством, особенно в случае пористых тел. В этом случае адсорбция на поверхности твердого тела описывается эмпирическим уравнением Г.
Фрейндлиха
x P 1/ n? (21)
m
где x - количество адсорбированного газа; m - масса адсорбента; Р -
равновесное давление или концентрация адсорбтива;
и n - постоянные величины.
Логарифмируя формулу, получают уравнение прямой:
lg x m
lg
1 lg P? (22)
n
При графическом построении зависимости постоянные и n (рис. 17).
lg x
m
f lg P находят
Рис. 17. Изотерма адсорбции
Фрейндлиха в логарифмических координатах.
Величина 1/n обычно колеблется в пределах от 0,1 до 0,9, а величина
от 2 до 25.
Уравнение Фрейндлиха широко используется для практических целей при инженерных расчетах.
Однако уравнение Фрейндлиха применимо только при малых и средних давлениях, в то время как уравнение Лэнгмюра хорошо описывает адсорбцию для всех давлений.
Вывод уравнений основан на том, что адсорбтив располагается на адсорбенте мономолекулярным слоем, т.е. толщиной в одну молекулу. Однако, как показали практические исследования в ряде случаев на пористых адсорбентах, особенно при больших концентрациях, возможно образование нескольких адсорбционных слоев (рис. 18).

Рис. 18. Схема строения полимолекулярного слоя по теории БЭТ
Такая многослойная адсорбция называется полимолекулярной, Общая теория полимолекулярной адсорбции разработана С. Брунауэром, П. Эмметом и Д. Теллером (сокращено теория БЭТ). По этой теории изотермы адсорбции имеют S - образную форму (рис, 196),
а б
Рис. 19. Изотермы адсорбции газов: а -Ленгмюра; б -БЭТ
Нижняя часть (ОА) кривой отвечает образованию монослоя и, следовательно, соответствует изотерме Лэнгмюра. Участок АВ характеризует образование последующих адсорбционных слоев.
Нахождение точки перехода от монослойности к полислойности (точка А на рис. 18б) дает возможность рассчитать величину rМАКС, отвечающую плотнейшей упаковке молекул в мономолекулярном слое адсорбтива. Знание этой величины и размеров молекулы дает возможность рассчитать удельную поверхность пористых адсорбентов (цемента, глинистых минералов, выбуриваемых пород, утяжелителей буровых растворов и т.д.), что имеет
весьма важное практическое значение:
S уд
rМАКС
N A
(23)
где rМАКС - предельная адсорбция; NA - число Авогадро; - площадь, занимаемая одной молекулой адсорбента.
Изотермы, аналогичные полимолекулярной адсорбции (рис. 18б), наблюдаются и при адсорбции, сопровождающейся капиллярной конденсацией, которая происходит в мелких порах адсорбента. Капиллярная конденсация начинает проявляться при определенной степени заполнения адсорбента или при определенном значении давления пара, характерном для данной системы. Капиллярная конденсация не связана с адсорбцией, она происходит вследствие взаимодействия молекул только адсорбтива.
Адсорбция, кроме внешних условий (Р, Т, С) зависит от природы адсорбента и адсорбтива, от их взаимного сродства. Чем сильнее взаимодействие адсорбент-адсорбтив, тем больше величина адсорбции при тех же равновесных давлениях или концентрациях. Сродство адсорбтива к адсорбенту тем сильнее, чем больше их склонность к образованию связей одной природы, например, к дисперсионному взаимодействию, или к диполь- дипольному, или к образованию водородных связей. Так, поверхность сажи склонна к дисперсионным взаимодействиям. Поверхности ионных кристаллов имеют большое сродство к соединениям, молекулы которых
обладают диполями. На поверхности оксидов металлов обычно имеются гидроксильные группы, которые способны образовывать водородные связи. Поэтому их поверхности прочно удерживают воду, спирты, амины и др.
Величина адсорбции зависит и от сил взаимодействия между молекулами адсорбтива. Чем оно больше, тем слабее взаимодействие адсорбент-адсорбтив, соответственно изменяется величина при мономолекулярной адсорбции. При полимолекулярной адсорбции величина адсорбции может увеличиться с усилением взаимодействия между молекулами адсорбтива. При значительных силах сцепления между молекулами адсорбтива конденсация адсорбированного вещества на поверхности наступает при меньших давлениях, чем для веществ с малыми силами взаимодействия между молекулами. На одном и том же адсорбенте лучше адсорбируются те газы, у которых выше молекулярная масса, которые легче сжимаются, т.е. температура кипения которых выше. Этим, например, обусловлена адсорбция на поверхности твердых тел из воздуха главным образом водяных паров, что создает благоприятные условия для развития коррозионных процессов.
Пары молекул воды адсорбируются на всех глинистых материалах, причем физическая адсорбция сопровождается хемосорбцией, а в случае минералов с подвижной кристаллической решеткой (типа монтмориллонита) сильным набуханием. Пары неполярных молекул (СО2, углеводородов) адсорбируются лишь на внешней поверхности частиц глин.
Свойства молекул адсорбтива в граничном слое отличаются от таковых в объемных условиях, в которых они взаимодействуют только друг с другом. Адсорбированные молекулы в значительной степени теряют присущую им в объеме подвижность. Поэтому в зависимости от насыщенности адсорбционного слоя, количества слоев и характера связей с адсорбентом молекулы адсорбтива могут находиться в виде особого состояния двухмерного газа, жидкости или твердого тела.
Адсорбция из растворов
Адсорбция на границах раздела твердое тело-жидкость имеет место в пластах, содержащих нефть, на твердых частицах буровых растворов и цементов. Жидкая фаза редко бывает чистой. Она состоит из собственной
жидкости, а также растворенных в ней молекул или ионов других веществ.
Адсорбция из растворов в основном походит на адсорбцию газов и паров. Однако она осложняется наличием растворителя, который также может адсорбироваться твердым телом. Поэтому адсорбция растворенных веществ меньше адсорбции газов и идет медленнее. Это объясняется тем, что убыль концентрации в слое, прилегающем к поверхности адсорбента, восполняется за счет диффузии, которая в жидкостях протекает медленнее, чем в газах. С повышением температуры величина адсорбции из растворов падает в меньшей степени, чем в случае адсорбции газов.
На границе твердое тело - раствор различают два вида адсорбции: молекулярную адсорбцию неэлектролитов (или слабых электролитов) и адсорбцию электролитов.
Молекулярная адсорбция
Молекулярная адсорбция из разбавленных растворов подчиняется уравнениям Лэнгмюра (20) и Фрейндлиха (21), в которых парциальное давление заменено равновесной концентрацией растворенного вещества:
r r
вс;
МАКС 1 вс
r с 1/ n
(24)
Адсорбция на твердых поверхностях из растворов зависит от характера смачивания поверхности растворителем. Это является результатом конкуренции за центры адсорбции на поверхности адсорбента молекул растворенного вещества и молекул растворителя. Если растворитель хорошо смачивает поверхность твердого тела, следовательно, он сильно понижает поверхностное натяжение на границе с твердой фазой, поэтому происходит преимущественная адсорбция молекул растворителя. Если же растворитель плохо смачивает твердую поверхность, то молекулы растворителя на ней почти не адсорбируются, и на поверхности остается достаточно места для адсорбции растворенного вещества.
Все неполярные гидрофобные вещества (уголь, парафин) лучше адсорбируют поверхностно-активные вещества из водных растворов и слабо из неполярных из малополярных жидкостей. Гидрофильные вещества (силикагель, глины) лучше адсорбируют ПАВ из неполярных или слабо полярных жидкостей. Поэтому они применяются для очистки различных
фракций нефтей и нефтепродуктов.
Адсорбция ПАВ на твердой поверхности изменяет ее природу, Так, если гидрофильную поверхность обработать водным раствором ПАВ, то его молекулы ориентируются полярными группами к поверхности, а углеводородными радикалами в воздух. Если адсорбционное взаимодействие достаточно прочно, то поверхность вещества приобретает гидрофобные свойства. Капля воды на такой поверхности образует тупой угол, т.е. поверхность не смачивается водой (рис. 19).

Рис. 19. Гидрофобизация поверхности
Адсорбция ПАВ из водных растворов зависит от их природы. С увеличением длины углеводородного радикала адсорбируемость ПАВ на твердой поверхности различна: из водных растворов на гидрофобных адсорбентах растет в соответствии с правилом Траубе, из неполярных растворителей на гидрофильных адсорбентах падает (обращение правила Траубе).
Большое значение для адсорбции имеет соответствие поперечного сечения пор адсорбента и молекул адсорбтива. С увеличением размера молекул адсорбтива адсорбция на адсорбентах с узкими порами падает.
В конечном счете адсорбция из растворов на твердых поверхностях зависит от природы адсорбента, адсорбтива и растворителя. Эта зависимость определяется правилом уравнивания полярности П.А. Ребиндера:
Вещество С может адсорбироваться на поверхности раздела фаз А и В,
если оно в результате своего присутствия в поверхностном слое будет уравнивать полярности этих фаз.
Полярность характеризуется диэлектрической проницаемостью .
Следовательно, адсорбция С будет идти при соблюдении условия εА > С > εВ или εА < С < εВ.
Из правила Ребиндера вытекает: 1) чем больше разность полярности
между растворимым веществом и раствором, т.е. чем меньше растворимость
растворенного вещества, тем лучше оно адсорбируется; 2) чем ближе по своей природе адсорбент к растворителю, тем меньше адсорбируется растворенное вещество из этого растворителя. Выравнивание полярностей фаз (адсорбента и растворителя) происходит при определенной ориентации молекул ПАВ на межфазной границе (рис. 20).

а) уголь б) глина
Рис. 20. Ориентация молекул ПАВ на границе твердое тело-раствор:
а - неполярный адсорбент - полярный растворитель;
б - полярный адсорбент - неполярный растворитель.
Адсорбция электролитов
Сильные электролиты в водных растворах практически полностью дисоциированы на ионы, поэтому адсорбент поглощает не молекулы, а ионы. Поглощение сильных электролитов из водных растворов на твердых адсорбентах называется ионной адсорбцией.
Ионы обычно адсорбируются на поверхностях, построенных из ионов (c ионной кристаллической решеткой) и из полярных молекул, т.е. на гидрофильных адсорбентах. С повышением температуры скорость ионной адсорбции возрастает. Эти факты указывают на то, что при поглощении ионов протекает хемосорбция, сопровождающаяся образованием поверхностных химических соединений. Поэтому адсорбция ионов часто носит необратимый характер. Характерной особенностью ионной адсорбции является избирательность, которая выражается в способности твердой поверхности адсорбировать ионы одного типа: катионы или анионы. Избирательность определяется природой адсорбента и адсорбируемых ионов. Правила избирательной адсорбции сформулированы Н.П. Песковым и К. Фаянсом. Согласно первому правилу: на твердой поверхности преимущественно адсорбируются ионы, имеющие общую c данной поверхностью группировку ( или изоморфную с ней).
Поэтому на осадке гидроксида магния, подученном по реакции
MgCl2+2NaOHMg(OH)2+2NaCl,
проводимой при избытке MgCl2, будут адсорбироваться ионы Mg2+ или ОН-, но не ионы Na+ или С1-. Такую адсорбцию можно рассматривать как кристаллизацию, т.е. достройку кристаллической решетки адсорбента.
Поверхность полярных адсорбентов в растворах электролитов обладает электрическим зарядом, возникающим в результате поверхностной диссоциации ионогенных групп адсорбента или избирательной адсорбции. Влияние заряженной поверхности на ионную адсорбцию определяется вторым правилом Пескова-Фаянса: на твердой поверхности адсорбируется тот ион, знак которого противоположен по знаку поверхности и который может образовывать c одним из ионов решетки мало растворимое соединение.
Ионы электролитов, имеющие противоположный знак заряда по отношению к зарядам на поверхности, не адсорбируются, но вследствие наличия сил электростатического притяжения остаются вблизи адсорбированных ионов, образуя с ними так называемый двойной электрический слой.
Адсорбционная способность ионов существенно зависит от их природы, заряда, радиуса и степени гидратации.
Чем больше заряд иона, тем лучше он адсорбируется. Из ионов одинакового заряда лучше адсорбируется ион наибольшего радиуса, так как такой ион сильнее поляризуется и, следовательно, лучше притягивается к полярной поверхности адсорбента. Кроме того, с увеличением радиуса уменьшается степень его гидратации. А это также усиливает адсорбцию, так как гидратная оболочка ослабляет электростатическое притяжение,
Гидратированные ионы, расположенные в порядке возрастания адсорбционной способности, образуют так называемые лиотропные ряды: Li+<Na+<K+<NH4+<Rb+<Cs+ (для однозарядных катионов)
Mg2+<Ca2+<Sr2+<Ba2+ (для двухзарядных катионов)
Cl-<Br-<NO3-<J-<CNS-<OH- (для однозарядных анионов)
Разновидностью ионной адсорбции является ионообменная адсорбция. Она заключается в том, что твердый адсорбент, практически не растворимый в воде, поглощает из раствора ионы одного знака (катионы или анионы) и вместо них для сохранения электронейтральности выделяет в раствор
эквивалентное количество других ионов того же знака (рис. 21).
Рис. 21. Схема ионообменной адсорбции
Обменная адсорбция ионов очень похожа на обменные ионные химические реакции, но только протекающие на поверхности твердой фазы. Если при обменной адсорбции взамен поглощаемого иона нейтральной соли (NaCl, KCl, KNO3, Na2SO4) адсорбент отдает в раствор эквивалентное количество ионов Н+ или OН-, такая адсорбция называется гидролитической.
Так, глинистые минералы могут участвовать в гидролитической адсорбции своими Н+ - ионами. Поэтому обменная адсорбция может сопровождаться изменением pН среды.
Как и всякая химическая реакция обмена, ионная адсорбция обратима и подчиняется закону действия масс. Ионы, поглощенные адсорбентом, можно десорбировать введением раствора, содержащего ион, который способен вступить в реакцию обмена c этим ионом.
Е.К. Гедройц установил, что по способности к взаимному обмену (по
вытесняющей способности катионы и анионы располагаются в определенном порядке, практически не зависящем от природы адсорбента: H+>Fe3+>Al3+>Ca2+>Mg2+>NH+>K+>Na+>Li+ (для катионов)
OH- > SO42- > Cl- > NO -
> Br-
> J-
(для анионов)
Скорость ионной адсорбции определяется скоростью диффузии ионов через слой раствора. Количественно обменная адсорбция описывается
уравнением изотермы Б.П. Никольского
Z 1 r 1
Z 2 r 2
Z 1 c 1
k
Z 2 c 2
, (25)
где r1 и r2- количества поглощенных ионов, моль/г; C1 и С2- равновесные концентрации или активности обменивающихся ионов в растворе; Z1 и Z2 - заряды ионов; К - константа обмена, которая определяет соотношения ионов в поглощенном состоянии при заданной концентрации в растворе.
Адсорбенты, способные к ионному обмену, носят общее название -
иониты.
Различают процессы катионного и анионного обмена; соответственно иониты называют катионитами и анионитами. Существуют иониты, которые в зависимости от условий обменивают катионы либо анионы. К обмену ионами способны многие природные горные породы (глауконит, бентониты, цеолиты, глины), искусственные и синтетические вещества (силикагель, сульфоугли, ионообменные смолы),
Обменная адсорбция играет большую роль при бурении, поскольку разбуриваемые породы и глины, входящие в состав буровых растворов, содержат так называемый "поглощающий комплекс". Поглощающий комплекс - та часть глины, которая удерживает ионы в обменном состоянии, С точки зрения химического состава он представляет собой смесь нерастворимых в воде глинистых минералов (алюмосиликатов), органических и органоминеральных веществ и содержат катион, способный участвовать в обмене на другие катионы. В поглощающем комплексе глин, преобладает Na+ или Ca2+, реже K+ или Mg2+. Если в поглощающем комплексе глин преобладает Na+., то они при избытке воды разбухают. Таким образом, добавляя в промывочные жидкости тот или иной электролит
(например, Na2 CO3, Na3PO4, CaCl2 и др.), можно изменить их свойства. Используя ионный обмен, можно регулировать такие свойства буровых растворов, как рН, вязкость, стабильность, изменять растворимость в них минералов, гидрофильность глинистых частиц и т.д. Ионный обмен при использовании буровых растворов существенно влияет на устойчивость и деформацию горных пород.
Способность глин и других адсорбентов к обмену ионов количественно характеризуется обменной емкостью. Обменная емкость измеряется числом миллиграмм-эквивалентов (мг.экв) ионов, обменившихся при контакте раствора с 100 г адсорбента. Различные глинистые минералы обладают разной объемной емкостью: наибольшую имеют монтмориллонитовые глины (80-150 мг.экв), а самую низкую - каолинитовые (3-19 мг.экв).
Процессы ионного обмена играют важную роль в природе. Они определяют состав природных вод, почв, грунтов, соотношение некоторых химических элементов в земной коре. Иониты применяют для умягчения и полной деминерализации природных вод и очистки сточных вод.
Адсорбционные примеси из растворов применяются в нефтеперерабатывающей, текстильной, пищевой, энергетической, металлургической, горнодобывающей и других отраслях промышленности.
В нефтеперерабатывающей промышленности адсорбенты широко используют для очистки нефтепродуктов, как катализаторы в процессах каталитического крекинга. Цеолиты являются хорошими молекулярными ситами, с помощью которых разделяют молекулы разного размера (например, выделяют п-парафиновые углеводороды из бензиновых и керосиновых фракций нефтей).
Абсорбция
Абсорбция - это объемная сорбция газа или пара жидкостью, приводящая к образованию раствора. Распределение вещества между фазами подчиняется закону Генри. Каждый абсорбент способен поглощать в заметных количествах лишь определенные вещества, что позволяет использовать абсорбент для очистки от примесей (воды, сероводорода, оксида углерода), а также для разделения природных или попутных нефтяных газов, газов крекинга и пиролиза на определенные группы или индивидуальные углеводороды. Природные и попутные газы подвергают осушке и очистке на нефтепромыслах перед направлением их в магистральный газопровод, чтобы исключить образование гидратов и коррозию металлических труб. Эти газы, а также газы крекинга и пиролиза разделяют на нефтехимических заводах.
Абсорбция в промышленности осуществляется на абсорбционных
установках, основным аппаратом в которых служит поглотительная колонка
- абсорбер. В абсорбере имеются тарелки, как и в ректификационной колонне, или насадка (металлические или керамические фигурные тела). Газ, который требуется очистить, подается в нижнюю часть абсорбера, а абсорбент стекает вниз навстречу поднимающейся смеси газов и паров. С низа колонны уходит насыщенный извлеченными компонентами абсорбент, а с верха колонны остаточный газ.
Поглощение газов и паров абсорбентом происходит за счет физической
абсорбции или чаще всего в результате хемосорбции.
Для осушки газов в качестве абсорбента в основном применяют этиленгликоль, который поглощает воду за счет физической абсорбции.
Для очистки газа от сероводорода и диоксида углерода используют абсорбенты, образующие с ними легко разрушаемые соединения. При низких температурах примеси поглощаются абсорбентами, а при повышенных температурах или при продувке воздухом происходит регенерация поглотительного раствора и выделение диоксида углерода или сероводорода. Выделившийся сероводород отправляют на получение серной кислоты.
В качестве адсорбентов для очистки газов применяют:
1. Соли сильных оснований и слабых кислот (фосфаты, феноляты, карбонаты натрия или калия). Растворы карбонатов щелочных металлов, взаимодействуют с CO2 и Н2S по реакциям
Na2CO3+CO2+H2O2NaHCO3
Na2CO3+H2SNaHS+NaHCO3
Подобным образом реагируют с СО2 и Н2 феноляты и фосфаты калия и натрия.
2. Растворы моноэтаноламина HOCH2CH2NH2 и диэтаноламина (HOCH2CH2)2NH. Процесс поглощения моноэтаноламином идет по следующим реакциям:
HOCH2CH2NH2+ H2SHOCH2CH2NH3HS HOCH2CH2NH2+ CO2+H2OHOCH2CH2NH3HCO3
Абсорбционный метод широко применяют для выделения из
природных и нефтяных газов легких углеводородов и бензиновых фракций (газового бензина). В качестве абсорбента в этом случае используют керосиновые и легкие масляные фракции нефтей. Пары бензина почти полностью растворяются в масляной фракции, бутан и изобутан на 85-95 %, пропан на 75-80 %, этан на 25-30 %.
Метод абсорбции используют и для анализа газовых смесей. Метод основан на последовательном поглощении отдельных компонентов различными химическими поглотителями. Измеряя объем газа до и после абсорбции, по разности определяют количество поглощенного компонента или суммы компонентов (в об. %) реагирующих C данным поглотителем
Тема 7: Механика промывочных жидкостей и тампонажных растворов.
1 Адсорбция.
2. Абсорбция.
3. Поверхностно-активные вещества.
Адсорбция
Адсорбция - это явление самопроизвольного повышения концентрации газообразного или растворенного вещества на поверхности твердого тела или
жидкости в гетерогенных (неоднородных) системах. Различают физическую, или
Ван-дер-Ваальсову, адсорбцию и химическую, или хемосорбцию. Более общим термином, характеризующим самопроизвольное cгущение какого-то компонента на поверхности раздела двух фаз, является сорбция. При этом поглощающее вещество называется сорбентом, поглощаемое - сорбтивом. В зависимости от того, насколько глубоко проникают частицы сорбтива в сорбент, различают адсорбцию (вещество поглощается в поверхностном слое) и абсорбцию (вещество поглощается всем объемом тела).
В физикохимии буровых и тампонажных растворов велика роль как физических, так и химических поверхностных явлений. Они обусловливают такие
свойства этих систем, как устойчивость к коагулирующему действию электролитов, структурно-механические показатели. С адсорбционными явлениями связан механизм действия реагентов-стабилизаторов, понизителей вязкости и замедлителей сроков схватывания цементных растворов. Адсорбционные слои при физической
адсорбции имеют электрическую природу. Эти силы возникают при взаимодействии молекул с жестким (постоянным) диполем, жестким и индуцированным диполем, между неполярными молекулами, вследствие мгновенного дипольного момента и между молекулами при водородной связи. К химическим связям относятся ионные,
ковалентные и координационные.
Независимо от состава поверхностных слоев адсорбционные процессы характеризуются следующими общими свойствами.
Ø Процессы адсорбции обратимы и носят избирательный характер.
Частицы, находящиеся в адсорбционных слоях, не закреплены жестко, они могут выходить за пределы действия межмолекулярных сил, т.е. отрываться от адсорбента и уходить в окружающее пространство - десорбироваться. Со временем среднее число частиц, покинувших поверхностный слой, становится равным
числу адсорбируемых частиц за тот же период времени и в системе устанавливается адсорбционное равновесие.
Ø Процесс адсорбции экзотермичен, т.е. протекает с выделением тепла. В соответствии с принципом смещения равновесий (принцип Ле–Шателье). адсорбцию выгодно осуществлять при низких температурах.
Ø Абсорбция характеризуется малой энергией активации, т.е. малым энергетическим барьером, а следовательно, большой скоростью ее протекания.
Адсорбция - это самопроизвольный процесс повышения концентрации газообразных и растворенных веществ на границе раздела фаз, вызванный избытком свободной поверхностной энергии и сопровождающийся её; понижением за счет снижения (S=const).
Концентрированно газов и растворенных веществ на границе раздела
происходит в результате притяжения (поглощения) молекул, атомов или ионов из окружающей среды поверхностью вещества, обладающей нескомпенсированным силовым полем. Вещество, способное поглощать (адсорбировать) на своей поверхности другое вещество, называется адсорбентом, а вещество, которое поглощается - адсорбтивом.
В некоторых случаях молекулы поглощенного газа диффундируют
вглубь поглотителя и распределяются по всему объему. Такой процесс называется абсорбци