Нитрозные газы, полученные на стадии окисления аммиака, содержат оксид азота (II), азот, кислород и пары воды. При окислении оксида азота (II) в оксид азота (IV) в этой системе протекают три параллельных реакции:
1) 2NO + O2 2NO2 – ΔH, ΔH = 112,3 кДж,
2) 2NO2 N2O4 – ΔH, ΔH = 57,0 кДж,
3) NO2 + NO N2O3 – ΔH, ΔH = 40,0 кДж.
Все эти реакции обратимы, протекают в гомогенной системе с выделением тепла и уменьшением объема. Вследствие этого понижение температуры и повышение давления сдвигает равновесие их вправо.
Константа равновесия первой реакции окисления оксида азота (II) выражается уравнением:
 ,
,
и сильно зависит от температуры.
| tºC
|
|
|
|
|
|
|
| Kp
| 1,24∙1014
| 1,82∙108
| 8,5∙104
| 2,1∙10-3
| 5,6∙10-3
| 1,5∙10-3
|
Из таблицы следует, что при температурах ниже 100 ºС равновесие первой реакции почти полностью сдвинуто в сторону образования оксида азота (IV). При повышении температуры оно сдвигается влево и выше 700 ºС образования оксида азота (IV) практически не происходит. Так как нитрозные газы выходят из реактора при температуре около 800 ºС, в них оксид азота (IV) газы необходимо охладить ниже 100 ºС.
Обычно переработку нитрозных газов ведут при 10 – 50 ºС. В этих условиях часть оксида азота (IV) димеризуется в тетроксид N2O4. Степень димеризации его существенно зависит от температуры. При температуре выше 150 ºС равновесие второй реакции почти полностью сдвинуто влево и тетроксид азота в газе практически отсутствует. Даже при -20 ºС степень димеризации оксида азота (IV) не превышает 92%.
Скорости первой и второй реакций различны, поэтому соответствующие равновесия устанавливаются не одновременно. Первая реакция окисления протекает с меньшей скоростью, поэтому скорость всего процесса на этой стадии производства определяется именно скоростью окисления оксида азота (II), которая выражается общим для гомогенных реакций уравнением:
 .
.
Для этой реакции характерна аномальная зависимость ее скорости от температуры. Она ускоряется при понижении температуры и почти полностью прекращается с повышением температуры до определенного предела. Это объясняется особым механизмом окисления оксида азота (II) в оксид азота (IV), которое протекает в две стадии через образование промежуточного продукта – димера оксида азота (II):
2 NO N2O2 – ΔH,
N2O2 + O2 2NO2 – ΔH.
Реакция образования димера обратима, протекает с выделением тепла и значительно быстрее, чем реакция его последующего окисления. Поэтому при повышении температуры равновесие реакции образования димера сдвигается влево и равновесная концентрация димера в газе понижается. Так как скорость реакции окисления димера:

зависит от его концентрации, то уменьшение скорости при повышении температуры вызывает снижение скорости окисления димера и, следовательно, оксида азота (II) до оксида азота (IV).
Скорость реакции димеризации оксида азота (IV) в тетроксид весьма высока, поэтому равновесие второй реакции устанавливается практически мгновенно и соотношение оксидов NO2 : N2O4 определяется условиями этого равновесия, установившегося в газе.
Таким образом, понижение температуры и повышение давления в нитрозном газе способствует окислению оксида азота (II) в оксид азота (IV) и димеризации последнего.
Абсорбция оксида азота (IV)
Нитрозные газы, поступающие на абсорбцию, представляют сложную смесь различных оксидов азота (NO2, N2O4, NO, N2O), элементарного азота, кислорода и паров воды. Их состав зависит от условий окисления, то есть от состояния системы, описываемого тремя реакциями.
Все оксиды азота, входящие в состав нитрозных газов, нерастворимы в воде, но, за исключением оксида азота (II), взаимодействуют с ней. Поглощение их водой сопровождается химической реакцией хемосорбции, протекающей в системе «газ-жидкость», описываемой уравнениями:
2NO2 + H2O HNO3 + HNO2 – ΔH, ΔH = 116 кДж,
N2O4 + H2O HNO3 +HNO2 – ΔH, ΔH = 59 кДж
и распада нестойкой азотистой кислоты по уравнению:
3HNO2 HNO3 +2NO + H2O + ΔH, ΔH = 76 кДж.
Суммируя эти уравнения, получаем итоговые уравнения поглощения оксидов азота водой:
3NO2 г + H2O ж 2HNO3 ж + NO г – ΔH, ΔH = 136 кДж,
3N2O4 г + H2O ж 4HNO3 ж +2NO г – ΔH, ΔH = 101 кДж.
Из этих уравнений следует, что при абсорбции из трех моль оксида азота (IV) образуется два моля азотной кислоты и один моль оксида азота (II), который возвращается в цикл и снова окисляется до оксида азота (IV).
Механизм образования азотной кислоты при адсорбции оксида азота (IV) водой, а затем образующейся водной азотной кислотой, заключается в том, что оксид азота (IV) диффундирует через пограничный слой газа к поверхности жидкости и абсорбируется ею. При этом оксид азота (IV) реагирует с водой в первой реакции со скоростью, превышающей скорость диффузии и скорость реакции разложения азотистой кислоты в третьей реакции. Образующийся оксид азота (II) выделяется в газовую фазу, где окисляется кислородом до оксида азота (IV).
Скорость процесса абсорбции оксида азота (IV) водой описывается уравнения для гетерогенных процессов:
 ,
,
где Δp – движущая сила абсорбции,
 – парциальное давление NO2 в газовой фазе,
– парциальное давление NO2 в газовой фазе,
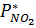 – равновесное давление NO2 у поверхности водного раствора азотной кислоты.
– равновесное давление NO2 у поверхности водного раствора азотной кислоты.
С повышением концентрации кислоты в процессе абсорбции возрастает равновесное давление оксида азота (IV) и снижается движущая сила процесса. Вследствие этого процесс абсорбции замедляется.
Состояние системы «NO2 – HNO3 – H2O» и, следовательно, концентрация получаемой азотной кислоты зависит от температуры, давления, парциального давления оксида азота (IV) в поглощаемой газовой смеси и концентрации образовавшейся кислоты. При понижении температуры и концентрации кислоты и повышения давления степень абсорбции оксида азота (IV) водной азотной кислотой возрастает, при том тем интенсивнее, чем выше концентрация его в нитрозных газах. При атмосферном давлении и температуре 25 ºС абсорбция оксида азота практически прекращается, когда концентрация кислоты достигнет 0,65 мас.долей.
Таким образом, возможность получения азотной кислоты концентрацией более 0,65 мас.дол. объективно ограничена температурой и давлением процесса абсорбции и содержанием оксида азота (IV) в нитрозных газах. В реальных условиях производства при температуре 40 ºС, давлении 0,1 МПа и понижении содержания оксида азота вследствие его поглощения из газа концентрация получаемой кислоты не превышает 0,5 мас.дол. Получение азотной кислоты более высокой концентрации требует иной технологии.
Степень абсорбции оксида азота (IV) непосредственно связана с абсорбционным объемом аппаратуры. Повышение степени абсорбции требует, особенно, в конце процесса, значительного увеличения абсорбционного объема. Так, если степень абсорбции, равная 0,92 дол.ед., может быть достигнута при Vаб = 22 м3/т кислоты, то для повышения ее до 0,98 дол.единицы, то есть на 6,5% абсорбционный объем должен быть увеличен до 70 м3/т. Так как увеличение абсорбционного объема вызывает резкое возрастание капитальных затрат, то экономически более выгодно не добиваться степени абсорбции выше 0,98 дол.ед., а поглощать остатки оксида азота (IV) в отходящих газах щелочными поглотителями с последующим окислением образовавшегося нитрита натрия концентрированной азотной кислотой и возвращением оксида азота (II) в цикл (инверсия оксида азота (II)):
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2,
3NaNO2 + 2HNO3 = 3NaNO3 + 2NO + H2O.



 ,
, .
.
 ,
, – парциальное давление NO2 в газовой фазе,
– парциальное давление NO2 в газовой фазе,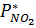 – равновесное давление NO2 у поверхности водного раствора азотной кислоты.
– равновесное давление NO2 у поверхности водного раствора азотной кислоты.


