МОСКОВСКОВСКИЙ ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ
МИТХТ
Кафедра Общей химической технологии
Курсовой проект
Производство азотной кислоты
Вариант 2
Работу выполнила: студентка
группы ХХБО-04-14
Преподаватель: Чабан Наталья Григорьевна
Москва, 2017
Оглавление
Введение. 4
Обоснование постановки задачи. 4
Сведения о применении целевого продукта и масштабах его производства. 4
Исходное сырье. 6
Характеристика сырья. 6
Этапы подготовки сырья в технологической схеме. 7
Характеристика целевого продукта. 9
4. Физико-химическое обоснование основных процессов производства целевого продукта и экологической безопасности производства. 10
Окисление аммиака до оксида азота (II). 10
Влияние температуры.. 12
Влияние состава АмВС. 13
Влияние давления. 13
Влияние времени контактирования. 14
Катализаторы.. 14
Окисление оксида азота (II) и димеризация оксида азота (IV). 16
Абсорбция оксида азота (IV). 18
Расчетные уравнения синтеза азотной кислоты.. 20
Охрана окружающей среды.. 20
5. Описание технологической схемы.. 24
Структурная и операторная схемы.. 26
6. Расчет материального баланса. 28
7. Расчет основных технологических показателей процесса. 35
8. Выводы.. 36
9. Список использованной литературы.. 37
Исходные данные
Содержание NH3 в аммиачно-воздушной смеси – 9,4 % по объему;
Степень превращения NH3 в NО – 93 %;
Степень переработки нитрозных газов в азотную кислоту – 95 %;
Концентрация НNО3 – 59 % по массе;
Содержание в выхлопных газах:
· кислороду – 3,0%
· воды – 2,6 % по объему;
Базис расчета – 1500 кг НNО3 в продукте.
Введение
Обоснование постановки задачи
Курсовая работа по дисциплинам «Основы химической технологии» и «Основы системных закономерностей технологических процессов» является одним из этапов инженерной подготовки. Её задачу составляют: качественный и количественный анализ ХТС, что позволяет дать оценку любому инженерному проекту в целом и дать основу для расчета курсовых проектов по специальным дисциплинам на современном уровне – инженера химика-технолога.
Сведения о применении целевого продукта и масштабах его производства
Азотная кислота – одна из важнейших минеральных кислот. По объему производства в химической промышленности она занимает второе место после серной кислоты. Азотная кислота широко применяется для производства многих продуктов, используемых в промышленности и сельском хозяйстве:
· около 40% ее расходуется на получение сложных и азотных минеральных удобрений;
· азотная кислота используется для производства
· синтетических красителей,
· взрывчатых веществ,
· нитролаков,
· пластических масс,
· лекарственных синтетических веществ и др.;
· железо хорошо растворяется в разбавленной азотной кислоте.
Концентрационная азотная кислота образует на поверхности железа тонкий, но плотный слой нерастворимого в концентрированной кислоте оксида, защищающего металл от дальнейшего разъедания. Эта способность железа пассивироваться используется для защиты его от коррозии.
Концентрированную азотную кислоту (особенно с добавлением 10% H2SO4) перевозят обычно в стальных цистернах. Многие органические вещества (в частности животные и растительные ткани) при действии HNO3 разрушаются, а некоторые из них от соприкосновения с очень концентрированной кислотой могут воспламеняться. В лабораторной практике обычно применяется азотная кислота, содержащая около 65% HNO3 (пл.1,40). В промышленности применяют два сорта азотной кислоты: разбавленную с содержанием 50–60% HNO3 и концентрированную, содержащую 96–98% HNO3.
Раньше, когда не существовало производства синтетического аммиака, азотную кислоту получали действием серной кислоты на чилийскую селитру. Объемы производств были очень небольшими, и кислота использовалась только для производства взрывчатых веществ, красителей и некоторых других химических продуктов. Сейчас азотную кислоту получают из синтетического аммиака и перерабатывают главным образом в азотные удобрения.
Исходное сырье
Характеристика сырья
Сырьем для получения азотной кислоты служат аммиак, воздух и вода.
Синтетический аммиак в большей или меньшей степени загрязнен примесями. Такими примесями являются катализаторная пыль, смазочное масло (при сжатии поршневым компрессором). Для получения чистого газообразного аммиака служат испарительные станции и дистилляционные отделения жидкого аммиака. Дальнейшая очистка осуществляется в фильтрах, состоящих из чечевицеобразных элементов, фильтрующим материалом в которых служит хлопчатобумажная замша. Тонкой очистке аммиачно–воздушная смесь подвергается в фильтре с поролитовыми трубками.
Атмосферный воздух, применяемый в производстве азотной кислоты, забирается на территории завода или вблизи его. Этот воздух загрязнен газообразными примесями и пылью. Поэтому он подвергается тщательной очистке во избежание отравления катализатора окисления аммиака. Очистка воздуха осуществляется, как правило, в скруббере, орошаемом водой, затем в двухступенчатом фильтре.
Вода, применяемая для технологических нужд, подвергается специальной подготовке: отстою от механических примесей, фильтрованию и химической очистке от растворенных в ней солей. Для получения реактивной азотной кислоты требуется чистый паровой конденсат, который дополнительно очищают от возможных примесей.
Этапы подготовки сырья в технологической схеме
Природный газ сжимают в компрессоре до давления 4,6 МПа, смешивают с азотоводородной смесью (АВС: газ = 1:10) и подают в огневой подогреватель, где реакционная смесь нагревается с 130-140 0С до 370-400 0С. Далее нагретый газ подвергают очистке от сернистых соединений: на алюмокобальтовом катализаторе проводится гидрирование сероорганических соединений до сероводорода, а затем в адсорбере сероводород поглощается сорбентом на основе оксида Zn. Обычно устанавливается два адсорбера, соединенные последовательно или параллельно. Один из них может отключаться на загрузку свежего сорбента. Содержание H2S очищенном газе не должно превышать 0,5 мл/м3 газа.
Очищенный газ смешивается с водяным паром в отношении 1:3,7 и полученная парогазовая смесь поступает конвекционную зону трубчатой печи. В радиационной камере печи размещены трубы, заполненные катализатором конверсии метана, и горелки, в которых сжигается природный или горючий газ. Парогазовая смесь подогревается в нагревателе до 525 0С и затем под давлением 3,7 МПа, распределяется сверху вниз по большому числу параллельно включенных труб, заполненных катализатором. Выходящая из трубчатого парогазовая смесь содержит 9-10 % CH4. При t=850 0C парогазовая смесь поступает в конвектор метана второй ступени – реактор шахтного типа. В верхнюю его часть компрессором подается технологический воздух, нагретый в зоне печи до 480-500 0С. Парогазовая и паровоздушная смеси поступают раздельными потоками в соотношении, требуемом для обеспечения практически полной конверсии метана и получения технологического газа с соотношением (CO+H2): N2=3,05 - 3,10.
Содержание водяного пара соответствует соотношению пар:газ=0,7:1. При температуре ≈ 1000 0С газ направляется в котел-утилизатор, вырабатывающий пар под давлением Р=10,5 МПа. Здесь реакционная смесь охлаждается до 380-420 0С и идет в конвектор СО первой ступени, где на железохромовом катализаторе протекает конверсия основного количества оксида углерода водяным паром. Выходящая из реактора газовая смесь (t=450 0С) содержит около 3,6 % СО. В паровом котле парогазовая смесь охлаждается до температуры 225 0С и подается в конвектор СО второй ступени, заполненный низкотемпературным катализатором, где содержание СО снижается до 0,5 %. Конвертируемый газ на выходе из конвектора имеет следующий состав (%)
H2-61,7;
CO-0,5;
CO2-17,4;
(N2+Ar)-20,1;
CH4-0,3.
После охлаждения и утилизации теплоты конвертируемый газ при температуре окружающей среды и давлении 2,6 МПа поступает на очистку.
Для очистки конвертированного газа от оксидов углерода применяют абсорционные, адсорбционные и каталитические методы очистки.
Отходящие газы (дымовые газы) крупных агрегатов производства аммиака образуются в результате сжигания природного газа в огневом подогревателе сероочистки и в трубчатой печи паровой конверсии. В этих газах содержатся оксиды азота. Отходящие газы очищают по методу каталитического восстановления при умеренных температурах. В качестве восстановителя выступает аммиак, с помощью которого происходит восстановление оксидов азота до элементарного азота.
Влияние температуры
Повышение температуры способствует увеличению скорости реакций и коэффициента диффузии аммиака в смеси и, поэтому, является наиболее эффективным средством, увеличения скорости процесса, протекающего преимущественно в диффузионной области. Это подтверждается термодинамическими данными.
| Реакция
| ΔН, кДж/моль
| ΔG, кДж/моль
|
| 298 ºК
| 1173 ºК
|
| 4NH3+5O2=4NO+6H2O
| -226,0
| -246,2
| -414,6
|
| 4NH3+3O2=2N2+6H2O
| -317,2
| -326,9
| -335,2
|
Из таблицы следует, что вероятность реакции окисления до оксида азота (II) с повышением температуры возрастает почти вдвое, а реакции окисления до азота почти не изменяется.
Влияние состава АмВС
Соотношение аммиака и кислорода в газовой смеси влияет на температурный режим и общую скорость процесса в том случае, если лимитирующей в нем является химическая реакция, то есть процесс протекает в кинетической области. При стехиометрическом соотношении компонентов в АмВС степень превращения аммиака в оксид азота (II) не превышает 0,65 дол.ед. Для увеличения выхода оксида азота (II) процесс ведут при отношении О2 : NH3 = 1,8 – 2,0, что соответствует содержанию в АмВС 0,095 – 0,105 об. долей аммиака и 0,18 – 0,19 об. долей кислорода. Избыток кислорода используется на стадии доокисления оксида азота (II), а указанный состав АмВС обеспечивает автотермичность процесса окисления и лежит за пределом взрывчатости АмВС.
Влияние давления
Повышение давления ускоряет процесс окисления аммиака за счет увеличения концентрации реагентов и производительности катализатора, что позволяет сократить размеры аппаратуры. При этом, однако, снижается выход оксида азота (II) и увеличивается эрозия и унос катализатора, что удорожает продукцию. Так, если при атмосферном давлении (105 Па) унос катализатора не превышает 0,05 г на тонну азотной кислоты, то при давлении 0,8 МПа он достигает 0,4 г/тонну.
Абсорбция оксида азота (IV)
Нитрозные газы, поступающие на абсорбцию, представляют сложную смесь различных оксидов азота (NO2, N2O4, NO, N2O), элементарного азота, кислорода и паров воды. Их состав зависит от условий окисления, то есть от состояния системы, описываемого тремя реакциями.
Все оксиды азота, входящие в состав нитрозных газов, нерастворимы в воде, но, за исключением оксида азота (II), взаимодействуют с ней. Поглощение их водой сопровождается химической реакцией хемосорбции, протекающей в системе «газ-жидкость», описываемой уравнениями:
2NO2 + H2O HNO3 + HNO2 – ΔH, ΔH = 116 кДж,
N2O4 + H2O HNO3 +HNO2 – ΔH, ΔH = 59 кДж
и распада нестойкой азотистой кислоты по уравнению:
3HNO2 HNO3 +2NO + H2O + ΔH, ΔH = 76 кДж.
Суммируя эти уравнения, получаем итоговые уравнения поглощения оксидов азота водой:
3NO2 г + H2O ж 2HNO3 ж + NO г – ΔH, ΔH = 136 кДж,
3N2O4 г + H2O ж 4HNO3 ж +2NO г – ΔH, ΔH = 101 кДж.
Из этих уравнений следует, что при абсорбции из трех моль оксида азота (IV) образуется два моля азотной кислоты и один моль оксида азота (II), который возвращается в цикл и снова окисляется до оксида азота (IV).
Механизм образования азотной кислоты при адсорбции оксида азота (IV) водой, а затем образующейся водной азотной кислотой, заключается в том, что оксид азота (IV) диффундирует через пограничный слой газа к поверхности жидкости и абсорбируется ею. При этом оксид азота (IV) реагирует с водой в первой реакции со скоростью, превышающей скорость диффузии и скорость реакции разложения азотистой кислоты в третьей реакции. Образующийся оксид азота (II) выделяется в газовую фазу, где окисляется кислородом до оксида азота (IV).
Скорость процесса абсорбции оксида азота (IV) водой описывается уравнения для гетерогенных процессов:
 ,
,
где Δp – движущая сила абсорбции,
 – парциальное давление NO2 в газовой фазе,
– парциальное давление NO2 в газовой фазе,
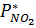 – равновесное давление NO2 у поверхности водного раствора азотной кислоты.
– равновесное давление NO2 у поверхности водного раствора азотной кислоты.
С повышением концентрации кислоты в процессе абсорбции возрастает равновесное давление оксида азота (IV) и снижается движущая сила процесса. Вследствие этого процесс абсорбции замедляется.
Состояние системы «NO2 – HNO3 – H2O» и, следовательно, концентрация получаемой азотной кислоты зависит от температуры, давления, парциального давления оксида азота (IV) в поглощаемой газовой смеси и концентрации образовавшейся кислоты. При понижении температуры и концентрации кислоты и повышения давления степень абсорбции оксида азота (IV) водной азотной кислотой возрастает, при том тем интенсивнее, чем выше концентрация его в нитрозных газах. При атмосферном давлении и температуре 25 ºС абсорбция оксида азота практически прекращается, когда концентрация кислоты достигнет 0,65 мас.долей.
Таким образом, возможность получения азотной кислоты концентрацией более 0,65 мас.дол. объективно ограничена температурой и давлением процесса абсорбции и содержанием оксида азота (IV) в нитрозных газах. В реальных условиях производства при температуре 40 ºС, давлении 0,1 МПа и понижении содержания оксида азота вследствие его поглощения из газа концентрация получаемой кислоты не превышает 0,5 мас.дол. Получение азотной кислоты более высокой концентрации требует иной технологии.
Степень абсорбции оксида азота (IV) непосредственно связана с абсорбционным объемом аппаратуры. Повышение степени абсорбции требует, особенно, в конце процесса, значительного увеличения абсорбционного объема. Так, если степень абсорбции, равная 0,92 дол.ед., может быть достигнута при Vаб = 22 м3/т кислоты, то для повышения ее до 0,98 дол.единицы, то есть на 6,5% абсорбционный объем должен быть увеличен до 70 м3/т. Так как увеличение абсорбционного объема вызывает резкое возрастание капитальных затрат, то экономически более выгодно не добиваться степени абсорбции выше 0,98 дол.ед., а поглощать остатки оксида азота (IV) в отходящих газах щелочными поглотителями с последующим окислением образовавшегося нитрита натрия концентрированной азотной кислотой и возвращением оксида азота (II) в цикл (инверсия оксида азота (II)):
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2,
3NaNO2 + 2HNO3 = 3NaNO3 + 2NO + H2O.
Охрана окружающей среды
Неуклонный рост производства азотной кислоты тесно связан с увеличением о6ъемаотходяших газов, а следовательно, с ростом количества выбрасываемых в атмосферу оксидов азота. Оксиды азота очень опасны для любых живых организмов. Некоторые растения повреждаются уже через 1 ч пребывания в атмосфере, содержащей 1 мг оксидов в 1 м3 воздуха. Оксиды азота вызывают раздражение слизистой оболочки дыхательных путей, ухудшение снабжения тканей кислородом и другие нежелательные последствия. Хвостовые газы производства азотной кислоты содержат после абсорбционных колонн от 0,05 до 0,2% оксидов азота, которые по санитарным требованиям без дополнительной очистки запрещено выбрасывать в атмосферу.
Радикальное решение проблем очистки хвостовых газов – каталитическое восстановление оксидов азота снижает их содержание в очищенном газе до 0,001-0,005%. что обеспечивает санитарные нормы по содержанию оксидов азота в приземном слое воздуха при мощностях производства кислоты до 1 млн т/год, сосредоточенных в одной точке и при высоте выброса 100-150 м. На ряде существующих предприятий по производству азотной кислоты под давлением применен метод очистки, в котором восстановителем является природный газ, а в качестве катализатора используется палладий на носителе, в качестве второго слоя катализатора — носитель (оксид алюминия). На катализаторе протекают следующие реакции:
CH4 + 202 CO2 + 2Н2О;
CH4 + 2NO2 N2 + 2Н2О + СО2;
CH4 + 4NO 2N2 + 2Н2О + СО2.
Метод обеспечивает снижение содержания оксидов азота в выхлопных газах до 0,005%. Теплота реакции используется для получения пара. Данный метод очистки органически связан с технологией производства азотной кислоты. Он нашел применение в агрегате, работающем под давлением 0,716 МПа, и в aгpeгaтe AK-72.
В качестве восстановителя вместо природного газа применяют также аммиак. Этот метод характеризуется тем, что на алюмованадиевом катализаторе аммиак реагирует только с оксидами азота, т. е. обеспечивает селективное восстановление:
4NH3 + 6NO 5N2 + 6H2О;
8NH3 + 6NO2 7N2 + 12H2О.
Одним из наиболее реальных способов утилизации оксидов азота, обеспечивающих санитарные нормы содержания оксидов азота в приземном слое атмосферы после рассеивания их из выхлопной трубы, является адсорбционно-десорбционный метод, в котором используется непрерывно циркулирующий сорбент (силикагель). Разработаны способы адсорбции на молекулярных ситах, промывки кислым раствором мочевины и другими промывными жидкостями. На современных установках получения азотной кислоты нет постоянных источников сточных вод. Эти установки потребляют большое количество оборотной охлаждающей воды. Растворы, периодически сливаемые из насосов и другого оборудования, например при проведении ремонта, собирают в приямок и нейтрализуют.



Схема производства азотной кислоты под давлением 0,716 МПа с приводом компрессора от газовой турбины:
1 – фильтр воздуха; 2 – реактор каталитической очистки; 3 – топочное устройство; 4 – подогреватель метана; 5 – подогреватель аммиака; 6 – смеситель аммиака и воздуха с пролитовым фильтром; 7 – холодильник-конденсатор; 8 – сепаратор; 9 – абсорбционная колонна; 10 – продувочная колонна; 11 – подогреватель отходящих газов; 12 – подогреватель воздуха; 13 – сосуд для окисления нитрозных газов; 14 – контактный аппарат; 15 – котел‑утилизатор; 16,18 – двухступенчатый турбокомпрессор; 17 – газовая турбина
Выводы
Исключительное значение азотной кислоты для многих отраслей народного хозяйства и оборонной техники и большие объемы производства обусловили интенсивную разработку эффективных и экономически выгодных направлений совершенствования азотнокислотного производства. К таким направлениям относятся:
— создание систем высокой единичной мощности (до 400 тыс. т/год), работающих по комбинированной схеме;
— разработка высокоактивных избирательно действующих неплатиновых катализаторов окисления аммиака;
— возможно более полное использование энергии сжатых отходящих газов и низкопотенциальной теплоты процессов путем создания полностью автономных энерготехнологических схем;
— создание замкнутого оборота охлаждающей воды;
— решение проблемы очистки отходящих газов с утилизацией оксидов азота путем внедрения адсорбционно-десорбционного метода очистки на силикагеле и цеолитах;
— возможно более полное удаление остатков оксидов азота из отходящих газов с использованием в качестве восстановителей горючих газов и аммиака.
Список использованной литературы
1. Общая химическая технология: Учеб. для вузов/А.М. Кутепов, Т.И. Бондарева, М.Г. Беренгартен - 3-е изд., перераб. – М.: ИКЦ «Академкнига», 2003. – 528 с.;
2. Соколов Р.С. Химическая технология: Учеб. пособие для студ. высш. учеб. заведений: В 2 т. – М.: Гуманит. изд. центр ВЛАДОС, 2000. – Т. 1: Химическое производство в антропогенной деятельности. Основные вопросы химической технологии. Производство неорганических веществ. – 368 с.;
3. Кононова Г.Н., Сафонов В.В., Егорова Е.В. Расчет материального баланса химико-технологических систем интегральным метод +ом. – М.: ИПЦ МИТХТ им. М.В. Ломоносова, 2007. - 30 с.;
Сборник заданий и методических указаний по расчету материального баланса химико-технологических производств. Учебно-методическое пособие. /Авт: Брук Л.Г., Егорова Е.В., Кононова Г.Н., Сафонов В.В., Смирнова С.Н., Чабан Н.Г., Шварц А.Л. Под ред. Брука Л.Г., Кононовой Г.Н., Сафонова В.В. Изд. 3-е, перераб. – М.: ИПЦ МИТХТ им. М.В. Ломоносова, 2008. – 72 с.
МОСКОВСКОВСКИЙ ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ
МИТХТ
Кафедра Общей химической технологии
Курсовой проект



 ,
, – парциальное давление NO2 в газовой фазе,
– парциальное давление NO2 в газовой фазе,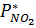 – равновесное давление NO2 у поверхности водного раствора азотной кислоты.
– равновесное давление NO2 у поверхности водного раствора азотной кислоты.




