Цель работы: научиться составлять уравнения окислительно-восстановительных реакции, изучить влияние различных факторов на протекание окислительно-восстановительных процессов.
ВЛИЯНИЕ КОНЦЕНТРАЦИИ ОКИСЛИТЕЛЯ НА ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЙ ПРОЦЕСС
(Демонстрационно)
ОПЫТ 1.1. Исследуйте влияние разбавленной и концентрированной азотной кислоты на медь. Отметьте условия, при которых протекают данные реакции. Для какого иона характерна появившаяся окраска раствора? Какой газ выделяется в первом и втором случаях?
Напишите уравнения реакций, используя метод электронного баланса, и отметьте цвет выделяющегося газа. Укажите, сколько молей азотной кислоты выполняют роль солеобразователя в обеих реакциях.
ВЛИЯНИЕ КОНЦЕНТРАЦИИ ОКИСЛИТЕЛЯ НА ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЙ ПРОЦЕСС
(Демонстрационно)
ОПЫТ 2.1. К кристаллам дихромата калия добавьте концентрированной соляной кислоты и нагрейте содержимое пробирки. Как меняется цвет раствора? Какой газ выделяется? Образованием каких ионов хрома обусловлено изменение окраски раствора? Составьте уравнение реакции, используя метод электронного баланса. Укажите сколько молей кислоты выполняют роль восстановителя и роль среды.
Составьте уравнение реакции взаимодействия концентрированной соляной кислоты с кристаллическим перманганатом калия, используя метод электронного баланса. Укажите сколько молей кислоты расходуется как восстановителя и сколько на образование солей.
ВЛИЯНИЕ СРЕДЫ НА ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА ИСХОДНЫХ ВЕЩЕСТВ
ОПЫТ 3.1. В три пробирки налить по 3 капли раствора перманганата калия. В одну пробирку добавить 2 капли раствора серной кислоты, во вторую – столько же воды, в третью – такое же количество щелочи. Во все три пробирки внести кристаллический сульфит натрия. Перемешать растворы до полного растворения кристаллов.
Написать уравнение реакций, используя метод электронного баланса. Отметить изменение окраски перманганата калия, имея в виду, что соединения марганца в различных степенях окисления имеют характерные окраски: ион MnO4– имеет фиолетовую окраску, ион MnO42– – зеленую, ион Mn2+ – бесцветный. Оксид марганца MnO2 – труднорастворимое вещество бурого цвета.
Используя метод электронного баланса, напишите реакции взаимодействия перманганата калия с сульфитом натрия в кислой, нейтральной и щелочной средах.
ИЗМЕНЕНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ СВОЙСТВ АТОМОВ ЭЛЕМЕНТОВ С ПРОМЕЖУТОЧНОЙ СТЕПЕНЬЮ ОКИСЛЕНИЯ
ОПЫТ 4.1. В одну пробирку налить 3 - 4 капли раствора дихромата калия, а во вторую – иодида натрия. В обе пробирки добавить по 3 - 4 капли серной кислоты и кристаллического нитрита калия. Как изменилась окраска в первой пробирке? Что произошло во второй пробирке? Написать уравнения проведенных реакций.
Закончить уравнения следующих реакций, расставив коэффициенты, используя метод электронного баланса:
1. Zn + KNO2 + KOH +H2O → NH3 +K2[Zn(OH)4]
2. KNO2 + PbO2 + HCl → KNO3 + PbCl2 + H2O
Окислительные или восстановительные свойства проявляет нитрит калия?
Сделать выводы по данным опытам.
Контрольные вопросы
1. Какой процесс называется окислением?
2. Какой процесс называется восстановлением?
3. Какова классификация окислительно-восстановительных реакций?
4. Привести примеры влияния среды на протекание окислительно-восстановительных реакций.
Лабораторная работа № 4
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Цель работы: изучение явления комплексообразования, свойств и способов получения некоторых комплексов; исследование диссоциации комплексных и двойных солей и химических реакций с их участием.
Теоретическая часть
Сложные химические соединения, получившие название комплексных, состоят из внутренней (координационной) и внешней сферы. Внутренняя сфера называется комплексным ионом. Например, в комплексном соединении [Ni(NH3)6]SO4 комплексным ионом или внутренней сферой является ион [Ni(NH3)6]2+, а внешней сферой - ион SO42-.
Комплексное соединение в растворе диссоциирует на комплексный ион и ион внешней сферы. Диссоциация протекает по типу сильных электролитов и называется первичной диссоциацией (I ступень):

В растворах диссоциация протекает преимущественно по первой ступени.
Комплексный ион диссоциирует по типу слабых электролитов, т.е. в незначительной мере – вторичная диссоциация (II ступень):

Константа, отвечающая этому равновесию, называется константой нестойкости (Кн) комплексного иона:
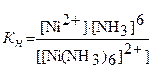
Константа нестойкости характеризует каждый комплексный ион и является мерой устойчивости комплекса. Чем устойчивее комплексный ион, тем меньше его константа нестойкости.
Комплексы бывают катионные – комплексный ион заряжен положительно [Cu(H2O)4]Cl2, анионные K4[Fe(CN)6] – комплексный ион отрицательный. Нейтральные комплексы состоят только из внутренней сферы - [Сг(СО)6], поэтому они обычно не диссоциируют и их растворы не проводят электрический ток и их часто называют неорганическими неэлектролитами.
ОПЫТ 1. Образование соединений с комплексным катионом.
Поместить в две пробирки по 3 - 4 капли раствора сульфата меди и добавить в одну из них две капли хлорида бария, а в другую - раствора щелочи. На присутствие каких ионов в растворе указывают образовавшиеся осадки? Написать уравнения реакций.
Поместить в пробирку 4 - 5 капель раствора сульфата меди и по каплям добавить раствор аммиака до образования осадка гидроксосульфата меди. К раствору с осадком добавить раствор аммиака до растворения осадка в результате образования комплексной соли - аммиаката меди. Написать уравнения реакций получения гидроксосульфата и аммиаката меди (координационное число меди равно 4).
Полученный раствор аммиаката меди разделить на две части и провести те же два опыта, которые были проделаны с раствором сульфата меди. Образуется ли осадок гидроксида меди? На основании проделанных опытов написать уравнение диссоциации аммиаката меди.
ОПЫТ 2. Образование соединения с комплексным анионом.
К двум каплям раствора нитрата серебра добавить раствор хлорида калия до образования осадка. К осадку по каплям прилить раствор тиосульфата натрия Na2S2O3 до его растворения вследствие образования тиосульфатного комплекса серебра (координационное число серебра равно двум). Написать уравнения протекающих реакций.
К раствору тиосульфатного комплекса серебра прибавить 1 - 2 капли хлорида калия. Образуется ли осадок хлорида серебра? Написать уравнение диссоциации тиосульфатного комплекса серебра.
ОПЫТ 3. Прочность комплексных ионов и разрушение комплексов.
К 2 - 3 каплям концентрированного раствора хлорида кобальта (II) добавить концентрированный раствор роданида аммония NH4CNS до изменения окраски в результате образования роданидного комплекса кобальта. Написать уравнения реакции (координационное число кобальта равно 4).
Убедиться в устойчивости полученного соединения, добавляя по каплям дистиллированную воду до изменения окраски, обусловленной заменой лигандов CNS- на H2О. Написать уравнение реакции, учитывая, что координационное число кобальта в аквакомплексе равно шести. Написать уравнение диссоциации комплексных ионов [Co(CNS)4]2- и [Со(Н2О)6]2+ и выражения констант нестойкости. Объяснить, почему происходит замена лигандов.
ОПЫТ 4. Реакции обмена с участием комплексных соединений.
К 2 - 3 каплям раствора сульфата меди добавить такой же объем раствора комплексной соли K4[Fe(CN)6]. Отметить цвет образовавшегося осадка. Написать уравнение реакции в молекулярной и ионной формах.
ОПЫТ 5. Диссоциация двойных солей.
Проделать качественные реакции на ионы Fe3+ и SO42-. Для этого к 2 -3 каплям раствора хлорида железа (III) добавить 1 - 2 капли раствора роданида аммония NH4CNS. Отметить цвет образовавшегося осадка роданида железа. Написать уравнение реакции.
К 2 - 3 каплям раствора сульфата натрия добавить 1-2 капли хлорида бария. Отметить цвет осадка. Написать уравнение реакции.
Внести в две пробирки по 1 - 2 капли раствора двойной соли NH4Fe(SO4)2. В одну пробирку добавить 1 - 2 капли раствора роданида аммония, а в другую – 1 - 2 капли раствора хлорида бария. Отметить происходящие в результате реакций изменения. Написать уравнения реакций.
На основании проделанных опытов записать уравнение электролитической диссоциации двойной соли. Сделайте вывод по работе на основании проделанных опытов.
Контрольные вопросы
1. Каков механизм образования донорно-акцепторной связи? Укажите донор в следующих комплексных ионах: [Ni(NH3)6]2+, [SiF6]2-, [HgI4]2-
2. Орбитали каких энергетических уровней в ионе Cr3+ принимают участие в образовании химической связи в комплексном ионе [Cr(NH3)6]3+.
3. Приведите пример катионного и анионного комплексных соединений для Cr3+. Координационное число Сг3+ равно 6.
4. Роданид калия KCNS при добавлении к раствору соли (NH4)2SO4×Fe(SO4)3 связывает ион Fe3+ в роданид железа, а при добавлении к раствору соли 3KCN×Fe(CN)3 – не связывает. Какая из этих солей двойная, а какая комплексная? Приведите уравнения диссоциации обеих солей в водных растворах.
Лабораторная работа № 5.